开心散对抑郁模型大鼠海马CX3CL1-CX3CR1信号轴的影响*
2021-11-22肖望重
肖望重,胡 青,唐 林,戴 冰,黄 莉
(湖南中医药大学第一附属医院,湖南 长沙 410007)
抑郁症是一种以悲伤、绝望、快感缺乏为主要特征,并伴有严重自杀倾向的情感障碍性疾病,其发病率和死亡率在逐年增加[1]。抑郁症的病因病机复杂,目前多认为其发生发展与单胺神经递质失衡、神经突触可塑性损伤有关,近年来抑郁症的细胞因子假说也备受关注[2]。研究表明,慢性应激后体内细胞因子水平发生改变,如炎症因子、趋化因子、生长因子等异常表达,造成神经毒性,同时激活神经内分泌-下丘脑-垂体-肾上腺轴(HPA轴),进一步加重体内炎症等反应,损伤海马神经元,导致抑郁症发生[3]。CX3CL1是一种特殊的趋化因子,在神经元中广泛表达,通过与其受体CX3CR1结合,直接调节外周和中枢神经元兴奋传递,并能介导小胶质细胞与神经元之间的信号交流[4-5]。开心散是治疗情志疾病的经典名方,出自唐代孙思邈《千金要方·卷十四》,由人参、远志、茯苓、石菖蒲四味药物组成,全方有益气养心、安神定志的功效。开心散的现代研究主要集中在质量控制、制备工艺、成分及药效研究,涉及深入分子机制的研究很少,本研究从CX3CL1-CX3CR1信号轴探讨了开心散抗抑郁的作用机理。
1 材料与方法
1.1 实验动物6周龄SPF级雄性SD大鼠60只,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004,动物合格证号:1107271911005090,饲养于湖南中医药大学实验动物中心SPF级动物房,实验期间饲养室温度为(22±2)℃,相对湿度为(60±5)%,光照时间为12 h/12 h明暗交替。实验经湖南中医药大学实验动物中心动物伦理委员会审核通过,批准号:LLBH-201909150001。
1.2 药物与试剂开心散由人参、远志、茯苓、石菖蒲四味药组成,原药材均购自湖南中医药大学第一附属医院,由本院药剂科唐林药师鉴定为正品。人参用8倍体积的70%乙醇提取2次,合并提取液,过滤,人参药渣备用;将人参药渣与茯苓、远志、石菖蒲混合,加入10倍体积的水提取2次,合并药液,浓缩,加乙醇使药液含醇量达50%,冷藏过夜。将水提醇沉滤液与人参提取液合并,充分回收乙醇,浓缩,减压干燥,制得浸膏,计算浸膏得率为11.4%,保存待用。氟西汀(礼来苏州制药有限公司,规格:20 mg,批号:H20180015),人用剂量为每天60 mg;5-羟色胺(5-HT)ELISA试剂盒(批号:SD9540)、多巴胺(DA)ELISA试剂盒(批号:SD9563)均购自上海碧云天公司;CX3CL1抗体(批号:bs-0811R)、CX3CR1抗体(批号:bs-1728R)均购自北京博奥森;免疫组化试剂盒(武汉博士德,批号:AR1027)。
1.3 主要仪器敞箱自制;RT-6100酶标仪(深圳雷杜公司);HS-3345全自动组织切片机(金华市华速科技有限公司);Axio Scope A1正置荧光显微镜(德国Zeiss公司);ChemiDocXRS+化学发光凝胶成像仪(美国BIO-RAD公司)。
1.4 造模与分组大鼠适应性喂养5 d后,进行旷场测试,根据评分值将大鼠随机分为正常组、模型组、开心散低剂量组、开心散高剂量组、氟西汀组,每组12只。采用经典的慢性不可预见性温和应激(CUMS)方法建立大鼠抑郁模型[6-7],应激源包括:潮湿垫料24 h,昼夜颠倒24 h,禁水禁食24 h,夹尾1 min,4℃冰水浴5 min,80 dB噪声12 h,束缚6 h。每天随机采用上述1种应激方法,7 d为1个周期,同种应激不连续出现,共造模4周。造模期间大鼠均单笼饲养。造模完成后模型大鼠旷场实验自主活动评分低于正常组(P<0.05),强迫游泳实验不动时间高于正常组(P<0.05),即判断造模成功。
1.5 实验给药大鼠在应激造模1周后开始灌胃给药,给药量按照70 kg成人与200 g大鼠体表面积等效换算(成人剂量×0.018/0.2),开心散低、高剂量组大鼠给予临床等效1倍、4倍剂量的中药溶液(2.7、10.8 g/kg),氟西汀组大鼠给予临床等效2倍剂量的氟西汀水溶液(10.8 mg/kg),正常组与模型组大鼠则给予等量蒸馏水,灌胃体积为10 mL/kg,连续给药21 d。末次给药后,所有大鼠进行行为学测试,测试完成后麻醉大鼠,部分取脑组织固定于多聚甲醛溶液中,分离部分海马组织于液氮中冻存,转移至超低温冰箱中备用。
1.6 观察指标
1.6.1 行为学测试 (1)旷场测试:将大鼠放入底部均匀划分为25个方格的自制黑色敞箱中央,待大鼠自由探索1 min后,记录4 min内穿越格子次数,记为自主活动评分;(2)强迫游泳实验:将大鼠放入特制强迫游泳筒中,大鼠会剧烈挣扎以免沉落水下,记录5 min内的不动时间(停止游动,身体呈漂浮状态)。
1.6.2 大鼠海马组织5-HT和NE的含量 每组取6份大鼠海马组织充分匀浆,离心后取上清液。按照ELISA试剂盒检测步骤进行操作,酶标仪上读取OD值,绘制标准曲线,计算各组大鼠海马组织5-HT和NE的含量。
1.6.3 大鼠海马区组织病理学改变 取6份固定充分的脑组织脱水、石蜡包埋、切片,将切片于恒温箱中烘干,二甲苯脱蜡后置于苏木精-伊红染液中染色,经脱水、透明、封片后于光学显微镜下观察海马区组织病理变化情况,并进行拍照分析。
1.6.4 免疫组化法检测海马组织CX3CL1、CX3CR1平均光密度值 取6份脑组织脱水、包埋、切片、脱蜡,3%H2O2中室温浸泡10 min,蒸馏水冲洗,PBS浸泡5 min,微波炉中蒸煮进行热抗原修复,加入5%山羊血清封闭非特异性位点,PBS洗涤,加入CX3CL1、CX3CR1一抗(1∶100)4℃冰箱中孵育过夜;洗涤,滴加二抗室温下孵育30 min,洗涤,滴加DAB染液,苏木素复染5 min,梯度乙醇脱水,中性树胶封片,待片子晾干后拍照。使用Image-pro Plus软件分析目的蛋白的积分光密度值。
1.6.5 Western blotting法检测海马组织CX3CL1、CX3CR1蛋白相对表达量 取6份海马组织加入1 mL组织裂解液冰上裂解30 min,离心,取上清液,测定总蛋白含量。根据目的蛋白分子量制备分离胶和浓缩胶,将样本于100℃加热5 min使蛋白变性,每个孔道上样50 μg,80 V恒压SDS-PAGE电泳至溴酚蓝到达分离胶底部,300 mA电流转膜60 min,采用脱脂奶粉封闭2 h,根据分子量裁剪条带,加入CX3CL1、CX3CR1一抗(1∶1 000)于4℃冰箱孵育过夜。一抗孵育结束后,TBST液洗涤条带,加入HRP标记的二抗(1∶1 000)继续孵育4 h,洗涤,化学发光法显影。应用Image J软件分析条带灰度值,GAPDH为内参蛋白,计算目的蛋白的相对表达量。
1.7 统计学方法采用SPSS 25.0统计软件分析数据,所有计量资料以(±s)表示,多组间比较采用单因素方差分析,满足方差齐性时,多组间均数的两两比较采用LSD法,不满足方差齐性时,多组间均数的两两比较采用Dunnett's T3法。以P<0.05为差异有统计学意义。
2 结 果
2.1 开心散对抑郁大鼠行为学的影响与正常组比较,模型组大鼠自主活动评分明显降低(P<0.01),强迫游泳不动时间明显延长(P<0.01);与模型组比较,开心散高剂量组和氟西汀组大鼠自主活动评分明显升高(P<0.01),强迫游泳不动时间明显缩短(P<0.01);开心散低剂量组大鼠自主活动评分高于模型组(P<0.05),强迫游泳不动时间与模型组比较,差异无统计学意义(P>0.05);与氟西汀组比较,开心散低剂量组大鼠强迫游泳不动时间明显延长(P<0.01);开心散高剂量组大鼠自主活动评分及强迫游泳不动时间与氟西汀组比较,差异无统计学意义(P>0.05)。(见表1)
表1 各组大鼠自主活动评分和强迫游泳不动时间比较(±s)

表1 各组大鼠自主活动评分和强迫游泳不动时间比较(±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与氟西汀组比较,dP>0.05,eP<0.01
组别 动物数(只)给药剂量 自主活动评分(分) 强迫游泳不动时间(s)正常组 12 - 55.17±11.40 10.67±5.63模型组 12 - 31.17±7.11a 52.75±11.09a氟西汀组 12 10.8 mg/kg 50.67±9.46c 19.50±6.26c开心散高剂量组12 10.8 g/kg 52.17±11.96c d 23.33±9.07c d开心散低剂量组12 2.7 g/kg 44.00±9.46b 45.25±13.53e
2.2 开心散对抑郁大鼠海马单胺递质的影响与正常组比较,模型组大鼠海马5-HT、DA含量明显降低(P<0.01);与模型组比较,开心散高剂量组和氟西汀组大鼠海马5-HT、DA含量均明显升高(P<0.01或P<0.05);开心散低剂量组大鼠海马5-HT、DA含量与模型组比较,差异无统计学意义(P>0.05);与氟西汀组比较,开心散低剂量组大鼠海马5-HT含量明显降低(P<0.01)。(见表2)
表2 各组大鼠海马单胺递质含量比较(±s,ng/mL)

表2 各组大鼠海马单胺递质含量比较(±s,ng/mL)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与氟西汀组比较,dP<0.01
组别 动物数(只)给药剂量 5-HT DA正常组 6 - 108.10±13.20 117.20±9.38模型组 6 - 87.17±8.96a 87.28±11.07a氟西汀组 6 10.8 mg/kg 105.20±6.23c 100.10±5.65b开心散高剂量组6 10.8 g/kg 102.00±5.88b 101.50±7.37b开心散低剂量组6 2.7 g/kg 85.92±5.71d 94.83±9.03
2.3 开心散对抑郁大鼠海马组织形态的影响HE染色结果显示,正常组大鼠海马区神经元分布均匀,排列规则,未见明显凋亡神经元;模型组大鼠海马区神经元可见明显凋亡,数量减少,排列不规则,胞核深染,空泡细胞多;氟西汀组大鼠海马区神经元数量明显增加,排列相对规则,凋亡神经元减少;开心散高剂量组大鼠海马区神经元数量明显增加,排列整齐规则,空泡细胞及深染细胞数减少;开心散低剂量组大鼠海马区神经元数量有一定程度的增加,排列相对整齐,空泡细胞数较模型组减少。(见图1)

图1 各组大鼠海马区组织病理学改变情况(HE,×200)
2.4 各组大鼠海马组织CX3CL1、CX3CR1平均光密度值比较与正常组比较,模型组大鼠,海马组织CX3CL1、CX3CR1平均光密度值显著增加(P<0.01);与模型组比较,氟西汀组和开心散高剂量组大鼠海马组织CX3CL1、CX3CR1平均光密度值显著降低(P<0.01或P<0.05);与氟西汀组比较,开心散低剂量组大鼠海马组织CX3CR1平均光密度值增加(P<0.05)。(见图2~3、表3)
表3 各组大鼠海马CX3CL1、CX3CR1平均光密度值比较(±s)

表3 各组大鼠海马CX3CL1、CX3CR1平均光密度值比较(±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与氟西汀组比较,dP<0.05
组别 动物数(只)给药剂量 CX3CL1 CX3CR1正常组 6 - 0.39±0.02 0.53±0.04模型组 6 - 0.49±0.03a 0.67±0.05a氟西汀组 6 10.8 mg/kg 0.42±0.02c 0.55±0.04c开心散高剂量组 6 10.8 g/kg 0.44±0.02b 0.57±0.04c开心散低剂量组 6 2.7 g/kg 0.47±0.04 0.62±0.03d

图2 各组大鼠海马CX3CL1蛋白阳性表达情况(免疫组化,×200)

图3 各组大鼠海马CX3CR1蛋白阳性表达情况(免疫组化,×200)
2.5 各组大鼠海马组织CX3CL1、CX3CR1蛋白表达水平比较与正常组比较,模型组大鼠海马组织CX3CL1、CX3CR1蛋白表达显著增加(P<0.01);与模型组比较,开心散高剂量组、氟西汀组大鼠海马组织CX3CL1、CX3CR1蛋白表达显著降低(P<0.01);与氟西汀组比较,开心散低剂量组大鼠海马组织CX3CL1、CX3CR1表达显著增加(P<0.01),开心散高剂量组大鼠海马组织CX3CR1表达显著增加(P<0.05)。(见图4、表4)

图4 各组大鼠海马CX3CL1/CX3CR1蛋白Western blotting图
表4 各组大鼠海马CX3CL1、CX3CR1蛋白相对表达量比较(±s)
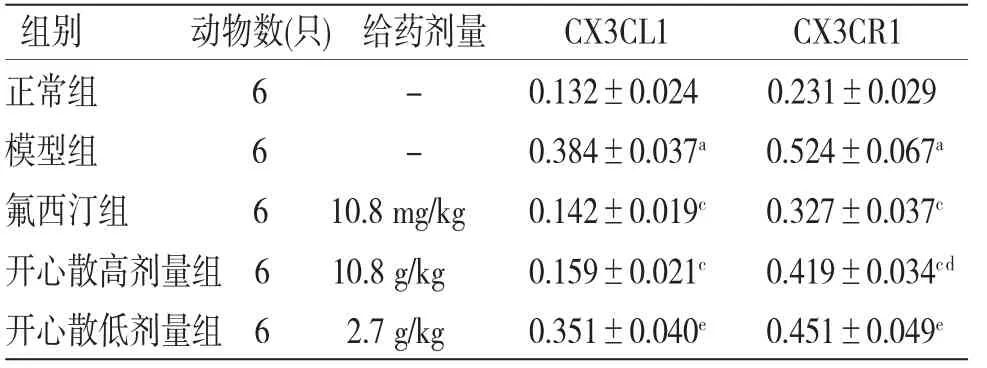
表4 各组大鼠海马CX3CL1、CX3CR1蛋白相对表达量比较(±s)
注:与正常组比较,aP<0.01;与模型组比较,cP<0.01;与氟西汀组比较,dP<0.05,eP<0.01
组别 动物数(只)给药剂量 CX3CL1 CX3CR1正常组 6 - 0.132±0.024 0.231±0.029模型组 6 - 0.384±0.037a 0.524±0.067a氟西汀组 6 10.8 mg/kg 0.142±0.019c 0.327±0.037c开心散高剂量组6 10.8 g/kg 0.159±0.021c 0.419±0.034cd开心散低剂量组6 2.7 g/kg 0.351±0.040e 0.451±0.049e
3 讨 论
开心散是古代医家治疗情志疾病的经验方,由人参、远志、茯苓、石菖蒲组成。方中人参大补元气,安神益智;远志宁心安神,祛痰开窍;茯苓健脾宁心;石菖蒲豁痰开窍,四味药均有益心智、宁心神的功效,全方以补为主,标本兼顾,共奏益气养心、安神定志功效。抑郁症以情绪低落、兴趣减退、学习记忆衰退为主要特征,患者表现为肝气郁结、心脾两虚、心神不宁等证候,且超过90%患者伴随着焦虑情绪或睡眠障碍[8-9]。开心散作为宁心安神的代表方剂,是研究最为广泛的抗抑郁中药组方之一。目前,开心散抗抑郁药理作用主要涉及调节神经递质[10]、神经营养[11]、褪黑素[12]、炎症因子[13]、海马结构功能保护[14]等方面,尚未有从趋化性细胞因子层面探讨其功效的报道。
趋化因子也称为趋化素,是一种能够吸引白细胞到炎症或损伤位点的细胞因子,分为CXC(α)、CC(β)、CX3C(δ)和C(γ)4个家族。研究表明,CC和CX3C家族与神经系统疾病的发生关联紧密,如CCL2的表达水平与抑郁症状呈正相关[15],CCL3通过活化免疫细胞参与调节中枢神经炎症[16]。CX3CL1是CX3C家族重要成员,其可剂量依赖性地减少大鼠的自主探索活动,引发抑郁症状[17]。研究表明,CX3CL1是介导小胶质细胞和神经元之间通讯机制的关键因子,其高水平表达会激活小胶质细胞,后者是中枢的免疫细胞,激活后会持续释放炎症因子产生神经毒性[18]。抑郁状态下,CX3CL1与其受体CX3CR1耦联,小胶质细胞突起逐渐缩短消失成阿米巴状,炎症级联反应发生,神经元受损,给药抗抑郁药文拉法辛治疗后小胶质细胞形态恢复,CX3CR1表达降低[19]。同时也有研究表明,缺乏CX3CR1小胶质细胞形态也会发生明显改变,并产生焦虑和抑郁样行为[20]。可见,CX3CL1-CX3CR1轴的平衡能够影响小胶质细胞的功能平衡,并对神经元产生影响。在本研究中,抑郁模型大鼠海马CX3CL1与CX3CR1表达高于正常大鼠,提示CX3CL1-CX3CR1轴处于激活状态,并对大鼠行为表征产生了影响;而经氟西汀和开心散干预后,其表达逐渐恢复平衡。
本研究发现,开心散能够明显改善抑郁模型大鼠的自主活动及行为绝望,升高海马单胺神经递质的水平,其机制与调控CX3CL1-CX3CR1轴有关。本研究从趋化因子水平探讨开心散抗抑郁药理机制,为该方的进一步开发应用提供了实验依据。
