灵芝三萜对鼻咽癌小鼠免疫功能及T细胞亚群分化的影响
2021-11-22王玲玲阿依恒曲库尔汗
王 松,王玲玲,阿依恒·曲库尔汗
(新疆医科大学第一附属医院,新疆 乌鲁木齐 830054)
鼻咽癌是发生于鼻咽腔侧壁、顶部的恶性肿瘤,常见表现为鼻塞、耳闷堵感、头痛、听力下降、涕中带血等,对患者健康、生命构成了威胁[1]。目前,鼻咽癌主流疗法为同步放化疗,疗效尚可,但对免疫系统造成了极大破坏,不利于康复、转归[2]。有研究表明[3],鼻咽癌发病与免疫功能下降有关,因而增强鼻咽癌患者免疫功能是改善预后的途径之一。灵芝是担子菌纲多孔科灵芝属真菌,为补益类中药,有扶正固本、延年益寿等功效。研究发现[4],灵芝及其提取物有抗肿瘤、降血脂、增强免疫力等作用。灵芝三萜是灵芝重要组成成分,灵芝的多种药理活性与其相关。故本研究拟观察灵芝三萜对鼻咽癌小鼠模型免疫功能的影响,以期为灵芝三萜用于鼻咽癌免疫治疗提供理论依据。
1 材 料
1.1 实验动物4周龄SPF级Balb/c小鼠65只,雌雄各半,体质量20~25 g,购自南方医科大学实验动物中心,动物生产许可证号:SCXK(粤)2016-0015。实验前适应性饲养1周,饲养条件为室温22~26℃,湿度40%~60%,自然光照,自由摄食水。本实验经医学实验动物管理委员会批准,批准号:20190511。
1.2 细胞株人低分化鳞状上皮鼻咽癌细胞株CNE-2,购自南方医科大学附属第一医院生物研究室。
1.3 药物与试剂灵芝三萜(纯度>99%,日本第一药品产业株式会社,批号:20181209);重组人干扰素α1b注射液(北京三元基因药业股份有限公司;批准文号S20040010)。小鼠免疫球蛋白A(Immunoglobulin A,IgA)ELISA检测试剂盒(批号:20190922)、免疫球蛋白G(Immunoglobulin G,IgG)ELISA检测试剂盒(批号:20190813)、免疫球蛋白M(Immunoglobulin M,IgM)ELISA检测试剂盒(批号:20190907)均购自武汉华美生物工程有限公司;白细胞介素-10(interleukin-10,IL-10)ELISA检测试剂盒(武汉华美生物工程有限公司,批号:20190821);转化生长因子-β(transforming growth factor-β,TGF-β)ELISA检测试剂盒(武汉华美生物工程有限公司,批号:20190719)。
1.4 主要仪器GB204型电子天平(瑞士特勒公司);SAF-680T酶标仪(上海旦鼎国际贸易有限公司);Cytomics TM FC500型流式细胞仪(美国Beckman Coulter公司)。
2 方 法
2.1 分组与造模65只Balb/c小鼠留取10只作为对照组,不作任何处理,其余建立鼻咽癌小鼠模型[5],将小鼠置入24 h光照调节动物饲养箱内饲养3周,取CNE-2鼻咽癌细胞在5%CO2、37℃条件下的RPMI培养基中培养,每隔2 d传代1次,收集对数生长期肿瘤细胞系细胞,胰酶消化,1 500 r/min离心5 min,计数后配制成1.0×107个/mL单细胞悬液。无菌条件下,小鼠右侧背部皮下接种单细胞悬液,10 d后小鼠右侧背部皮下出现可触及绿豆大小的肿瘤块,往后每隔1周测量1次肿瘤直径,接种21 d时肿瘤体积在100 mm3以上表示建模成功。55只小鼠共建模成功44只,随机分为模型组、干扰素组、低剂量组、高剂量组,每组11只。
2.2 实验给药低、高剂量组大鼠分别灌胃给予灵芝三萜溶液,剂量分别为25、50 mg/kg,灌胃体积均为0.2 mL/10 g,1次/d;干扰素组大鼠肌内注射40 000 U/mL重组人干扰素α1b注射液,隔天1次;模型组、对照组大鼠灌胃给予生理盐水,0.2 mL/10 g,1次/d;各组大鼠均干预4周。
2.3 观察指标
2.3.1 肿瘤质量、抑瘤率、胸腺指数、脾脏指数 干预4周后,观察小鼠精神状态、二便、饮食、毛色、活动情况等方面指标,每周测定1次小鼠背上肿瘤体积变化,并记录数据。末次给药24 h后,颈椎脱臼处死小鼠,剥离肿瘤、胸腺、脾脏,肿瘤剥离后立即浸入10%多聚甲醛溶液中固定,称重后计算抑瘤率、胸腺指数、脾脏指数。抑瘤率=(模型组肿瘤质量-治疗组肿瘤质量)/模型组肿瘤质量×100%;胸腺(脾脏)指数=胸腺(脾脏)质量(mg)/体质量(g)。
2.3.2 血清IgA、IgG、IgM、IL-10、TGF-β 小鼠颈椎脱臼处死前,眼球取血,EDTA抗凝,室温静置0.5 h,3 000 r/min离心10 min,离心半径10 cm,取上清液。参考ELISA试剂盒说明书,采用双抗体夹心法检测,配置IgA、IgG、IgM、IL-10、TGF-β标准品,采用标本稀释液按1:2 000比例稀释,取标准品各50 μL依次加入酶标板一排6孔内,其他各孔加入稀释液稀释的小鼠血清50 μL。加入50 μL生物素标记的抗体,加盖后37℃反应1 h。弃液甩干,洗板5次,每次浸泡1~2 min,200 μL/孔,甩干,依序每个孔加入底物溶液90 μL,37℃避光显色20 min,依序加终止液50 μL,终止反应。酶标仪在450 nm波长依序测量各孔光密度值(OD值),加入终止液后15 min内检测,实验3次,取平均值。
2.3.3 小鼠脾脏T淋巴细胞亚群CD3+、CD4+、CD8+检测 取小鼠脾脏,剔除结缔组织、脂肪组织,称重后置于尼纶网上,再将尼纶网置入PBS液,轻压脾脏组织,将单个核细胞经网置入PBS液,吸取PBS液置入15 mL离心管内,2 000 r/min离心5 min,离心半径10 cm,弃上清,加入1 mL PBS,震荡混匀,离心后弃上清,加入PBS,调整细胞浓度为107个/mL。取流式管,加入CD3e FITC抗体1 μL、CD4 PE抗体0.625 μL、CD8a PE-Cy5抗体0.625 μL,再加入107个/mL脾细胞悬液100 μL,混匀后加入流式管(已预先加入了流式抗体),混匀后避光孵育15 min,再加入OptiLyseC 500 μL,立刻混匀,剧烈震荡30 s,室温避光孵育15 min,加入1 mL PBS,混匀后1 000 g离心5 min,离心半径10 cm,弃上清,细胞沉淀加入500 μL流式鞘液重悬,上机检测,实验3次,取平均值。对淋巴细胞作FICT、PE、PE-Cy5荧光强度检测,其中FICT为荧光1(FL1),PE为荧光2(FL2),PE-Cy5为复合荧光4(FL4)。
2.4 统计学方法采用SPSS 20.0统计学软件分析,计量资料以(±s)表示,肿瘤体积、肿瘤质量、抑瘤率、胸腺指数、脾脏指数、免疫球蛋白水平及脾T淋巴细胞亚群指标水平均经Levene检验提示方差齐,进行单因素方差分析和LSD-t比较。P<0.05为差异有统计学意义。
3 结 果
3.1 各组小鼠一般状况对照组小鼠毛色、二便、饮食、活动状态均正常,体形无明显改变。55只建模小鼠第10天时,44只小鼠体内出现大小不等的肿瘤结节,成瘤率为80.00%(44/55)。与对照组小鼠比较,模型组小鼠行动迟缓,皮毛蓬松无光泽,饮食下降,肿瘤体积逐渐增大,体质量因瘤体增大而增加;低剂量组、高剂量组和干扰素组小鼠行为、皮毛、饮食情况等均有所改善,肿瘤体积伴随用药时间延长而逐渐减小。(见图1)
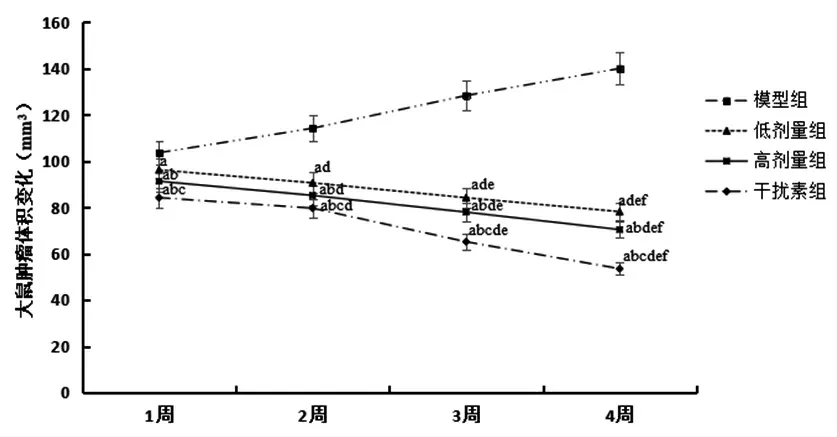
图1 各组小鼠给药后肿瘤体积变化比较(±s)
3.2 各组小鼠肿瘤质量与抑瘤率比较与模型组比较,低剂量组、高剂量组、干扰素组小鼠肿瘤质量降低(P<0.05);与低剂量组比较,高剂量组、干扰素组小鼠肿瘤质量降低(P<0.05),抑瘤率升高(P<0.05);与高剂量组比较,干扰素组小鼠肿瘤质量降低(P<0.05),抑瘤率升高(P<0.05)。(见表1)
表1 各组小鼠肿瘤质量及抑瘤率比较(±s)
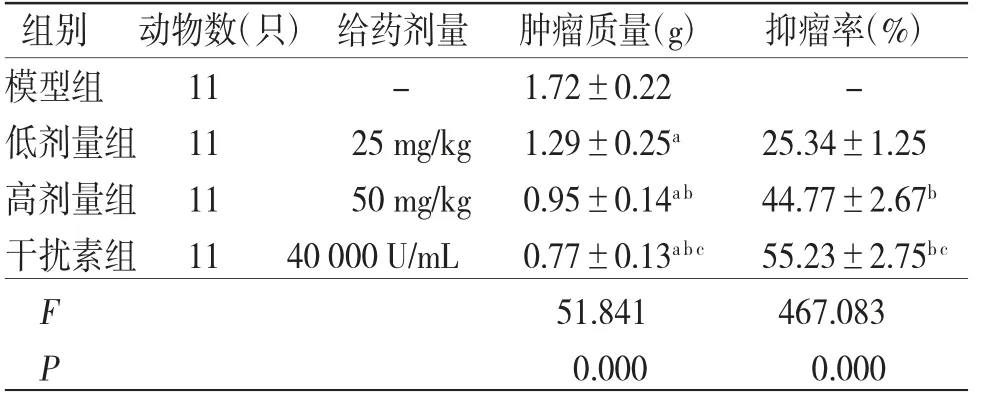
表1 各组小鼠肿瘤质量及抑瘤率比较(±s)
注:与模型组比较,aP<0.05;与低剂量组比较,bP<0.05;与高剂量组比较,cP<0.05
组别 动物数(只)给药剂量 肿瘤质量(g) 抑瘤率(%)模型组 11 - 1.72±0.22 -低剂量组11 25 mg/kg 1.29±0.25a 25.34±1.25高剂量组11 50 mg/kg 0.95±0.14a b 44.77±2.67b干扰素组11 40 000 U/mL 0.77±0.13a b c 55.23±2.75b c F 51.841 467.083 P 0.000 0.000
3.3 各组小鼠胸腺指数与脾脏指数比较与对照组比较,模型组、低剂量组、高剂量组、干扰素组小鼠胸腺指数和脾脏指数均降低(P<0.05);与模型组比较,低剂量组、高剂量组、干扰素组小鼠胸腺指数和脾脏指数均升高(P<0.05);与低剂量组比较,高剂量组、干扰素组小鼠胸腺指数和脾脏指数均升高(P<0.05);与高剂量组比较,干扰素组小鼠胸腺指数和脾脏指数均升高(P<0.05)。(见表2)
表2 各组小鼠胸腺指数与脾脏指数比较(±s,mg/g)

表2 各组小鼠胸腺指数与脾脏指数比较(±s,mg/g)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只) 给药剂量 胸腺指数 脾脏指数对照组 10 - 3.31±0.36 6.05±0.32模型组 11 - 2.08±0.15a 3.88±0.25a低剂量组11 25 mg/kg 2.34±0.11a b 4.31±0.24a b高剂量组11 50 mg/kg 2.66±0.23a b c 4.99±0.28a b c干扰素组11 40 000 U/mL 3.01±0.29a b c d 5.51±0.35a b c d F 44.180 96.775 P 0.000 0.000
3.4 各组小鼠血清IgA、IgG、IgM水平比较与对照组比较,模型组、低剂量组、高剂量组、干扰素组小鼠血清IgA、IgG、IgM水平均降低(P<0.05);与模型组比较,低剂量组、高剂量组、干扰素组小鼠血清IgA、IgG、IgM水平均升高(P<0.05);与低剂量组比较,高剂量组、干扰素组小鼠血清IgA、IgG、IgM水平均升高(P<0.05);与高剂量组比较,干扰素组小鼠血清IgA、IgG、IgM水平均升高(P<0.05)。(见表3)
表3 各组小鼠血清IgA、IgG、IgM水平比较(±s,μg/mL)

表3 各组小鼠血清IgA、IgG、IgM水平比较(±s,μg/mL)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只) 给药剂量 IgA IgG IgM对照组 10 - 54.63±3.21 433.65±10.28 588.34±10.14模型组 11 - 36.31±1.75a 342.26±9.12a 533.15±8.39a低剂量组11 25 mg/kg 40.39±1.69ab 380.47±8.47ab 541.18±7.24ab高剂量组11 50 mg/kg 45.28±1.28abc 401.45±8.26abc 552.63±6.41abc干扰素组11 40 000 U/mL 50.36±0.97abcd 419.85±7.74abcd 570.17±5.17abcd F 158.955 178.508 90.577 P 0.000 0.000 0.000
3.5 各组小鼠血清IL-10、TGF-β水平比较对照组比较,模型组、低剂量组、高剂量组、干扰素组小鼠血清IL-10、TGF-β水平均升高(P<0.05);与模型组比较,低剂量组、高剂量组、干扰素组小鼠血清IL-10、TGF-β水平均降低(P<0.05);与低剂量组比较,高剂量组、干扰素组小鼠血清IL-10、TGF-β水平均降低(P<0.05);与高剂量组比较,干扰素组小鼠血清IL-10、TGF-β水平均降低(P<0.05)。(见表4)
表4 各组小鼠血清IL-10、TGF-β水平比较(±s,ng/L)

表4 各组小鼠血清IL-10、TGF-β水平比较(±s,ng/L)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只) 给药剂量 IL-10 TGF-β对照组 10 - 16.24±0.69 27.56±2.22模型组 11 - 31.35±1.25a 59.67±3.67a低剂量组11 25 mg/kg 29.48±0.55ab 55.31±3.23ab高剂量组11 50 mg/kg 26.18±0.78ab c 40.34±2.28ab c干扰素组11 40 000 U/mL 22.67±1.03ab cd 30.59±2.54ab cd F 490.389 276.071 P 0.000 0.000
3.6 各组小鼠脾脏T淋巴细胞亚群变化比较与对照组比较,模型组、低剂量组、高剂量组、干扰素组小鼠脾脏CD3+、CD4+、CD8+T淋巴细胞占比及CD4+/CD8+比值均降低(P<0.05);与模型组比较,低剂量组、高剂量组、干扰素组小鼠脾脏CD3+、CD4+T淋巴细胞占比及CD4+/CD8+比值均升高(P<0.05);与低剂量组比较,高剂量组、干扰素组小鼠脾脏CD3+、CD4+T淋巴细胞占比及CD4+/CD8+比值均升高(P<0.05);与高剂量组比较,干扰素组小鼠脾脏CD3+、CD4+T淋巴细胞占比及CD4+/CD8+比值均升高(P<0.05)。(见图2、表5)
表5 各组小鼠小鼠脾脏CD3+、CD4+、CD8+T淋巴细胞亚群比较(±s)
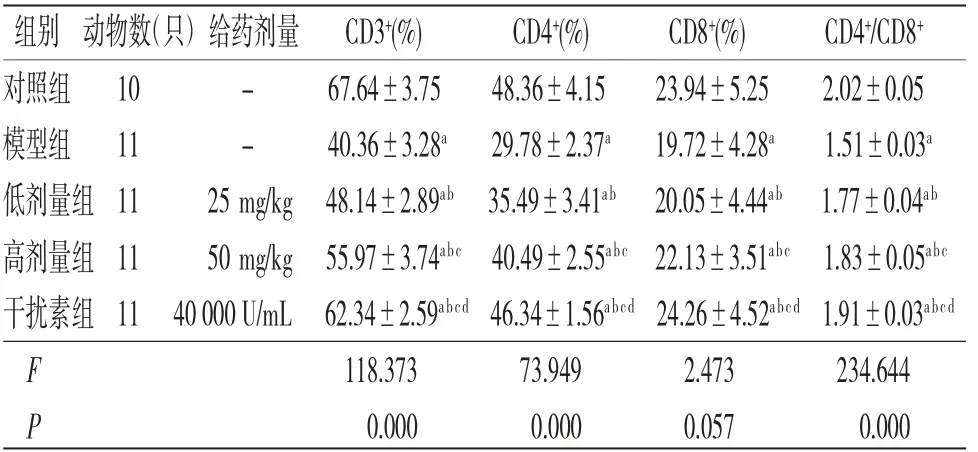
表5 各组小鼠小鼠脾脏CD3+、CD4+、CD8+T淋巴细胞亚群比较(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只)给药剂量 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+对照组 10 - 67.64±3.75 48.36±4.15 23.94±5.25 2.02±0.05模型组 11 - 40.36±3.28a 29.78±2.37a 19.72±4.28a 1.51±0.03a低剂量组11 25 mg/kg 48.14±2.89ab 35.49±3.41ab 20.05±4.44ab 1.77±0.04ab高剂量组11 50 mg/kg 55.97±3.74abc 40.49±2.55abc 22.13±3.51abc 1.83±0.05abc干扰素组11 40 000 U/mL 62.34±2.59abcd 46.34±1.56abcd 24.26±4.52abcd 1.91±0.03abcd F 118.373 73.949 2.473 234.644 P 0.000 0.000 0.057 0.000
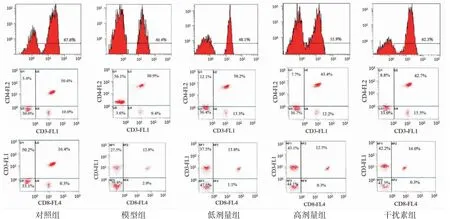
图2 各组小鼠脾脏CD3+、CD4+、CD8+T淋巴细胞占比
4 讨 论
鼻咽癌发病隐匿,确诊时多进展至晚期,尽管目前研究已对其早期诊断、治疗等方法进行了深入研究,但迄今仍未取得突破性进展,其防治工作依然是医学界重要研究课题。鼻咽癌发病机制尚不清楚,病因涉及免疫功能下降、EB病毒感染、遗传因素、饮食环境等[6]。鼻咽部解剖复杂,这一点决定了手术危险性,目前以放化疗为主,但存在非特异毒性、放疗耐受、远处转移、免疫低下等弊端[7]。我国传统医学主张以中药治疗鼻咽癌,国外也将中药作为补充替代医学进行过研究[8]。中医学强调“正气存内,邪不可干”,这一独特切入点反映在鼻咽癌治疗中主要表现为调节阴阳平衡,改善免疫功能,以抵抗病邪,可弥补放化疗的不足。
灵芝三萜是灵芝药用功效的主要活性成分,药理活性广泛,有抗肿瘤、增强免疫功能等效应,适宜作为低毒性辅助性药物治疗鼻咽癌。灵芝作为天然植物类药物,抗肿瘤作用早有报道,但灵芝三萜用于鼻咽癌治疗研究的报道鲜见[9]。本研究为了解灵芝三萜抗鼻咽癌活性及作用机制,通过种植CNE-2鼻咽癌细胞建立鼻咽癌小鼠模型。结果表明,与对照组比较,造模小鼠毛色、二便、饮食、活动状态及体质量均有异常改变,经灵芝三萜干预后明显改善;进一步计算肿瘤质量与抑瘤率,从模型组到低剂量组、高剂量组、干扰素组,小鼠肿瘤质量依次下降,高剂量组、干扰素组抑瘤率高于低剂量组,提示灵芝三萜用于鼻咽癌治疗中可抑制肿瘤生长,改善小鼠一般状况,尤以高剂量灵芝三萜为佳,其效果仅次于干扰素。干扰素是一种兼有抗病毒、抗肿瘤作用的免疫增强剂,在肿瘤治疗中可发挥抑制肿瘤、增强免疫功能的双重作用,适宜用于鼻咽癌放化疗时辅助治疗。现代医学认为[10-11],机体免疫功能与肿瘤产生、发展密切相关,但宿主免疫功能受抑制时,肿瘤发生风险大,且肿瘤增长时免疫功能受抑制,二者互为因果,因此调节机体免疫功能是防治癌症的关键步骤之一。
胸腺是中枢免疫器官,主要参与细胞免疫,负责调节机体免疫功能,可分泌多种细胞因子,促进T细胞成熟,在建立自身免疫耐受、维持免疫自稳方面发挥着不可或缺的作用[12]。脾脏为外周免疫器官,是T淋巴细胞、B淋巴细胞定居及产生免疫应答的场所,淋巴细胞、巨噬细胞丰富,与体液免疫关系密切[13]。胸腺与脾脏的质量与其免疫细胞数量、功能有关,二者脏器指数可反映机体免疫功能[14]。本研究结果显示,从模型组到低剂量组、高剂量组、干扰素组,小鼠胸腺指数和脾脏指数依次升高,提示灵芝三萜可增强鼻咽癌小鼠免疫功能。IgG是人工主动免疫后机体产生的抗体,是个体发挥免疫功能的主力;IgM是体液免疫应答中最早产生的抗体,在早期免疫中发挥重要作用;IgA是外分泌液中主要抗体,与IgG、IgM共为人体重要免疫球蛋白,可结合外界抗原,发挥防御、保护作用[15]。肿瘤已经发展出多种机制逃避免疫监视,产生免疫抑制细胞因子即重要因素之一,TGF-β是目前已知的最强免疫抑制因子。由T细胞生成TGF-β是抑制免疫应答的重要因素。研究发现[16],抑制肿瘤源性TGF-β可控制肿瘤增长,延长荷瘤小鼠存活率。IL-10是一种多效性细胞因子,具有双向免疫调节作用,可通过抗原提呈细胞发挥免疫抑制作用,在肿瘤环境中对免疫应答可发挥负向调节作用[17]。本研究结果显示,从模型组到低剂量组、高剂量组、干扰素组,小鼠血清IgA、IgG、IgM水平逐渐升高,IL-10、TGF-β水平逐渐下降,提示灵芝三萜可增强鼻咽癌小鼠免疫功能,推测这是灵芝三萜抑制鼻咽癌生长的机制之一。肿瘤免疫反应主要指细胞免疫反应,以T细胞亚群为主导,包括CD3+、CD4+、CD8+等。CD3+是成熟T细胞特征性标志,代表T淋巴细胞总数;CD4+是辅助性T细胞,主要辅助B细胞生成抗体,发挥杀瘤作用;CD8+细胞为抑制性T细胞,对细胞免疫有负调节作用,可对靶细胞产生细胞毒作用,抑制免疫作用。CD4+/CD8+比值降低提示机体处于免疫抑制状态,可能诱发或加快肿瘤生长。脾脏在鼻咽癌患者细胞免疫中占主导地位,故本研究观察了脾脏T淋巴细胞亚群分化情况。结果显示从模型组到低剂量组、高剂量组、干扰素组,小鼠脾脏CD3+、CD4+T淋巴细胞占比及CD4+/CD8+比值依次升高,提示灵芝三萜可提高T淋巴细胞标志物水平,进一步表明灵芝三萜可刺激细胞免疫,带动整个机体免疫力恢复。
综上所述,灵芝三萜可提高鼻咽癌小鼠胸腺指数和脾脏指数,提高血清IgA、IgG、IgM水平,降低血清IL-10、TGF-β水平,抑制肿瘤生长,其作用机制可能与调节T细胞亚群分化,增强鼻咽癌小鼠免疫功能有关。
