蒙药古日古木对自身免疫性肝炎INF-γ/STAT1通路的作用
2021-11-22杨冬冬谭真真张子英马丽杰
李 莎, 杨冬冬, 谭真真, 张子英, 金 蓉, 马丽杰*
(1.内蒙古医科大学基础医学院药理学教研室, 呼和浩特 010110; 2.中国医学科学院药物研究所, 北京 100050)
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种由肝细胞自身免疫介导进行性的肝脏疾病[1]。自1950年6月首次被报道[2]以来,人们对AIH的特征的认识逐渐加深,这类疾病的检出率逐年升高[3],自身免疫性肝炎以女性为主,发病年龄呈双峰型,发病高峰是儿童和中年人,尤其是更年期的妇女[4]。
古日古木,即中药红花(CarthamustinctoriusL.)为菊科植物。传统蒙药成方中,古日古木-13是由红花、丁香、莲子、诃子、川楝子、桅子、麦冬、木香、紫檀香、麝香、银朱、水牛角浓缩粉、牛黄组成的水丸,又称红花清肝十三味丸。古日古木-13出自《中华人民共和国卫生部药品标准》(蒙药分册)。临床实践中主要应用于肝热性病中,如脂肪肝、病毒性肝炎、药物性肝损伤等[5]。研究证明,古日古木通过减少氧自由基生成、抑制一氧化氮(nitric oxide,NO)合成、减少转化生长因子1(transforming growth factor 1,TGF-1)和基质金属蛋白酶抑制剂-1(TIMP-1)表达等途径发挥减轻肝损伤的作用。古日古木中的诃子具有增加白介素2(interleukin-2,IL-2)分泌同时减少白介素8(interleukin-8,IL-8),进而降低肿瘤坏死因子(tumor necrosis factorα,TNF-α)生成减少炎性反应的作用。而栀子也可以通过清除自由基、调节肝微粒酶作用等途径有效的保护肝损伤。另外,麦冬、莲子、麝香、牛黄等也被证明具有保护肝功能的作用[5]。胡建燃等[6]的研究发现红花作为活血化瘀类中药可以清除活性氧自由基,具有体外抗氧化和抗补体活性,表明可以在一定程度上应用于自身免疫性疾病的治疗。本课题组前期研究证明,古日古木和古日古木-13对CCl4造成的小鼠急性肝损伤具有明显的保护作用,可能通过提高小鼠肝脏超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛(malondialdehyde,MDA)及NO含量实现的[7-8]。而在CCl4诱导的小鼠慢性肝损伤模型中,古日古木-13通过降低C-Jun、C-Fos蛋白表达,增加肝再生增强因子ALR表达,并抑制C-Jun氨基末端激酶(C-Jun N-terminal kinase,JNK)信号激活等途径发挥减轻肝损伤、促进肝修复的作用[9]。本课题组前期研究证明古日古木和古日古木-13也可降低血清碱性磷酸酶(alkaline phosphatase,ALP)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)等肝脏转化酶而对刀豆蛋白A(concanavalin A,Con A)诱导的免疫性肝损伤具有保护作用。
在Con A诱导的AIH模型中,IFN-γ/细胞内信号传导与转录激活子1(signal transducer and activator of transcription1,STAT1)/血管细胞粘附分子-1(vascular cell adhesion molecule-1,VCAM-1)信号通路发挥了重要作用[10]。探讨古日古木和古日古木-13对这条通路的影响可能揭示出它们的可能的分子内作用机制之一,为它们在AIH中的应用和进一步研究奠定基础。
基于此,现应用现代药理学方法探讨蒙药古日古木单、复方对Con A诱导的小鼠急性自身免疫性肝损伤的保护作用,探索它们对INF-γ/STAT1/VCAM-1信号通路的影响。
1 材料与仪器
1.1 实验动物
BALB/c小鼠,体重(18±2) g,雌性,8~10周龄,由斯贝福(北京)生物技术有限公司提供,动物许可证号:SCXK(京)2011-0004。小鼠饲养于室温、湿度55%、12 h昼夜节律的环境中,不限食水,适应性喂养7 d后进行实验。
1.2 主要药物与试剂
古日古木,即红花草药,购自同仁堂大药房。古日古木-13(红花清肝十三味丸),由内蒙古蒙药股份有限公司生产,批号:150152。用研钵将古日古木研磨成细粉,过80目筛。加1%吐温80研磨均匀,分别加蒸馏水溶解并稀配成40、80、160 mg/kg混悬液,用即古日古木低剂量、中剂量、高剂量灌胃液,用前摇匀。古日古木-13灌胃液配制方法同古日古木。
地塞米松磷酸钠注射液,由郑州卓峰制药有限公司生产,批号:150722184,加入生理盐水配制成0.002 mg/kg的灌胃液。丙氨酸转移酶(ALT)测定试剂盒(批号:201603);碱性磷酸酶(ALP)测定试剂盒(批号:201601);刀豆蛋白A(SLBR620V,Sigma公司);肿瘤坏死因子-α(TNF-α)测定试剂盒(批号:201601-1);干扰素-γ(IFN-γ)测定试剂盒(批号:201603-4)(南京博尔迪公司);细胞凋亡检测试剂盒(批号:4293719,BD公司);兔单克隆抗VCAM1抗体(批号:GR257919-27);羊抗兔抗IgG抗体(批号:GR297013-1)兔多克隆抗STAT1抗体(批号:GR1095-11);α-Tublin(批号:GR286515-3)(Abcam公司);兔多克隆p-STAT1抗体(批号:0018,Cell Signaling 公司)NC膜(0.45 μmol/L,批号:MM0006,Pull公司);ECL Western Blot显色试剂盒(批号:RE230466);BCA蛋白定量试剂盒(批号:RL242684,Thermo 公司)。
1.3 主要仪器与设备
酶标仪Multiskan MK3(美国Thermo公司);电泳仪(美国Bio-Rad公司);Mastercycler Gradient高速低温离心机(德国eppendorf公司);FACS Calibur 流式细胞仪(BD公司);LeicaCTR6000荧光显微镜(Leica 公司);Tanon-5200化学发光图像分析仪(北京原平皓生物技术公司)。
2 方法
2.1 动物分组给药与模型建立
90只雌性BALB/c小鼠随机分为9组,即空白对照组、模型对照组、阳性对照组、古日古木低、中、高剂量组、古日古木-13低、中、高剂量组。古日古木和古日古木-13低、中、高各剂量组分别给予古日古木和古日古木-13 400、800、1 600 mg/kg进行灌胃;阳性对照组给予0.02 mg/kg地塞米松灌胃;空白组和模型组给予等体积蒸馏水灌胃。连续灌胃7 d。末次给药1 h后,尾静脉注射给予除空白对照组外各组小鼠20 mg/kg的Con A。
2.2 细胞因子检测
小鼠麻醉下心脏取血,室温下静置30 min,1 000 r/min,低温离心20 min,分离血清。酶联免疫吸附测定法(enzyme linked immunosorbent assay, ELISA)检测血清中TNF-α和IFN-γ水平。具体操作步骤按照试剂盒说明书进行。
2.3 TUNEL 法检测肝细胞凋亡
TdT-mediated dUTP Nick-End labeling(TUNEL)检测试剂盒实验说明书说明进行操作。将组织石蜡切片脱蜡至水,蛋白酶K(proteinase K) 37 ℃反应30 min,磷酸盐缓冲盐溶液(phosphate buffered saline, PBS)洗3遍。用配置好的TUNEL反应液37 ℃避光反应60 min,PBS洗3次。Streptavidin-Fluorescein标记液37 ℃避光反应30 min,PBS洗3次。DAB(diaminobenzidine)显色,苏木素复染3 s后冲洗,梯度酒精脱水,二甲苯透明,封片。光学显微镜下观察。
2.4 流式细胞术检测肝细胞凋亡
取新鲜的肝组织剪碎制成细胞悬液,加入结合缓冲液(1×binding Buffer)重悬细胞,调整浓度为106cells/mL,每管加5 μL 膜联蛋白V(annexin V)和2.5 μL碘化丙啶(propidine iodide, PI)于重悬细胞液中,避光孵育15 min,最后加400 μL 1×binding Buffer后使用流式细胞仪进行检测,Annexin V为绿色荧光代表早期凋亡细胞,PI将核染为红色,标记中晚期凋亡细胞。
2.5 蛋白质免疫印迹法(WB)检测各组小鼠肝组织STAT1、p-STAT1、VCAM-1表达
提取小鼠肝细胞总蛋白,BCA法测定蛋白含量,聚丙烯酰胺凝胶电泳1.5 h,电转2 h,脱脂奶粉封闭,加入一抗稀释液4 ℃孵育过夜,加入二抗稀释液室温孵育1 h,洗膜缓冲液(tris buffered saline tween,TBST)洗3次,每次10 min;超敏化学发光显影液发光,仪器摄影。
2.6 统计学处理
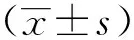
3 结果分析
3.1 对小鼠血清中炎性细胞因子水平的影响
与空白对照组相比,模型对照组TNF-α和IFN-γ水平显著升高,差异具有统计学意义(P<0.05),与模型对照组相比,古日古木-13中、高剂量TNF-α水平显著降低(P<0.05)。古日古木高剂量组、古日古木-13对自身免疫性肝损伤有保护作用且作用强度呈剂量依赖性,保护作用可能是通过降低炎性细胞因子IFN-γ实现的,如表1所示。

表1 对ConA所致小鼠肝损伤TNF-α、IFN-γ活力的影响Table 1 Effect of TNF-α and IFN-γ activity in liver injury induced by Con A in mice
3.2 古日古木、古日古木-13对肝细胞凋亡的影响
TUNEL标记定位于肝细胞核,正常肝细胞核蓝染,凋亡肝细胞核呈棕黄色。空白对照组肝细胞排列整齐,结构清晰,胞质淡染,细胞核呈蓝色且体积较大。模型对照组细胞结构破坏,界限不清,绝大部分细胞核皱缩并出现棕黄色着染,提示这些这些细胞已经发生凋亡,其余未染色细胞变小,胞膜完整但出现发泡现象。各给药组的肝细胞均出现不同程度的细胞核皱缩、着染。其中古日古木各剂量组着染程度较重,古日古木-13各剂量组着染程度较轻,提示复方各剂量组对干细胞凋亡的保护作用较显著,尤其是复方中剂量组和高剂量组,如图1所示。
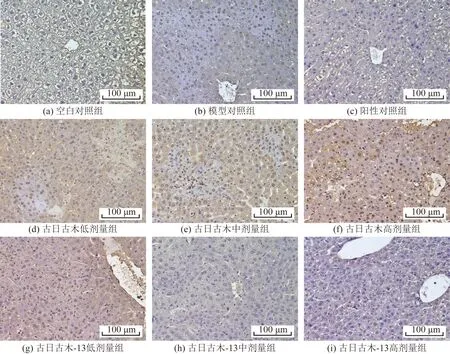
图1 TUNEL法检测肝细胞凋亡(10×40)Fig.1 Apoptosis was measured by TUNEL staining(10×40)
由图2和表2可知,流式细胞仪 (flow cytometry,FCM)测凋亡能力结果显示:与空白对照组相比,模型对照组的细胞凋亡率显著升高(P<0.05);与模型对照组相比,古日古木和古日古木-13各剂量组均能明显降低肝细胞的凋亡率(P<0.05),说明经过古日古木和古日古木-13处理后,大鼠肝细胞凋亡能力降低。其中古日古木低剂量组、中剂量组降低幅度较小,其余4组降低幅度较大,但4组间没有显著差异。另外,古日古木、古日古木-13各剂量组的细胞凋亡率均明显高于阳性对照组。
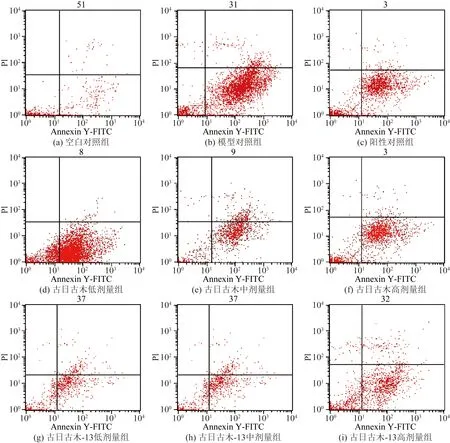
图2 各组小鼠肝细胞凋亡情况Fig.2 Hepatocytes apoptosis in each group

表2 各组小鼠肝细胞凋亡率比较Table 2 The apoptosis rate of hepatocytes in each group was compared
3.3 Western Blot检测肝组织内STAT1、p-STAT1和VCAM-1蛋白表达情况
Western Blot结果表明,与空白对照组相比,模型组小鼠肝组织内STAT1蛋白、p-STAT1蛋白和VCAM-1蛋白表达量明显升高。与模型组相比,除古日古木-13中剂量组外,其他给药组STAT1蛋白表达均显著降低(P<0.05);除古日古木低剂量组外,其余给药组p-STAT1蛋白均显著降低(P<0.05),尤其是古日古木-13高剂量组。所有给药组的VCAM-1蛋白表达量均显著降低(P<0.05),尤其是古日古木-13高剂量组和古日古木-13低剂量组。提示药物影响上述蛋白分子的表达方面剂量依赖性不明显。如图3和图4所示。
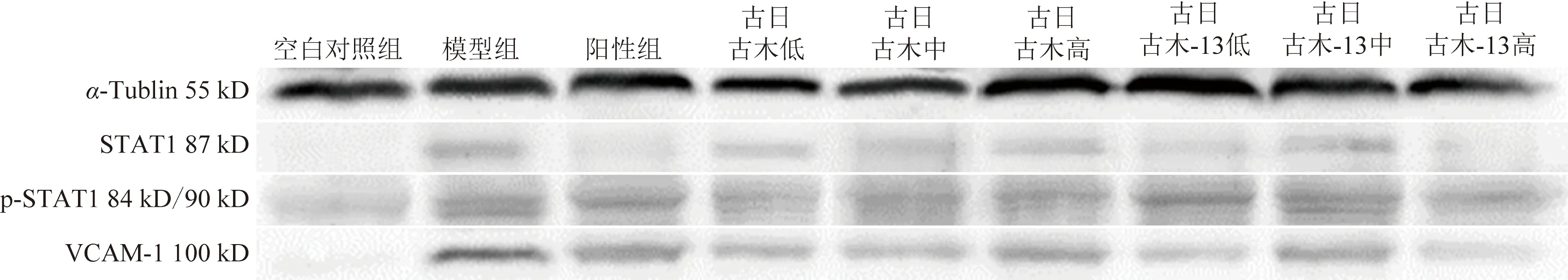
图3 蛋白印迹检测细胞凋亡相关蛋白表达Fig.3 Expression of apoptosis related proteins was tested by western blot

*为与空白对照组比较, P<0.05;#为与模型组比较, P<0.05图4 蛋白印迹检测细胞凋亡相关蛋白表达Fig.4 Expression of apoptosis related proteins was tested by western blot
4 讨论
目前鲜有针对AIH病因的治疗,主要采用非特异性免疫抑制:泼尼松龙或者与免疫抑制剂联合应用。但约有70%应用免疫抑制剂停药后会再次复发[11]。基于蒙药古日古木和古日古木-13在肝病治疗中已经具备大量临床成功经验,探索它们在自身免疫性肝炎中的治疗作用和作用机制,可能提供新的更为安全的治疗手段。刀豆蛋白A(concanavalin A,Con A)广泛应用于诱导的免疫性肝损伤动物模型[12]。Con A是一种提取自刀豆的可以促进T细胞有丝分裂的植物凝集素,它可以刺激T细胞,快速诱导产生肝脏转氨酶升高和大量T细胞浸润,继而引发肝脏组织坏死,导致AIH[13]。常见的给药剂量为10~30 mg/kg,常见取样时间则以给药后4~24 h[14],由前期实验的血清生化检测结果可知,给予小鼠20 mg/kg Con A刺激16 h后进行取样可以得到理想的急性免疫性肝损伤模型。
AIH的发病机制,较为公认的观点是肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)是诱导炎症反应的主要介质[13]。文献[15-17]发现TNF-α和INF-γ是自身免疫性肝细胞损伤的病原学原因,Mizuhara等[18]、Gantner等[19]发现Con A诱导的小鼠肝损伤与TNF-α有关。Wang等[20]进一步发现TNF-α和IFN-γ都是ConA诱导肝炎的主要介质。TNF-α以其可溶性形式和膜结合前体形式参与介导Con A肝炎,抑制细胞分裂并促进凋亡。而IFN-γ可以促进巨噬细胞和自然杀伤细胞的活化与增殖,促进主要组织相容性复合物Ⅱ的表达,因此参与肝损伤的形成[12-13,21]。已经上市的已经上市的TNF-α中和抗体英夫利昔单抗对AIH具有临床疗效,但仅仅体现在个别病例上,尚无大规模的研究证明[22-24]。而目前已经在使用的干扰素中和性抗体类药物主要是IFN-α类,用于治疗病毒性肝炎,在治疗AIH方面鲜有报道[25]。本文研究中发现古日古木-13中、高剂量给药组对TNF-α有明显的降低作用,古日古木中、高剂量组、古日古木-13所有剂量对IFN-γ有明显的降低作用。说明药物对IFN-γ的影响更为显著。提示药物对AIH的保护作用主要是通过降低炎性细胞因子IFN-γ来实现的。
肝损伤发生时,细胞内多种机制都可以参与诱导受损的肝细胞发生凋亡,如Fas介导、肝内浸润淋巴细胞凋亡减少导致的的肝细胞凋亡等[26]。原位末端标记(TdT-mediated dUTP nick end labeling,TUNEL)法和流式细胞术是两种检测细胞凋亡常用的方法。TUNEL法能够精确定位组织切片上的凋亡细胞,敏感性极高,但它只能标记中、晚期凋亡细胞,且凋亡细胞计数时易受主观因素的影响;而流式细胞术具有简单、快速、准确的有点,但它不能区分晚期凋亡与坏死细胞[27]。本文研究中利用两种方法检测给与Con A后小鼠肝细胞的凋亡情况,互相印证、补充。结果表明古日古木、古日古木-13各个剂量组均能够明显抑制Con A引起的肝细胞的凋亡,尤其是古日古木高剂量组和古日古木-13的三个剂量组。但这4组间的细胞凋亡率并不存在显著差异,与预想的剂量依赖趋势并不符合。这说明,提高浓度也许并不能增加古日古木-13的抗凋亡效果。
IFN-γ受体由IFNGR1和IFNGR2两个亚单位组成,与IFN-γ结合后,它们分别引起JAK1和AK2活化。活化的JAKs磷酸化IFN-γ受体的胞内部分,进而引起STAT1的Tyr-701残基磷酸化。磷酸化的STAT1自受体结合部位释放入细胞形成二聚体之后进入细胞核调控目标基因的转录,包括一氧化氮合酶(iNOS)、干扰素诱导蛋白-10(IP-10)和IFN-γ诱生的单核因子(Mig),以及干扰素调节因子(IRF-1)[28-29]。IRF-1是一种可以调控若干抗病毒和抗凋亡基因、调节机体对病原体的固有免疫及适应性免疫的转录因子。研究发现,Con A肝炎发生时,小鼠体内的IRF-1表达明显增加[30],且IRF-1-/-小鼠对Con A敏感度降低[31]。INF-γ/STAT1/IRF-1信号通路可以诱导产生细胞间黏附分子-1(ICM-1)、血管细胞黏附分子-1(VCAM-1)、CC类趋化因子配体-20(CCL-20),上皮来源的中性粒细胞活化肽-78 (ENA-78),干扰素诱导T细胞α趋化因子(I-TAC)、Mig以及IP-10等多种趋化因子和黏附分子,它们促进白细胞的浸润,发挥促炎作用参与AIH的形成[32]。结果表明,古日古木和古日古木-13对INF-γ/STAT1信号通路有影响,尤其是古日古木-13高剂量组最为明显,抑制INF-γ/STAT1信号通路并减少其下游分子VCAM-1的表达很有可能是药物抑制AIH的作用机制之一。
5 结论
综上所述,古日古木和古日古木-13均能不同程度的保护Con A导致的小鼠急性自身免疫性肝损伤,其机制可能是通过降低炎症因子的释放、减轻肝脏组织学改变、抑制INF-γ/STAT1信号通路及其下游效应分子VCAM-1,进而减轻炎症反应,同时减轻肝细胞凋亡来发挥保护肝脏作用的。
