汉黄芩素对胶原诱导性关节炎大鼠的治疗作用及对NLRP3炎症小体的影响
2021-11-21沈晓庆李婷君
沈晓庆,王 晶,李婷君
(辽宁中医药大学附属医院,辽宁 沈阳 110032)
类风湿关节炎(rheumatoid arthritis,RA)属于一种以滑膜增生、炎症细胞浸润及关节病变破坏为主要特征的慢性自身免疫性疾病,可导致骨及软骨的不可逆损伤,严重影响患者的日常活动及生活质量,给家人及社会造成了严重的负担[1]。RA的发病机制复杂且尚未完全阐明,其过程是集机体固有免疫、适应性免疫及多种细胞因子共同作用的结果。NLRP3炎症小体是一种存在于细胞浆中的多蛋白复合物,由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)和半胱氨酸蛋白酶-1前体(cysteine aspartic acid specific protease-1precursor,pro-Caspase-1)组成,能调控促炎性细胞因子(包括IL-1β、TNF-α及IL-18等)的成熟,从而参与炎症反应,与自身免疫性疾病、神经退行性疾病等密切相关[2-3]。有研究表明,RA模型中炎症小体NLRP3、Caspase-1、IL-1β及IL-18水平明显升高,与疾病的严重程度呈正比,且通过抑制NLRP3活性后,RA病理损伤明显减轻,说明NLRP3可能为治疗RA的有效靶点[4]。汉黄芩素为唇形科植物黄芩的主要药理活性成分之一,属于黄酮类化合物,具有抗炎、抗肿瘤等药理作用[5]。最近研究发现,汉黄芩素对RA模型具有一定的治疗作用。有研究表明,汉黄芩素可显著抑制类风湿关节炎成纤维滑膜细胞增殖,诱导其凋亡,并可显著下调炎症因子IL-6水平[6]。但是对NLRP3的影响未见报道。因此,本研究通过建立胶原诱导的关节炎大鼠(collagen induced arthritis,CIA)模型,探讨汉黄芩素治疗RA与NLRP3的关系,以期为明确汉黄芩素治疗RA的作用机制提供一定的实验依据。
1 材料与方法
1.1 实验动物SPF级SD雄性大鼠48只,体质量200~220 g,由辽宁长生生物技术有限公司提供,许可证号:SCXK(辽)2018-0001。大鼠饲养于辽宁中医药大学实验动物中心实验室,室温20~24℃,相对湿度40%~50%,自由饮食、饮水,光照和黑夜各12 h,适应性饲养1周后进行实验。本研究中所有实验方案均得到辽宁中医药大学实验动物福利伦理委员会的批准,批准号:IACUC2019005。
1.2 药物与试剂 汉黄芩素(成都普菲德生物有限公司,批号:JOT-10317);弗氏完全佐剂(批号:SLBT1422)、弗氏不完全佐剂(批号:SLBT1714)、鸡Ⅱ型胶原(批号:SLBV4134)(美国Sigma公司);地塞米松注射液(辽宁成大方圆药房,批号:2006031);HE染色试剂盒(大连美仑生物有限公司,批号:MB9898-Nov-21D);IL-1β ELISA试剂盒(批号:20190520)、TNF-α ELISA试剂盒(批号:20190408)、IL-18 ELISA试剂盒(批号:20190621)(北京索莱宝生物有限公司);兔抗NRLP3一抗(批号:BA-3677-2)、兔抗pro-Caspase-1一抗(批号:BM-4291)、兔抗Caspase-1一抗(批号:BA-2220-1)、兔抗GAPDH一抗(批号:BA2913)、驴抗兔生物素(HRP)标记二抗(批号:BA-1062)(武汉博士德生物有限公司);其余试剂均为国产分析纯。
1.3 主要仪器Ti-S型荧光倒置显微镜(日本尼康公司);RM2016型石蜡切片机(德国莱卡公司);SpectraMax M5型酶标仪(美国Sigma公司);Western blotting电泳仪和转膜仪(美国Bio-Rad公司)。
1.4 造模与分组48只大鼠中随机选取8只作为空白组,剩余40只大鼠根据文献报道的方法建立胶原诱导的关节炎大鼠模型[7-8]。将2 mg/mL鸡Ⅱ型胶原醋酸溶液逐滴加入至等体积的弗氏完全佐剂中,边滴加边研磨,不断研磨1 h。大鼠尾根部皮下散点注射上述弗氏完全佐剂200 μL。7 d后大鼠尾根部皮下散点注射含2 mg/mL鸡Ⅱ型胶原的弗氏不完全佐剂200 μL。空白组大鼠于同时间点注射等体积生理盐水。利用关节炎指数评分评价大鼠模型是否构建成功,评分标准如下,0分:关节无肿胀;1分:关节轻微肿胀;2分:关节中度肿胀;3分:关节严重肿胀;4分:关节严重肿胀并溃烂[8-9]。将4个关节的评分进行相加,累积评分≥4分表示CIA模型制备成功[10]。将造模成功的40只大鼠进一步随机分为模型组、地塞米松组、汉黄芩素低剂量组、汉黄芩素中剂量组、汉黄芩素高剂量组,每组8只。
1.5 实验给药 汉黄芩素给药剂量根据黄芩成人(5~10g/60 kg)临床剂量与汉黄芩素在黄芩中的含量(25 mg/g),并按人与动物体质量系数换算得到;汉黄芩素低剂量为成人临床剂量的2倍,中剂量为成人临床剂量的4倍,高剂量为成人临床剂量的8倍。地塞米松剂量根据体质量60 kg的成人的临床剂量按人与动物体质量系数换算得到;即汉黄芩素低、中、高剂量组大鼠分别给予汉黄芩素灌胃,50、100、200 mg/kg;地塞米松组大鼠给予地塞米松灌胃,3 mg/kg;空白组和模型组大鼠灌胃给予等体积冷开水[11]。1次/d,连续28 d。
1.6 检测指标
1.6.1 关节炎指数评分 分别于治疗第0、7、14、21及28天对大鼠双侧后足关节进行关节炎指数评分。0分:关节无肿胀;1分:关节轻微肿胀;2分:关节中度肿胀;3分:关节严重肿胀;4分:关节严重肿胀并溃烂[8-9]。
1.6.2 炎症因子水平 各组大鼠腹腔注射3.5%水合氯醛10 mL/kg进行麻醉,腹主动脉采血,3 000 r/min离心5 min,吸取上清,置于-20℃冰箱中保存,备用。利用ELISA试剂盒检测各组大鼠血清中炎症因子IL-1β、TNF-α及IL-18水平,步骤严格按照试剂盒说明书进行操作。
1.6.3 胸腺指数与脾指数 处死各组大鼠后,快速摘取完整的胸腺与脾脏,置于滤纸上吸干多余血迹,称质量并记录,根据如下公式计算胸腺指数与脾指数:胸腺(脾)指数=胸腺(脾)质量/大鼠体质量。
1.6.4 大鼠滑膜组织损伤病理观察 剥离大鼠膝关节,置于4%多聚甲醛中固定,脱钙液脱钙4周后,制备石蜡切片。将切片置于70%、80%、90%及100%酒精溶液中水化,二甲苯透明2次,每次15 min,苏木素染色液染色20 min,自来水冲洗;自来水浸泡20 min反蓝,自来水冲洗;伊红染色2 min,自来水冲洗;将切片置于70%、80%、90%及100%酒精溶液中脱水,二甲苯透明2次,每次5 min,晾干,中性树胶封片。置于倒置显微镜下观察各组大鼠滑膜组织病理变化。
1.6.5 NLRP3信号通路蛋白表达 将膝关节滑膜组织置于液氮中进行研磨,提取总蛋白,BCA蛋白检测试剂盒检测蛋白浓度,并调整蛋白浓度至一致,随后进行蛋白变性,行SDS-PAGE电泳(电泳条件为100 V,电泳时间为90 min)、转膜(转膜条件为250 mA,转膜时间为90 min)、封闭1 h,分别孵育NRLP3、pro-Caspase-1、Caspase-1或GAPDH一抗稀释液(1∶1000),4℃孵育过夜;次日加入二抗稀释液(1∶1 000)室温振荡孵育1 h。ECL化学发光,凝胶成像仪采集图像光密度。Image J软件进行分析,结果以NRLP3、pro-Caspase-1、Caspase-1蛋白与内参蛋白GAPDH的光密度比值表示。
1.7 统计学方法 利用SPSS 25.0软件进行数据的统计分析。计量资料以“均数±标准差”(x±s)表示,关节炎指数评分数据比较利用重复测量方差分析;其余各指标多组间比较利用单因素方差进行分析,两组间比较利用LSD-t检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠关节炎指数评分比较 造模后,模型组,汉黄芩素低、中、高剂量组,地塞米松组大鼠关节炎指数评分比较,差异均无统计学意义(P>0.05),具有可比性,可用于后续研究。
组内比较:模型组大鼠于治疗第7、14、21、28天后关节炎指数评分均明显高于治疗前(P<0.05),汉黄芩素低剂量组大鼠仅于治疗第14、21天关节炎指数评分均明显高于治疗前(P<0.05);而汉黄芩素中、高剂量组大鼠于治疗第7、14、21、28天后关节炎指数评分与治疗前比较,差异无统计学意义(P>0.05)。
组间比较:治疗第28天时,与模型组比较,汉黄芩素低剂量组大鼠关节炎指数评分明显降低(P<0.05);治疗第21、28天,与模型组比较,汉黄芩素中剂量组大鼠关节炎指数评分明显降低(P<0.05);治疗第14、21、28天,与模型组比较,汉黄芩素高剂量组与地塞米松组大鼠关节炎指数评分均明显降低(P<0.05)。
分组因素与时间因素存在交互作用,变化趋势相同,低、中、高剂量汉黄芩素治疗后关节炎指数评分存在剂量依赖性。

图1 交互效应轮廓图
2.2 各组大鼠胸腺指数、脾指数比较 与空白组比较,模型组大鼠胸腺指数、脾指数均明显升高(P<0.05);与模型组比较,汉黄芩素中、高剂量组及地塞米松组大鼠胸腺指数、脾指数均明显降低(P<0.05),且汉黄芩素中、高剂量组之间存在一定的剂量依赖性。汉黄芩素低剂量组大鼠胸腺指数、脾指数与模型组比较,差异无统计学意义(P>0.05);汉黄芩素低剂量组大鼠胸腺指数高于汉黄芩素高剂量组及地塞米松组(P<0.05)。(见表2)
表2 各组大鼠胸腺指数与脾指数比较(±s)

表2 各组大鼠胸腺指数与脾指数比较(±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与地塞米松组比较,cP<0.05;与汉黄芩素低剂量组比较,dP<0.05
?
2.3 各组大鼠膝关节病理损伤情况 空白组大鼠膝关节组织结构正常,滑膜细胞增生、炎症细胞浸润、血管翳形成等病理改变不可见,关节软骨表面光滑;而模型组大鼠膝关节组织细胞排列紊乱,滑膜细胞增生、炎症细胞浸润等病理损伤明显,可见血管翳形成和大量变性坏死的软骨细胞;汉黄芩素低剂量组大鼠膝关节组织细胞排列较紊乱,可见滑膜细胞增生、炎症细胞浸润等病理损伤,血管翳形成、变性坏死的软骨细胞多见;汉黄芩素中、高剂量组及地塞米松组大鼠与模型组比较,膝关节组织细胞排列较为整齐,滑膜细胞增生、血管翳形成、炎症细胞浸润等病理损伤明显减轻,变性坏死的软骨细胞明显减少,改善情况从强至弱依次为地塞米松组、汉黄芩素高剂量组、汉黄芩素中剂量组。(见图2)
表1 各组大鼠关节炎指数评分比较(±s,分)

表1 各组大鼠关节炎指数评分比较(±s,分)
注:与治疗前比较,aP<0.05;与模型组比较,bP<0.05;F时间主效应=10.912,P时间主效应=0.000;F分组主效应=182.258,P分组主效应=0.000;F交互效应=2.375,P交互效应=0.004
?
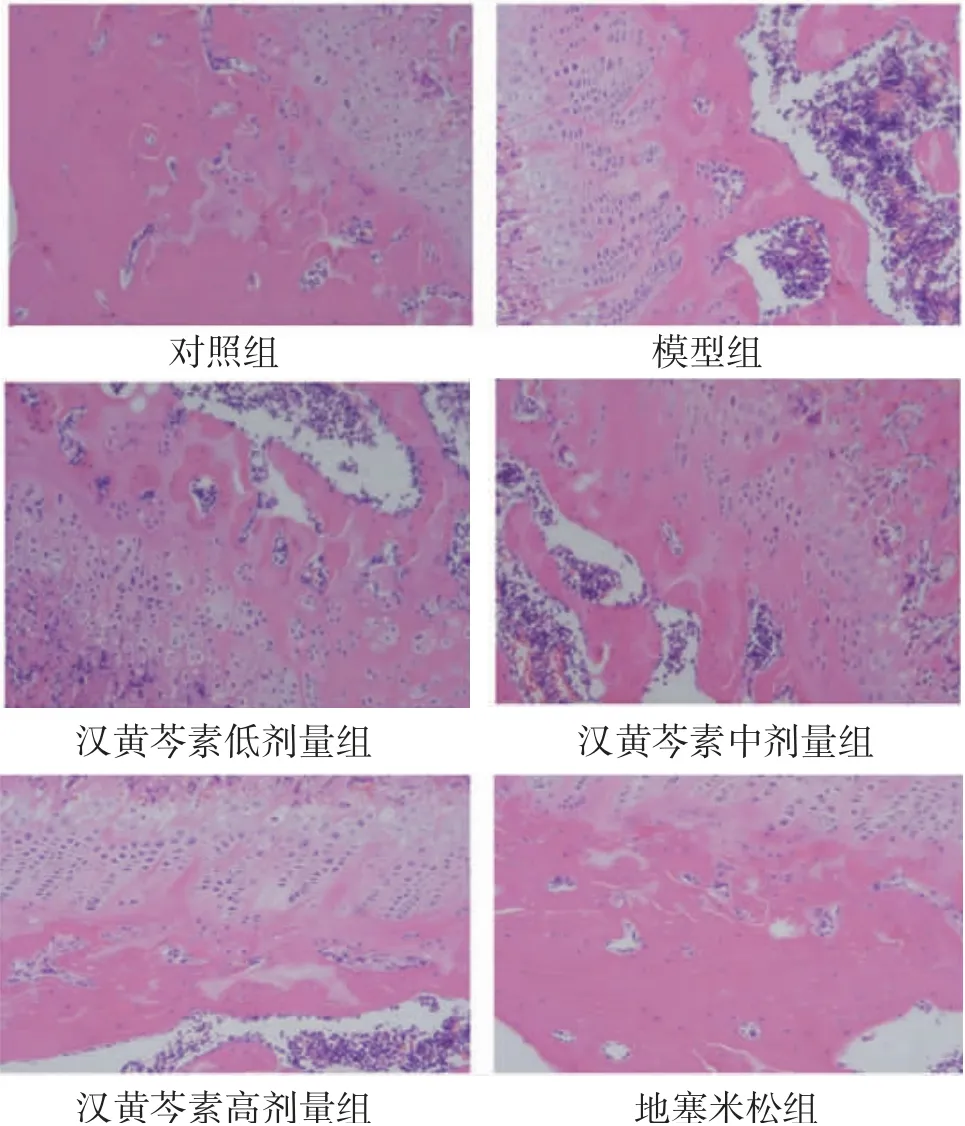
图2 各组大鼠膝关节病理损伤情况比较(HE,×400)
2.4 各组大鼠炎症因子表达比较 与空白组比较,模型组大鼠血清中IL-1β、TNF-α及IL-18表达水平明显升高(P<0.05);与模型组比较,汉黄芩素中、高剂量组及地塞米松组大鼠血清中IL-1β、TNF-α及IL-18表达水平明显降低(P<0.05),且汉黄芩素低、中、高剂量组及地塞米松组之间比较,差异无统计学意义(P>0.05);汉黄芩素低剂量组大鼠血清中IL-1β、TNF-α及IL-18表达水平与模型组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组大鼠炎症因子表达比较(±s,pg/mL)

表3 各组大鼠炎症因子表达比较(±s,pg/mL)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05
?
2.5 各组大鼠NLRP3信号通路相关蛋白比较 与空白组比较,模型组大鼠滑膜组织NRLP3、pro-Caspase-1及Caspase-1蛋白相对表达量明显升高(P<0.05);与模型组比较,汉黄芩素中、高剂量组及地塞米松组大鼠滑膜组织NRLP3、pro-Caspase-1及Caspase-1蛋白相对表达量明显降低(P<0.05),且汉黄芩素低、中、高剂量组及地塞米松组之间比较,差异无统计学意义(P>0.05);汉黄芩素低剂量组大鼠滑膜组织NRLP3、pro-Caspase-1及Caspase-1蛋白相对表达量与模型组比较,差异无统计学意义(P>0.05)。(见图3)
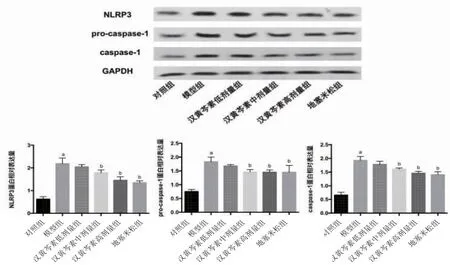
图3 各组大鼠NLRP3信号通路相关蛋白比较(±s,n=8)
3 讨 论
RA属中医学中“痹证”“历节”“白虎病”等范畴。《黄帝内经》曰:“风寒湿三气杂至,合而为痹也”;“所谓饮食居处,为其病本”,首次阐明了痹证的病因与外邪入侵人体有关。现代医家认为RA病机为邪实正虚,虚实夹杂,且邪气痹阻经脉为其根本病机,病变多累及筋骨、肌肉、关节甚至累及脏腑器官等[12]。黄芩为唇形科植物黄芩的干燥根,始载于《神农本草经》,已经有两千多年的应用史。黄芩具有清热燥湿、泻火解毒、止血安胎等功效,主治温热病、肺炎、痢疾、咳血、胎动不安、高血压、痈肿疖疮等[13]。现代药理学研究表明,黄芩对大鼠类风湿关节炎具有一定的缓解作用,能够抑制炎症介质的释放,从而缓解炎症反应[14]。其主要药理活性成分为黄酮类化合物,其中汉黄芩素属于黄芩根特异性黄酮,具有较好的抗炎及抗肿瘤等药理作用[15]。有研究表明,汉黄芩素能够通过靶向NF-κB/MAPK信号通路改善CIA大鼠的RA样病理损伤[11];汉黄芩素还可通过激活p38MAPK信号通路以诱导类风湿关节炎成纤维样滑膜细胞凋亡,抑制其增殖,缓解RA[16]。本研究通过建立CIA大鼠模型评价汉黄芩素对其治疗作用,结果表明中、高剂量的汉黄芩素可明显降低CIA大鼠的关节炎指数评分,降低胸腺指数和脾指数,改善滑膜组织病理损伤,改善炎症浸润,对CIA大鼠具有一定的治疗作用,与文献报道一致[11];且汉黄芩素中、高剂量组与地塞米松组比较,差异无统计学意义。而低剂量汉黄芩素对CIA大鼠的治疗作用不明显,说明其治疗CIA存在剂量依赖性。
目前的研究认为,炎症因子大量释放与RA的发生与发展密切相关。炎症细胞浸润入滑膜组织内,可造成滑膜增生与基质破坏,从而加速RA的发展进程并加重其病理损伤,因此抑制炎症因子产生与释放是防治RA的重要环节[17-18]。IL-1β、TNF-α及IL-18是机体内重要的促炎性细胞因子,具有调节机体固有免疫与细胞免疫的作用,在RA等自身免疫性疾病中具有重要的调节作用[19]。IL-1β不仅能通过诱导内皮细胞表达黏附因子、基质细胞释放趋化因子,还能够诱导环氧酶2或者NO合成酶,从而加强机体炎症反应[20]。IL-18能与淋巴细胞、巨噬细胞及成纤维样滑膜细胞上的IL-18受体结合,发挥刺激作用[21]。本研究结果显示,中、高剂量汉黄芩素可明显抑制CIA大鼠血清中炎症因子IL-1β、TNF-α及IL-18的水平,且与地塞米松组比较,差异无统计学意义,结果说明汉黄芩素可降低CIA大鼠的炎症反应水平。此外,由于IL-1β与IL-18为NLRP3炎症小体的下游效应分子,因此推测汉黄芩素抑制CIA大鼠炎症反应与调控NLRP3炎症小体有关。
NLRP3炎症小体在RA的发生发展过程中发挥着重要的作用,其是机体固有免疫的重要组成部分,可通过模式识别受体(pattern recognition receptor,PRR)识别内源性或者外源性刺激因素,从而聚集Caspase-1并使其激活,并剪切IL-1β及IL-18的活性前体pro-IL-1β及pro-IL-18,促进其成熟,产生成熟的细胞因子并释放,最终导致RA过程中的一系列炎症反应[22-23]。为了验证汉黄芩素抑制CIA大鼠炎症反应是否与调控NLRP3炎症小体有关,我们利用Western blotting检测了NRLP3、pro-Caspase-1及Caspase-1蛋白表达。结果显示中、高剂量的汉黄芩素能抑制CIA大鼠滑膜组织中NRLP3、pro-Caspase-1及Caspase-1蛋白表达,说明汉黄芩素减轻CIA大鼠炎症反应可能与抑制NLRP3炎症小体有关。
综上所述,汉黄芩素能够降低CIA大鼠的关节炎指数评分,降低胸腺指数和脾指数,改善滑膜组织RA样病理损伤,并抑制NLRP3炎症小体介导的炎症反应来缓解RA的进展,为阐明汉黄芩素治疗RA的作用机制提供了实验依据,但是具体作用机制与作用靶点仍需要进一步深入研究。
