基于Keap1/Nrf2/ARE通路探究黄连素对妊娠合并糖尿病大鼠胰腺的保护作用
2021-11-21朱袁君
朱袁君,崔 瑜,殷 浩
(十堰市太和医院,湖北 十堰 442000)
妊娠合并糖尿病包括糖尿病合并妊娠和妊娠期糖尿病(gestational diabetes mellitus,GDM),其中GDM约占妊娠期高血糖的90%,即怀孕妇女妊娠前空腹及餐后血糖正常,妊娠后血糖水平异常的疾病[1]。目前,我国GDM的总患病率为14.8%,且有逐年上升趋势[2]。妊娠合并糖尿病可导致妊娠期高血压、羊水过多、早产、巨大儿、新生儿呼吸窘迫综合征等,虽然部分患者在产后血糖可恢复正常,但产后糖尿病的发病风险明显升高,严重威胁着母婴健康[3]。妊娠期孕产妇血糖异常与胰腺功能异常密切相关,但目前大部分的药物仅在已经受损的胰岛组织基础上促进胰岛素分泌,并未针对受损的胰腺组织进行修复,也因此无法抑制胰腺功能的逐渐减退[4]。
黄连素是黄连的主要有效成分,具有抗菌、抗炎、抗病毒的作用,对神经系统、心血管系统和内分泌系统疾病也有明显的改善作用。在动物实验中,黄连素亦表现出较好的安全性,能够降低子痫大鼠的血压,减轻肾损伤,增加正常胎儿的数量和体质量[5-8]。研究证明,黄连素对2型糖尿病具有明显治疗作用,对GDM大鼠也具有降低血糖、改善胰岛素抵抗的作用,但其作用机制仍需进一步探讨[9-10]。本研究通过建立妊娠合并糖尿病大鼠模型考察黄连素对GDM大鼠胰腺的保护作用,并探究其作用机制。
1 材料与方法
1.1 实验动物SPF级成年雌性SD大鼠60只,雄性SD大鼠30只,体质量180~220 g,购自河南省实验动物中心,动物生产许可证号:SCXK(豫)2017-0001,饲养在河南省实验动物中心实验室独立动物房,动物使用许可证号:SYXK(豫)2016-0002。饲养条件为室温(22±2)℃,湿度(50±10)%,每天定时换气,保持12 h/12 h光暗照明,食水不限。研究方案获本院伦理委员会批准。
1.2 药物与试剂 黄连素(上海一基实业有限公司,纯度≥98%,批号:2086-83-1);盐酸二甲双胍(中美上海施贵宝制药有限公司,批号:1710083);链脲佐菌素(streptozocin,STZ,北京索莱宝科技有限公司,批号:S8050);胰岛素、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)检测试剂盒(武汉伊莱瑞特生物科技有限公司,批号:E-EL-R2614c,E-BC-K022-S,E-BCK096-S,E-BC-K031-S,E-EL-0060c);Bcl-2相 关X蛋 白(Bcl-2-associated X protein gene,Bax)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1,Keap1)、NF-E2相关因子2(NF-E2-related factor 2,Nrf2)、血红素氧合酶1(heme oxygenase-1,HO-1)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔源单克隆抗体(武汉三鹰生物技术有限公司,批号:60267-1-Ig,60178-1-Ig,60027-1-Ig,66504-1-Ig,66743-1-Ig,60004-1-Ig)。
1.3 主要仪器ONETOUCH型血糖仪(强生上海医疗器械有限公司);IX53型显微镜(日本奥林巴斯);DYCZ-24KS型双板垂直电泳仪(北京六一仪器厂);G:BOX型多功能凝胶成像系统(美国Syngene公司)。
1.4 造模与分组 本研究造模方法参考文献[11],选取未交配过的雌性SD大鼠60只和雄性SD大鼠30只,将处于动情前期的雌鼠与雄鼠按2∶1的比例合笼交配,次日早晨镜检雌鼠阴道分泌物,若观察到阴栓即确定为妊娠第1天。经观察,有54只大鼠妊娠成功。将孕鼠随机分为空白组、模型组、二甲双胍组、黄连素高剂量组、黄连素中剂量组和黄连素低剂量组,每组9只。妊娠第5天时,除空白组大鼠腹腔注射等量生理盐水外,其余各组大鼠腹腔注射35 mg/kg STZ溶液,3 d后检测大鼠空腹血糖水平,若空腹血糖水平≥13.5 mmol/L,表明妊娠合并糖尿病模型建立成功。
1.5 实验给药 确认模型建立成功的当天开始给药,二甲双胍组大鼠灌胃二甲双胍溶液,200 mg/kg,黄连素高、中、低剂量组大鼠分别灌胃高剂量(100 mg/kg)、中剂量(50 mg/kg)、低剂量(25 mg/kg)黄连素溶液,空白组和模型组大鼠灌胃等体积冷开水,1次/d,连续6周。
1.6 观察指标
1.6.1 血糖和胰岛素水平 给药前及给药后第2、4、6周时,各组大鼠尾静脉采集血液1 mL,通过血糖仪和胰岛素检测试剂盒分别测定大鼠空腹血糖水平和胰岛素水平。
1.6.2 胰腺组织病理变化 末次给药后,通过腹腔注射水合氯醛麻醉大鼠,颈椎脱臼法处死后分离胰腺组织,生理盐水清洗至无血丝,一部分置于4%多聚甲醛中固定,用于苏木精-伊红染色(hematoxylin-eosin staining,HE)及TUNEL(TdT-mediated dUTP nick-end labeling)染色,另一部分冻存于-80℃,用于试剂盒、Western blotting检测。胰腺组织用4%多聚甲醛固定,蒸馏水清洗,梯度乙醇脱水,二甲苯透明,石蜡包埋、切片(厚度为4 μm),二甲苯脱蜡,梯度乙醇复水,行HE染色观察胰腺组织病理变化。
1.6.3 TUNEL法观察胰岛细胞凋亡情况 切片制备方法同“1.6.2”。切片标本常规脱蜡、复水,滴加蛋白酶K溶液,室温水解15 min去除组织蛋白,蒸馏水清洗后放置在含2%过氧化氢的磷酸缓冲盐溶液(phosphate buffer saline,PBS)中反应5 min,滴加末端脱氧核苷酸转移酶(terminal deoxyribonucleotidyl transferase,TdT)反应液2滴,置湿盒中37℃孵育1 h,滴加50 μL过氧化物标记的抗地高辛抗体,然后将切片放置在湿盒中室温孵育0.5 h,PBS清洗后滴加DAB溶液,室温孵育3~6 min显色,蒸馏水终止,苏木精染细胞核2 min,脱水、透明后用中性树胶封片,显微镜高倍镜下观察,每组随机取4个视野拍照,计算凋亡指数(apoptosis index,AI),即每组选取5个阳性细胞数最多的高倍视野,计算500个细胞中阳性细胞所占的百分比。1.6.4 ELISA法测定胰腺组织SOD、GSH-Px、CAT活性及MDA含量 取大鼠胰腺组织,加入预冷PBS缓冲液,冰上匀浆,10 000 r/min离心10 min取上清,离心半径为12.5 cm,分装在EP管中,-80℃保存。根据SOD、GSH-Px、CAT和MDA试剂盒操作方法,通过紫外可见分光光度计测定大鼠胰腺组织中SOD、GSH-Px、CAT活力和MDA含量。
1.6.5 Western blotting检 测 胰 腺 组 织Bax、Bcl-2及Keap1/Nrf2/抗氧化反应元件(Antioxidant response elements,ARE)信号通路蛋白表达水平 取大鼠胰腺组织,冰上研磨匀浆,加入裂解液提取组织蛋白,BCA蛋白定量试剂盒测定蛋白浓度,加入loading buffer,在EP管中混匀后置于沸水中煮沸5 min使蛋白变性。配置15%的分离胶和5%的浓缩胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,上样后80 V电泳2 h,60 V转膜2 h,5%脱脂奶粉封闭2 h,TBST缓冲液清洗后将条带放入10 mL Bax、Bcl-2、Keap1、Nrf2、HO-1、GAPDH兔源一抗稀释液中,稀释比例均为1∶1 000,4℃环境下孵育12 h,第2天用TBST缓冲液清洗3次,每次10 min,然后加入羊抗兔二抗(1∶2 000)中,在37℃环境下孵育2 h,TBST缓冲液清洗3次后滴加ECL发光液,反应1 min后置于凝胶成像系统显影。免疫印迹实验的内参蛋白为GAPDH,用Image J软件分析各个蛋白对应的灰度值,计算蛋白相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.7 统计学方法 应用SPSS 25.0统计软件分析数据,实验重复3次,计量资料以“均数±标准差”(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。重复测量计量资料比较,采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血糖和胰岛素水平比较 给药前后不同时间点之间大鼠血糖水平和胰岛素水平比较,差异有统计学意义(P<0.05),即存在时间效应;二甲双胍组和黄连素高、中、低剂量组大鼠血糖水平随着时间延长逐渐降低,胰岛素水平随着时间延长逐渐升高,差异均有统计学意义(P<0.05)。空白组、模型组、二甲双胍组和黄连素高、中、低剂量组大鼠血糖水平和胰岛素水平整体比较,差异有统计学意义(P<0.05),即存在分组效应;给药前,模型组,二甲双胍组和黄连素高、中、低剂量组大鼠空腹血糖水平均高于空白组(P<0.05),胰岛素水平均低于空白组(P<0.05),给药后,二甲双胍组和黄连素高、中、低剂量组大鼠空腹血糖水平低于模型组(P<0.05),胰岛素水平高于模型组,差异均有统计学意义(P<0.05)。时间因素和分组因素存在交互效应(P<0.05)。(见表1~2、图1~2)

图1 大鼠空腹血糖水平时间和分组交互效应轮廓图

图2 大鼠胰岛素水平时间和分组交互效应轮廓图
表2 各组大鼠胰岛素水平比较(±s,mmol/mL)
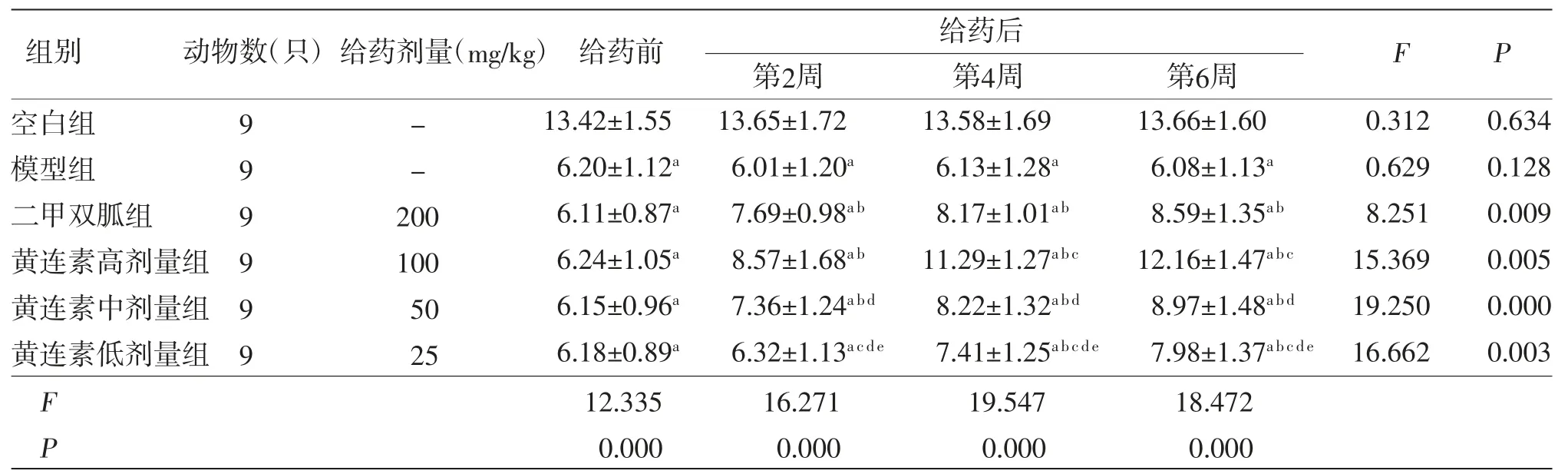
表2 各组大鼠胰岛素水平比较(±s,mmol/mL)
注:F时间主效应=17.331,P时间主效应=0.000;F分组主效应=22.012,P分组主效应=0.000;F交互效应=9.504,P交互效应=0.000;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与黄连素高剂量组比较,dP<0.05;与黄连素中剂量组比较,eP<0.05
?
2.2各组大鼠胰腺组织病理变化情况 空白组大鼠胰岛细胞排列整齐、结构完整,细胞质含量丰富,胰岛细胞数量多,未见异常;与空白组比较,模型组大鼠胰岛细胞明显减少,细胞肿胀、结构不完整,排列紊乱;与模型组比较,二甲双胍组和黄连素高、中剂量组大鼠胰腺组织细胞损伤得到明显改善,胰岛细胞数量增加,胞核胞质清晰,但黄连素低剂量组大鼠仍可见胰腺组织细胞紊乱现象。(见图3)
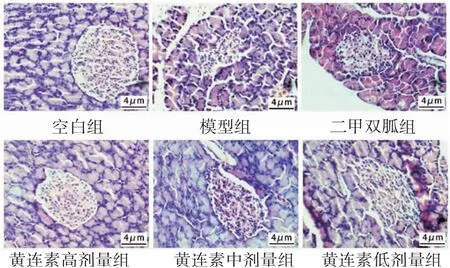
图3 各组大鼠胰腺组织病理变化比较(HE,×400)
2.3 各组大鼠胰岛细胞凋亡情况比较6组大鼠胰腺组织细胞AI值比较,差异有统计学意义(P<0.05),进一步两两比较结果显示:空白组大鼠胰岛细胞几乎无凋亡现象,与空白组比较,模型组、二甲双胍组和黄连素高、中、低剂量组大鼠均存在胰岛细胞凋亡,AI值均升高(P<0.05)。与模型组比较,二甲双胍组和黄连素高、中剂量组大鼠胰岛凋亡细胞数量均减少,AI值均降低(P<0.05),而黄连素低剂量组大鼠凋亡细胞数量和AI值与模型组比较,差异无统计学意义(P>0.05)。与二甲双胍组比较,黄连素高、中、低剂量组大鼠AI值均升高(P<0.05)。与黄连素高剂量组比较,黄连素中、低剂量组大鼠AI值均升高(P<0.05),胰岛凋亡细胞均增加。黄连素中剂量组大鼠胰岛凋亡细胞数量低于黄连素低剂量组(P<0.05)。(见图4、表3)
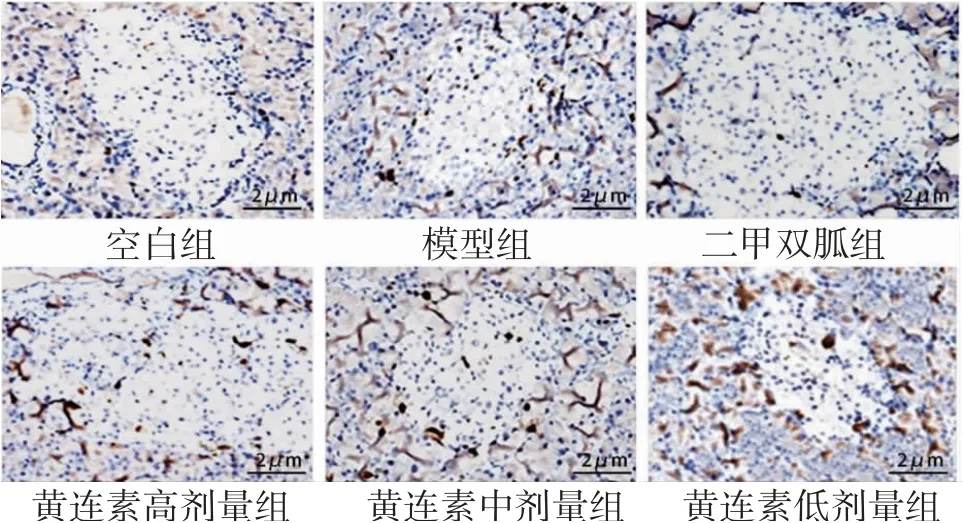
图4 各组大鼠胰腺组织细胞凋亡情况比较(TUNEL,×400)
表3 各组大鼠胰腺组织细胞AI值比较(±s)

表3 各组大鼠胰腺组织细胞AI值比较(±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与黄连素高剂量组比较,dP<0.05;与黄连素中剂量组比较,eP<0.05
?
2.4 各组大鼠胰腺组织Bax、Bcl-2蛋白相对表达量比较6组大鼠胰腺组织Bax、Bcl-2蛋白相对表达量比较,差异均有统计学意义(P<0.05)。进一步两两比较结果显示:模型组、二甲双胍组和黄连素高、中、低剂量组大鼠胰腺组织Bax蛋白相对表达量均高于空白组(P<0.05),Bcl-2蛋白相对表达量均低于空白组(P<0.05)。与模型组比较,二甲双胍组和黄连素高、中剂量组大鼠胰腺组织Bcl-2蛋白相对表达量均增加(P<0.05),Bax蛋白相对表达量均减少(P<0.05);黄连素低剂量组大鼠胰腺组织Bax、Bcl-2蛋白相对表达量与模型组比较,差异无统计学意义(P>0.05)。黄连素高剂量组大鼠胰腺组织Bax、Bcl-2蛋白相对表达量与二甲双胍组比较,差异无统计学意义(P>0.05)。与二甲双胍组比较,黄连素中、低剂量组大鼠胰腺组织Bax蛋白相对表达量均增加(P<0.05),Bcl-2蛋白相对表达量均减少(P<0.05)。黄连素中剂量组大鼠胰腺组织Bax蛋白相对表达量低于黄连素低剂量组(P<0.05),Bcl-2蛋白相对表达量高于黄连素低剂量组(P<0.05)。(见表4、图5)
表4 各组大鼠胰腺组织Bax、Bcl-2蛋白相对表达量比较(±s)

表4 各组大鼠胰腺组织Bax、Bcl-2蛋白相对表达量比较(±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与黄连素高剂量组比较,dP<0.05;与黄连素中剂量组比较,eP<0.05
?

图5 各组大鼠胰腺组织Bax、Bcl-2蛋白表达Western blotting图
2.5 各组大鼠胰腺组织SOD、GSH-Px、CAT活性及MDA含量比较6组大鼠胰腺组织SOD、GSH-Px、CAT活性及MDA含量比较,差异均有统计学意义(P<0.05)。进一步两两比较结果显示:模型组、二甲双胍组和黄连素高、中、低剂量组大鼠胰腺组织SOD、GSH-Px、CAT活性均低于空白组(P<0.05),MDA含量高于空白组(P<0.05)。与模型组比较,二甲双胍组和黄连素高、中、低剂量组大鼠胰腺组织SOD、GSH-Px、CAT活性均增加(P<0.05),MDA含量均降低(P<0.05)。与二甲双胍组比较,黄连素高剂量组大鼠胰腺组织SOD、GSH-Px、CAT活性增加(P<0.05),MDA含量降低(P<0.05),而黄连素中剂量组大鼠胰腺组织SOD、GSH-Px、CAT活性及MDA含量与二甲双胍组比较,差异均无统计学意义(P>0.05);黄连素低剂量组大鼠胰腺组织SOD活性与二甲双胍组比较,差异无统计学意义(P>0.05),GSH-Px、CAT活性低于二甲双胍组(P<0.05),MDA含量高于二甲双胍组(P<0.05)。黄连素的作用呈剂量依赖性。(见表5)
表5 各组大鼠胰腺组织SOD、GSH-Px、CAT活性及MDA含量比较 (±s)

表5 各组大鼠胰腺组织SOD、GSH-Px、CAT活性及MDA含量比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与黄连素高剂量组比较,dP<0.05;与黄连素中剂量组比较,eP<0.05
?
2.6 各组大鼠胰腺组织Keap1、Nrf2、HO-1蛋白相对表达量比较6组大鼠胰腺组织Keap1、Nrf2、HO-1蛋白相对表达量比较,差异均有统计学意义(P<0.05)。进一步两两比较结果显示:模型组大鼠胰腺组织Keap1蛋白相对表达量高于空白组(P<0.05),Nrf2、HO-1蛋白相对表达量低于空白组(P<0.05)。与模型组比较,二甲双胍组和黄连素高、中、低剂量组大鼠胰腺组织Keap1蛋白相对表达量均降低(P<0.05),Nrf2、HO-1蛋白相对表达量均升高(P<0.05)。二甲双胍组大鼠胰腺组织Keap1、Nrf2、HO-1蛋白相对表达量与黄连素高剂量组比较,差异均无统计学意义(P>0.05)。与二甲双胍组比较,黄连素中、低剂量组大鼠胰腺组织Keap1蛋白相对表达量均升高(P<0.05),Nrf2、HO-1蛋白相对表达量降低(P<0.05)。黄连素中剂量组大鼠胰腺组织Keap1蛋白相对表达量低于黄连素低剂量组,Nrf2、HO-1蛋白相对表达量高于黄连素低剂量组,差异有统计学意义(P<0.05)。(见表6、图6)
表6 各组大鼠胰腺组织Keap1、Nrf2、HO-1蛋白相对表达量比较(±s)
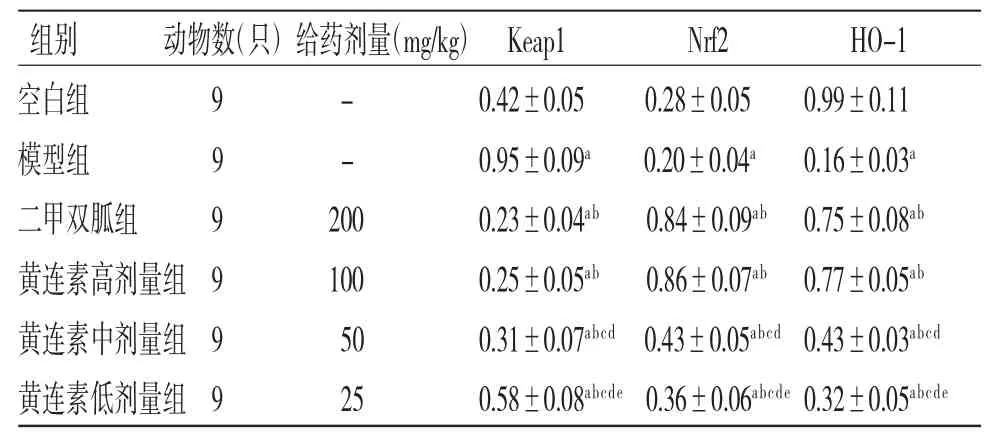
表6 各组大鼠胰腺组织Keap1、Nrf2、HO-1蛋白相对表达量比较(±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与黄连素高剂量组比较,dP<0.05;与黄连素中剂量组比较,eP<0.05
?
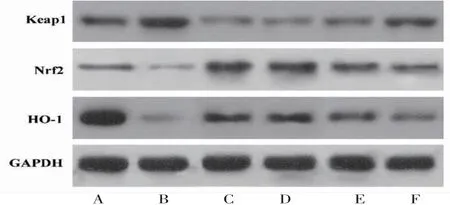
图6 各组大鼠胰腺组织Keap1、Nrf2、HO-1蛋白表达Western blotting图
3 讨 论
GDM是由于妊娠后母体糖代谢异常而首次发生的糖尿病,极易造成产妇出现先兆子痫、胎膜早破、早产等,增加母儿患2型糖尿病和心血管疾病的风险[12]。目前,治疗GDM主要通过饮食控制、运动和胰岛素等对症疗法,尚缺乏真正有效的防治方法。因此,寻找安全有效的药物防治GDM是目前围产医学研究的重要任务。黄连味苦、性寒,具有清热燥湿、泻火解毒之功效,对糖尿病疾病有治疗作用[13]。研究表明,黄连的有效成分黄连素可改善GDM大鼠胰岛素抵抗,降低血糖,但其作用机制仍需进一步阐明[14-15]。
本研究通过向孕鼠腹腔注射STZ制备妊娠合并糖尿病模型,结果显示大鼠空腹血糖水平显著升高,胰岛素水平显著降低,表明模型建立成功。使用黄连素治疗后,结果显示,从第2周至实验结束,黄连素可降低包括大鼠生产前后阶段的空腹血糖水平,增加胰岛素分泌。HE和TUNEL染色显示,黄连素能减轻孕鼠胰岛损伤,减轻胰岛细胞凋亡,AI指数显著降低,这一现象在Bax和Bcl-2蛋白表达水平检测中得到验证,即黄连素降低了Bax的表达,增加了Bcl-2的表达。Bcl-2和Bax是调控细胞凋亡的关键基因,Bax过表达可促进细胞凋亡,而Bcl-2可与Bax形成二聚体,抑制Bax基因的表达,从而抑制细胞凋亡[16]。氧化应激反应是组织损伤的基本病理过程,MDA的含量高低能够直接反映机体的氧化应激水平,与MDA相反,SOD、GSH-Px、CAT属于抗氧化酶系统的重要分子,可清除有害氧自由基,抑制机体发生氧化应激损伤和细胞凋亡[17]。本研究显示,糖尿病孕鼠胰腺组织SOD、GSH-Px、CAT活性降低,MDA含量升高,而黄连素能够增加SOD、GSH-Px、CAT活性,减少MDA含量。以上研究表明,黄连素对GDM具有治疗和改善作用,能减轻胰腺损伤。
Keap1/Nrf2/ARE信号通路是人体重要的抗氧化应激通路,Keap1是Nrf2在细胞质中的关键调节因子。正常情况下,Keap1与Nrf2在胞质结合抑制Nrf2进入细胞核,Nrf2处于非激活状态,而在氧化应激条件下,Nrf2与Keap1脱离,从细胞质转移到细胞核中,并与下游基因启动子ARE结合,上调可以催化多种抗氧化途径的下游基因HO-1的转录和表达,从而实现维持细胞氧化平衡,保持细胞内环境稳态[18-19]。研究表明,调控Keap1-Nrf2/ARE信号通路,增加Nrf2/Keap1复合物的解离,促进Nrf2的表达能够减轻STZ诱导的糖尿病氧化应激反应及相关并发症[20]。与上述研究结果一致,本研究发现糖尿病孕鼠胰腺组织Keap1表达升高,Nrf2、HO-1蛋白表达水平降低,而使用黄连素干预后,胰腺组织Keap1蛋白表达水平降低,Nrf2、HO-1蛋白表达水平升高,表明黄连素对Keap1-Nrf2/ARE信号通路有调控作用。
综上所述,黄连素可降低GDM大鼠血糖,促进胰岛素分泌,减轻胰腺氧化应激损伤和细胞凋亡,其作用机制可能与激活Keap1-Nrf2/ARE信号通路有关。
