应用PASO标准评估两种手术方式治疗单侧醛固酮瘤疗效的对比研究
2021-11-20刘学洋
刘学洋,张 尧
(重庆医科大学附属第一医院泌尿外科 400016)
原发性醛固酮增多症(primary hyperaldosteronism,PHA) 是指肾上腺皮质自主分泌过量的醛固酮激素,引起以高血压、低血钾、低血浆肾素活性和碱中毒为主要表现的临床综合征,又称Conn综合征[1],为继发性高血压最常见的类型。根据分泌醛固酮的病因或病理改变,可将PHA分为醛固酮腺瘤(aldosterone-producing adenoma,APA)、单侧肾上腺增生和特发性醛固酮增多症等[1]。OMURA等[2]于2002年报道了肾上腺醛固酮瘤可合并多个腺瘤存在,并提出了单侧多发性肾上腺小结节的概念,这是对PHA诊治的重要补充。目前认为,单侧肾上腺病变可通过外科手术治疗。对单侧APA主要有2种可行的术式,即腹腔镜肾上腺全切除术(total adrenalectomy,TA)和腹腔镜肾上腺部分切除术(partial adrenalectomy,PA)。目前,由于缺乏统一的相关结局指标的文献报道,对单侧APA患者结局的判断仍受到限制[3-4]。在这种情况下,作为标准化的第一步,本研究引入了原发性醛固酮增多症手术结局(PASO)标准[5],以评估PHA患者手术治疗的成功性,并允许在系列之间进行比较。本研究回顾性分析了本院泌尿外科收治的行2种手术治疗的单侧APA患者的相关临床资料,并应用PASO标准评价了手术成功性,旨在进一步分析单侧APA最合适的手术方式。
1 资料与方法
1.1 一般资料
选取2013年1月至2020年3月本院收治的术前考虑为单侧APA患者245例,其中男83例(33.9%),女162例(66.1%);年龄18~73岁,平均(46.1±11.7)岁;左侧136例(55.5%),右侧109例(44.5%)。所有患者均行手术治疗,其中行PA 121例(49.4%),行单侧TA 124例(50.6%)。11例患者因体检发现肾上腺占位,其余234例患者均因头晕、头痛、乏力等高血压或低血钾相关症状就诊。有不同程度高血压243例(99.2%),收缩压130~285 mm Hg,平均(182.9±23.1)mm Hg;舒张压80~170 mm Hg,平均(110.8±13.2)mm Hg。合并持续性低钾血症189例(77.1%),血钾1.2~4.0 mmol/L,平均(2.5±0.5)mmol/L(正常值3.5~5.3 mmol/L)。首次初筛为阴性13例(5.3%),更换降压药物后复查血浆醛固酮/肾素浓度比值大于或等于20。术前完善双侧肾上腺静脉取血(adrenal vein sampling,AVS)161例(65.7%),其中144例通过AVS明确优势分泌侧,17例需结合CT完成侧化,AVS诊断准确率为89.4%;同时161例患者中CT检查提示双侧病变15例,双侧肾上腺无明显异常7例,术前考虑腺瘤最终病理检查为增生22例,CT诊断准确率为76.4%。术前所需降压药物种类1~5种,平均(1.9±0.8)种。所有患者术前均行肾上腺薄层CT检查明确腺瘤存在,术前影像学检查提示肿瘤直径6.0~34.0 mm,平均(14.4±4.4)mm。
1.2 纳入标准
(1)立位血浆醛固酮/血浆肾素浓度大于或等于20[6];(2)盐水负荷试验、卡托普利试验、氟氢可的松试验至少完善2项,且至少1项为阳性;(3)肾上腺CT检查提示单侧肾上腺占位病变,直径大于或等于10 mm,对侧肾上腺无异常,若CT检查提示单侧肾上腺占位病变,直径小于10 mm或对侧肾上腺增生及双侧多发病灶则行AVS明确醛固酮优势分泌侧;(4)术后病理检查提示肾上腺皮质腺瘤或肾上腺皮质增生。
1.3 手术方法
两组患者术前均予以口服螺内酯(100~200 mg/d,每天2~4次),如低血钾严重则予以口服或静脉补钾,同时部分患者予以硝苯地平控释片、厄贝沙坦片辅助降压。术前将血压控制在小于140/90 mm Hg(恶性高血压者可放宽至150/90 mm Hg),血钾大于4.0 mmol/L。两组患者均行后腹腔镜手术,术前详细告知TA与PA的利弊,根据患者意愿选择手术方式,若术中考虑多发腺瘤可能则直接行患侧TA。术后若出现皮质激素不足相关表现则短期予以口服或静脉补充激素治疗。手术均由具备高级专业技术职务的医师完成。具体手术方法:行PA时仔细分离出肾上腺瘤体,用吸引器钝性分离其周围组织,小的血管用超声刀处理,最后将肿瘤与正常肾上腺组织锐性分离。行TA时游离的肾上腺中央静脉用Hem-o-lok双重钳扎后切断,将肾上腺完整切除。
1.4 观察指标
观察两组患者手术时间、术中出血量、术后住院时间(出院标准为患者生命体征平稳,普食,切口引流管拔除,肾上腺功能基本正常)、术后血红蛋白降低数值、围术期输血率、围术期并发症、术后醛固酮水平、术后血钾水平、术后血压、术后激素补充、术后病理情况等。根据术后随访结果,运用PASO标准[5]进行结果分类,(1)临床结果分类:①完全缓解为血压正常(收缩压小于140 mm Hg和舒张压小于90 mm Hg),无须使用抗高血压药物;②部分缓解为服用较少的降压药物可维持与术前相同的血压或服用相同数量或更少的降压药物可降低血压;③无缓解为血压不变或血压升高伴随降压药物剂量不变或增加。(2)生化结果分类:①完全缓解为术后血钾正常(若术前合并低钾血症)及醛固酮/肾素比值正常或术后醛固酮/肾素比值升高,确诊试验中醛固酮可被抑制;②部分缓解为术后血钾正常(若术前合并低钾血症),术后醛固酮/肾素比值升高,且包括以下情况中的1种或2种:血浆醛固酮基线浓度降低大于或等于50%或异常但术后确认试验结果有所改善;③无缓解为持续性低钾血症(若术前合并低钾血症)或醛固酮/肾素比值持续升高或二者兼有,但术后抑制性试验未能抑制醛固酮分泌。总体临床(生化)缓解率=(完全缓解例数+部分缓解例数)/总例数×100%。两组患者均随访6~72个月,中位24个月,门诊随访血钾、醛固酮肾素及血压情况,CT检查随访肿瘤复发情况。
1.5 统计学处理
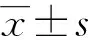
2 结 果
2.1 两组患者一般资料比较
两组患者年龄、手术侧别、体重指数、高血压病程、术前影像学检查肿瘤直径、血钾、肾素、术前血压水平、服用降压药物种类、术前初筛阴性率及低血钾率比较,差异均无统计学意义(P>0.05)。两组患者性别、醛固酮水平、术前AVS比例比较,差异有统计学意义(P<0.05)。TA组患者术侧多位于左侧,PA组患者两侧相当,见表1。

表1 两组患者一般资料比较
2.2 两组患者围术期及术后病理资料比较
245例患者均手术成功,无术中输血及中转开放手术者。两组患者手术时间、术中出血量、24 h血红蛋白下降值、围术期输血率、术后临床指标、术后住院时间、术后激素补充百分比、围术期并发症发生率比较,差异均无统计学意义(P>0.05);PA组患者中皮质腺瘤116例(95.9%),皮质结节状增生3例(2.5%),弥漫性增生2例(1.6%);TA组患者中皮质腺瘤97例(78.2%),结节状增生13例(10.5%),弥漫性增生14例(11.3%),多发瘤15例(12.1%),见表2。CT及病理检查图片见图1。

表2 两组患者围术期及术后病理资料比较
2.3 两组患者临床、生化结果及复发情况比较
245例患者中临床完全缓解149例(60.8%),部分缓解86例(35.1%),无缓解10例(4.1%);生化完全缓解226例(92.2%),部分缓解13例(5.3%),无缓解6例(2.5%)。PA组患者完全临床缓解率较高(62.0%),TA组患者部分临床缓解率较高(37.9%),TA组患者总体临床缓解率[97.6%(121/124)]、总体生化缓解率[99.2%(123/124)]、复发率(0)与PA组[分别为94.2%(114/121)、99.2%(123/124)、2.5%(3/121)]比较,差异均无统计学意义(P>0.05),见表3。TA组患者随访期内血钾均已在正常水平,8例患者醛固酮/肾素比值升高,7例患者行卡托普利抑制试验可被抑制,1例患者行卡托普利抑制试验不可被抑制;PA组患者中术后仍存在持续性低钾血症2例,3例患者醛固酮/肾素比值升高且卡托普利抑制试验不可被抑制。PA组1例复发患者为肿瘤切除术后7个月,再次出现高血压伴低血钾,复查CT提示同侧肾上腺残端结节状影,行患侧肾上腺切除术,病理检查提示肾上腺皮质结节状增生,术后高血压伴低血钾无明显改善,复查CT考虑仍有实质性肿物,后予以内科保守治疗;2例术后复发患者拒绝再次行手术治疗,予以内科保守治疗。
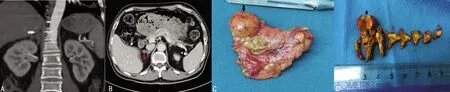
A、B:箭头显示腺瘤;C、D:黑色箭头显示CT可见腺瘤,红色箭头显示CT不可见微腺瘤。
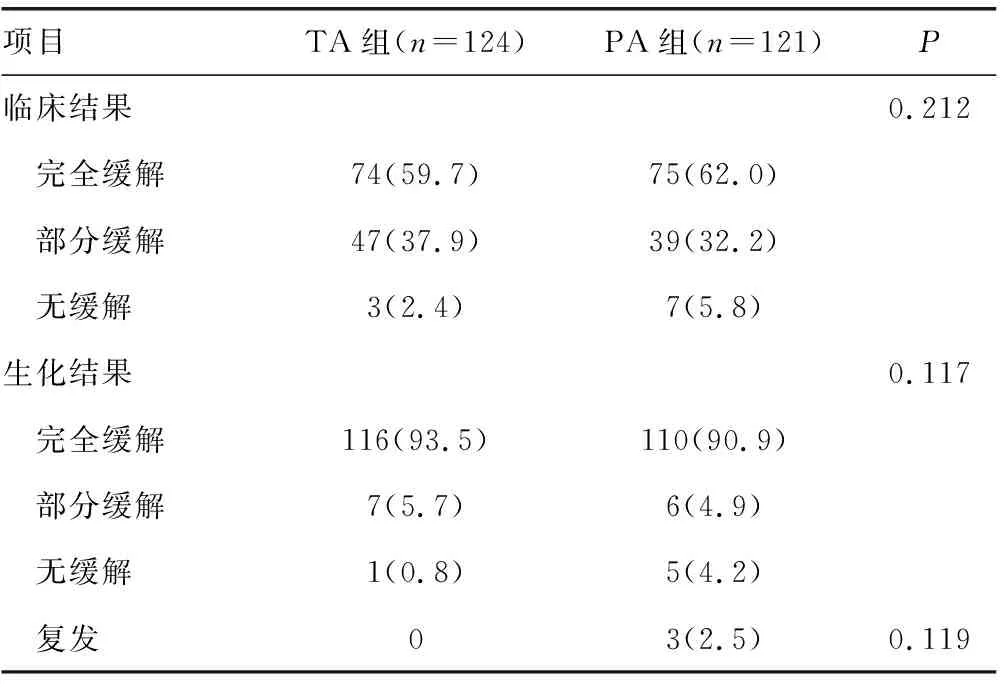
表3 两组患者临床、生化结果及复发情况比较[n(%)]
3 讨 论
有研究表明,在高血压人群中可能有高达15%的人患有PHA[7],同时最近有研究表明,我国初诊高血压患者PHA患病率至少为4.0%[8]。与原发性高血压患者比较,由于血清醛固酮水平是增加心血管事件发生率的独立因素[9],PHA患者更早且更易发生心、脑、肾等靶器官损害,这些患者即使血压控制良好也会发生心、脑、肾等靶器官损害,而经手术或药物治疗后的PHA患者随着血浆高醛固酮水平或作用下降,其靶器官损害的风险也会明显降低[10]。因而PHA的早期诊断非常重要。目前,我国PHA的诊断、研究水平相对滞后,不少医师(甚至专科医师)尚停留在根据“高血压伴低血钾”的线索筛查PHA的“初级水平”[11]。尽管高血压、低血钾被认为是PHA最典型的临床表现,但有研究表明,只有9.0%~37.0%的PHA患者可存在低钾血症[12],由于其灵敏度和特异度较低,在PHA的诊断中的预测价值有限。本研究患者中合并低钾血症189例(77.1%),若以低血钾作为筛查指标,将漏诊不少PHA患者,因此,仍需加强PHA的筛查。
PHA的分型诊断一直是临床上的难点,目前,主要通过生化检查结合CT及AVS进行分型。肾上腺CT在诊断上存在一定局限性,部分CT表现为双侧结节的醛固酮瘤可被误诊为特发性醛固酮增多症,而CT检查表现为肾上腺微腺瘤的特发性醛固酮增多症也可被误认为醛固酮瘤而行单侧肾上腺切除术。此外,在40岁以上患者中单侧肾上腺无功能腺瘤并不少见。单纯依靠CT检查进行定位诊断可能导致不必要的手术治疗。而AVS对区分PHA有无优势分泌侧有着重要价值。有研究表明,AVS诊断PHA的灵敏度和特异度均可达到90.0%以上,而CT检查仅为78.0%和75.0%[12-13]。本研究结果显示,AVS和CT检查诊断准确率分别为89.4%和76.4%,与以往研究结果一致,因此,应将AVS作为PHA分型诊断的“金标准”。
目前,有研究表明,单侧APA患者通过手术几乎能达到治愈效果,因此,单侧APA患者的诊断及手术治疗显得非常重要。相对于传统开放手术,腹腔镜手术具有微创、围术期并发症少、术后恢复快等特点[14]。自1992年GAGNER等[15]报道腹腔镜肾上腺切除术以来,目前TA已成为治疗醛固酮瘤的标准选择[16-17]。而WALZ等[18]于1996年描述了腹腔镜PA治疗APA,近年来采用PA治疗单侧APA的文献报道也越来越多,但由于其存在复发的可能性,对其应用仍存在争议。目前,关于PHA患者是行单纯腺瘤切除还是行患侧TA,目前尚有争议。2014年中国泌尿外科指南推荐醛固酮瘤患者首选腺瘤切除,如疑为多发醛固酮瘤者推荐行患侧TA[1]。2020年中华医学会内分泌学分会肾上腺学组《原发性醛固酮增多症的诊断及专家共识》推荐,确诊醛固酮瘤或单侧肾上腺增生患者行腹腔镜单侧肾上腺切除术,该共识指出,患者病侧肾上腺往往存在多发性病灶,而单纯肿瘤切除可能存在遗留肿瘤部分包膜,导致术后复发[19]。
迄今为止的研究表明,腹腔镜PA在技术上是安全的,且TA和PA的围术期并发症和手术结果相似[20-21]。有研究表明,因APA通常很小且孤立,位于腺体边缘,所以可作为PA的良好适应证[22]。而且对单侧APA患者,腹腔镜PA的最大优势是可保留部分具有功能的肾上腺皮质,以防对侧肾上腺由于其他原因需进一步切除而导致功能缺陷[23-24]。因此,KAYE等[25]主张,腹腔镜PA可作为治疗小肾上腺肿瘤的一线疗法。但其也表明,PA复发率可达3.0%[25],而且ISHIDOYA等[21]同样认为,PA存在术后复发率高的风险,故推荐对单侧APA采取PA。
本研究结果显示,两组患者术中出血量、24 h血红蛋白下降值、围术期输血率、术后临床指标、术后住院时间比较,差异均无统计学意义(P>0.05)。同时两组患者术后皮质醇分泌不足需长期激素替代治疗患者比例比较,差异也无统计学意义(P>0.05),与上述相关研究结果一致[20,25]。对出现皮质醇不足的患者及早通过短期激素替代治疗而使症状得以缓解,避免出现肾上腺危象的可能,术后6个月随访时皮质醇均已达到正常。而本研究TA组患者术后补充激素的概率大于PA组(分别为19.4%、10.7%),则可能是由于切除一侧肾上腺后导致一过性激素分泌不足,短期内即可通过对侧肾上腺代偿分泌激素使自身激素达到平衡。两组患者手术时间比较,差异无统计学意义(P>0.05),TA组患者手术时间较长,考虑与TA需游离周围重要器官及结扎肾上腺中央静脉,故手术难度加大,且损伤周围器官的风险较高有关。而本研究手术均由具备高级专业技术职务且手术经验丰富的医师完成,故两组患者围术期并发症发生率比较,差异无统计学意义(P>0.05)。
对APA患者,评价手术疗效的主要指标仍是临床及生化结果的缓解程度。本研究创新性选用PASO标准[5]评价手术成功性。在最长6年的随访期中,245例患者中临床完全缓解149例(60.8%),部分缓解86例(35.1%),无缓解10例(4.1%);生化完全缓解226例(92.2%),部分缓解13例(5.3%),无缓解6例(2.5%)。两组患者临床缓解率、生化缓解率比较,差异均无统计学意义(P>0.05)。总体临床缓解率达95.9%,总体生化缓解率达97.5%,而先前提到的PASO研究中临床和生化缓解率分别为84.0%、94.0%。以往研究中,生化缓解率一直保持在一个较高水平,而临床缓解率的差异则相对比较大[5]。本研究生化缓解率(97.5%)依然在较高水平,临床缓解率(95.9%)也达到了一个高水平。本研究对所有患者在盐水负荷试验、卡托普利试验、氟氢可的松3种确诊试验至少完善2项,且至少1项为阳性,同时对术前影像学肿瘤直径较小的病例也结合患者意愿完善了双侧AVS明确定位。有研究表明,AVS是PHA定位诊断的“金标准”。当CT检查提示肾上腺未见明显异常、单侧肢体增厚、单侧较小(≤2 cm)肿瘤时均应同时行AVS,并将AVS结果作为最终判定优势分泌侧的依据[26]。因此,本研究中的病例术前定性定位诊断均明确,手术疗效可能与此相关。本研究中术后仍有少部分患者临床无缓解[4.1%(10/245)],仍需服用较大剂量降压药物维持血压稳定,这部分患者则考虑可能与长期高血压导致靶器官损害或与伴发的原发性高血压相关,手术无法逆转病情,只能改善或延缓病情进展,但仍对其有益[27]。
针对APA,不支持应用PA的主要原因在于其可能无法完全去除高分泌醛固酮的病灶,术后复发率较高。本研究结果显示,TA组患者无复发,PA组患者中复发3例(2.5%),虽然两组患者复发率比较,差异无统计学意义(P>0.05),但仍会影响到对手术方式的选择。有学者认为,10.0%~25.0%的PHA患者肾上腺周围有许多结节样增生,对结节样增生术前影像学检查无法全部确诊,并且这些结节可能参与了醛固酮的分泌,与TA比较,肾上腺肿瘤切除术易残留有分泌功能的隐匿性腺瘤,并存在术后复发的风险[28]。本研究中TA组患者术后病理检查发现多发病灶15例(12.1%),包含CT检查无法发现的微腺瘤及结节样增生,而3例复发患者表现为再次出现高血压伴低血钾,同时复查CT提示术侧肾上腺残端出现腺瘤样或结节状增生改变,可能为复发的原因之一。最近的组织病理学研究表明,在AVS显示单侧患者中高达27.0%的患者可出现肾上腺增生合并腺瘤、增生或多发性腺瘤[29-30],肾上微腺瘤及微小结节样增生以肾上腺表面毫米级微结节形成为主要病理改变[31],传统检查方法包括传统CT检查及AVS均难以确诊。同时ENBERG等[32]通过对术后病理检查组织进行基因检测表明,部分微腺瘤或结节可分泌大量醛固酮,这些病灶的存在可能为术后复发的原因。因此,建议单侧APA患者行患侧TA。当然也有研究表明,单侧APA患者对侧可能也有影像学检查尚未发现的微腺瘤[33],可能也是术后复发的原因之一,但目前尚无更多的证据证明。
本研究的局限性主要在于其为回顾性分析,这种局限性在PHA的研究中经常遇到,主要是因为其发病率相对较低。回顾性分析存在偏差,包括选择偏差,通常与队列中的少数患者和缺乏随机化有关,而本研究中两组患者性别比较,差异有统计学意义(P<0.05),即考虑为选择偏差;另一个局限性是在本研究中部分病例缺乏AVS[65.7%(161/245)]。美国指南认为,AVS是术前检查的必要步骤。但这与国情相关,AVS作为一种有创操作,并非所有医学中心均可开展,且该检查费用较高。2020年中华医学会内分泌学分会肾上腺学组《原发性醛固酮增多症的诊断及专家共识》推荐,如患者愿意手术治疗且手术可行、肾上腺CT检查提示单侧或双侧肾上腺形态异常(包括增生或腺瘤)需进一步行双侧AVS以明确有无优势分泌[19]。本研究最短随访期为6个月,这对长期并发症(即PHA复发)的评估可能时间太短,然而,值得注意的是,本研究中位随访时间为24个月,与大多数检查PHA复发率研究的随访时间一致[4]。
综上所述,根据PASO共识标准,腹腔镜TA与PA治疗单侧APA疗效性、安全性相当,但PA存在较高的复发率,且存在遗留多发微腺瘤可能,同时PA并未在术后皮质醇不足方面表现出明显优势,故对单侧APA患者建议行单侧TA。同时建议PHA患者在术前详细完善定性定位检查确诊,以获得更好的术后疗效。最终仍需进行多中心、随机、前瞻性研究明确单侧APA的最佳治疗方案。
