miR-1-3p抑制肝癌细胞SMMC-7721增殖、迁移并诱导其凋亡*
2021-11-20刘雨潭孔艺璇王一同苏静慧卢鸿健王梅梅熊亚南章广玲
刘雨潭,孔艺璇,王一同,苏静慧,卢鸿健,王梅梅,熊亚南△,章广玲
(1.河北省慢性疾病重点实验室/唐山市慢性病临床基础研究重点实验室/华北理工大学基础医学院,河北 唐山 063000;2.华北理工大学临床医学院,河北 唐山 063000;3.河北省医工融合精准医疗重点实验室,河北 唐山 063000)
肝癌是仅次于肺癌、结肠癌和胃癌的第4类癌症相关致死原因,肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌类型,占75%~90%,患者被检出时多数已处于晚期,因此,治疗及预后效果均较差[1-3];寻找早诊断、早治疗的靶点是目前研究的热点之一。微小RNA(micro RNA,miRNA)是一组20~22碱基长度的非编码RNA分子,是转录后水平上基因表达的负调控因子。miRNAs异常表达常见于多种人类恶性肿瘤。有研究表明,miRNA在细胞凋亡和生长乃至癌的转移和侵袭过程中具有关键作用[4-5]。其中miR-1-3p参与了包括前列腺癌、膀胱癌、肺癌、结直肠癌等癌症的发生、发展[6-9];但在肝癌发病过程中的作用知之甚少。本研究通过检测miR-1-3p及其预测靶基因在肝癌细胞系SMMC-7721中的表达水平,并结合过表达和敲低表达技术,探讨了miR-1-3p对该肿瘤细胞系生物学行为的影响及其作用机制,现报道如下。
1 材料与方法
1.1 材料
质粒pcDNA3和pcDNA3/pri-miR-1-3p均由天津医科大学生命科学中心实验室汤华教授赠予,NC inhibitor、miR-1-3p inhibitor均购自锐博生物公司;实验用LO2和SMMC-7721细胞系均购自中国科学院上海细胞库,杜氏改良Eagle培养基(Dulbecco′s modified Eagle medium,DMEM)、胰酶、抗青霉素和链霉素双抗均购自美国Gibco公司,实时荧光定量聚合酶链反应(qRT-PCR)试剂盒、Lipofectamine 2000 Reagent、Trizol Reagent、Opti-MEM细胞培养基均购自美国Invitrogen公司。
1.2 方法
1.2.1细胞转染
收集细胞后按8×105个/孔,体积为100 μL均匀接种于6孔板。补充含10%血清的DMEM,5%二氧化碳、37 ℃过夜。细胞密度到达板底面积的70%~90%。按照Lipofectamine 2000说明书分组转染人肝癌细胞系SMMC-7721:分为转染pcDNA3/pri-miR-1-3p质粒(miR-1-3p组)、转染pcDNA3空载质粒(pcDNA3组)、转染miR-1-3p inhibitor(miR-1 inhibitor组)及其对照(NC inhibitor组)。
1.2.2分析miR-1-3p水平和临床信息
登录TCGA数据门户下载肝癌相关miRNA和临床信息。对比miR-1-3p在正常肝组织、原发及复发性肝癌组织中的水平,并对不同分期miR-1-3p的表达进行比较分析。采用单因素生存分析比较miR-1-3p与肝癌患者总生存率(overall survival,OS)的关系。
1.2.3qRT-PCR检测miR-1-3p及 CAAP1 mRNA的相对表达水平
转染48 h后TRIzol法提取总RNA,逆转录合成cDNA。使用qRT-PCR法测定miR-1-3p和CAAP1相对表达水平。使用时将获得的逆转录产物反应液稀释50倍后作为模板,U6 的上下游引物和所有miRNA的下游引物由miRNA第一链cDNA合成试剂盒提供。miR-1-3p 上游:5′-GCC GTG GAA TGT AAA GAA GTA TG-3′,CAAP1 上游:5′-CTC CTT GCA GCA GGA AAC TA-3′,CAAP1 下游:5′-ATG ACA CAG TCA GGT CCA GT-3′。
1.2.4CCK-8实验检测增殖能力
细胞按照5×103个/孔均匀接种于96孔板中,每孔100 μL,培养过夜。分别于转染后0、24、48、72、96 h吸净原培养液,每孔加入100 μL培养液和10 μL CCK-8试剂,37 ℃孵育3 h后使用酶标仪在波长450 nm处检测每孔的吸光度值[10]。
1.2.5集落形成能力检测
SMMC-7721转染48 h后800个/孔接种于12孔板,5%二氧化碳、37 ℃继续培养14 d,吸出每孔培养液,用磷酸盐缓冲液(phosphate buffer solution,PBS) 冲洗,再用1%结晶紫进行染色,细胞数大于或等于50可视为集落,观察并计数[11]。
1.2.6流式细胞术检测细胞凋亡
SMMC-7721转染48 h后重悬细胞,使用Annexin V-FITC试剂盒进行细胞凋亡检测,加入AnnexinV-FITC和PI staining solution各5 μL,轻轻混匀,室温放置,避光作用 10 min后用仪器检测染色细胞。
1.2.7Western blot检测蛋白水平
SMMC-7721转染48 h后吸弃原培养基,PBS冲洗3次,加入300 μL RIPA裂解液,冰浴摇30 min,14 000 r/min离心。在10%的十二烷基硫酸钠-聚丙稀酰胺上分离且转移到聚丙稀酰胺膜上,加入抗caspase-3(1∶200)或抗CAAP1(1∶500),4 ℃孵育过夜。用TBST洗3次,在室温下与羊抗兔(1∶2 000)孵育2 h。1×TBST冲洗4次,每次5 min,同时配制ECL显色液,避光。聚丙稀酰胺膜于显影液反应大概1 min后采用凝胶成像仪成像。采用ImageJ软件分析条带灰度。
1.2.8划痕实验检测迁移能力
SMMC-7721转染48 h后消化并计数,向24孔板中加入500 μL细胞悬液(8×104个),每组3个复孔,于培养箱24 h。用100 μL枪头尖端进行划痕创面处理,PBS清洗3次,加入新鲜培养基,在倒置相差显微镜下观察并拍照,培养24 h,用PBS洗3次,计算细胞迁移的平均距离和标准差并绘制柱状图。
1.2.9Transwell检测迁移和侵袭能力
1.2.9.1迁移能力
SMMC-7721细胞分组转染48 h后用PBS清洗2次,0.25%胰酶消化、计数,按照5×104个/孔量至1.5 EP管中,离心后用 200 μL DMEM重悬细胞,移入Transwell上层小室,迁移下室加600 μL 20%血清的DMEM,于培养箱中培养24 h,结晶紫染色,显微镜计数。
1.2.9.2侵袭能力
先在上层小室预铺一层 metrigel 胶(1 mg/mL),通过细胞计数板计数,按照1×105个/孔的量至1.5 EP管中,离心后用 200 μL DMEM重悬细胞移入Transwell上室,加600 μL含30%血清的DMEM进行侵袭实验。培养24 h后用棉签轻轻擦去小室膜上方的细胞,结晶紫染色,显微镜计数。
1.2.10双荧光素酶报告载体实验验证CAAP1是miR-1-3p的直接靶基因
构建双荧光报告载体pcDNA3/EGFP-miR-1-CAAP1-3′UTR和pcDNA3/EGFP-miR-1-CAAP1-3′UTR-mut载体,与pri-miR-1-3p共转染SMMC-7721细胞在48孔板中。转染48 h后用RIPA裂解液裂解细胞。测定蛋白样品中EGFP(报告分子)和RFP(内参)表达强度。
1.3 统计学处理
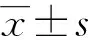
2 结 果
2.1 miR-1-3p在HCC中表达与预后的关系
原发性和复发性肿瘤中miR-1-3p的表达较正常组织明显降低,差异有统计学意义(P<0.05),见图1A;miR-1-3p在不同肝癌分期中的表达无显著差异,见图1B;miR-1-3p低表达水平与较短总生存期相关(P<0.05),见图1C。
A:肝癌组织与正常肝组织比较;B:在不同肝癌分期组织中的表达;C:miR-1-3p高表达患者与miR-1-3p低表达患者比较;*:P<0.05。
2.2 miR-1-3p在SMMC-7721细胞和LO2细胞中的表达
SMMC-7721中miR-1-3p相对表达水平明显低于LO2,差异有统计学意义(P<0.05),见图2。
2.3 过表达或沉默内源性miR-1-3p后SMMC-7721中miR-1-3p的表达
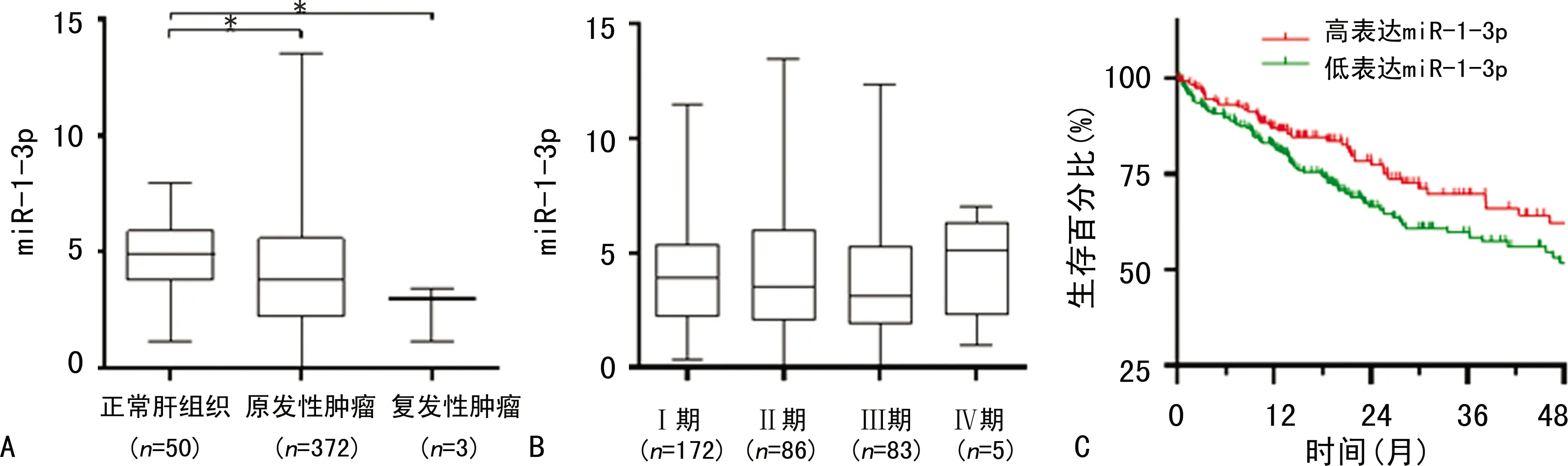
miR-1-3p组miR-1-3p表达水平较pcDNA3组明显升高,差异有统计学意义(P<0.05);miR-1 inhibitor组miR-1-3p表达水平较NC inhibitor组明显下降,差异有统计学意义(P<0.05),见图3。
2.4 miR-1-3p对SMMC-7721细胞增殖的影响
miR-1-3p过表达抑制了SMMC-7721细胞增殖,差异有统计学意义(P<0.05),见图4A;沉默miR-1-3p后促进了细胞的增殖,差异有统计学意义(P<0.05),见图4B。
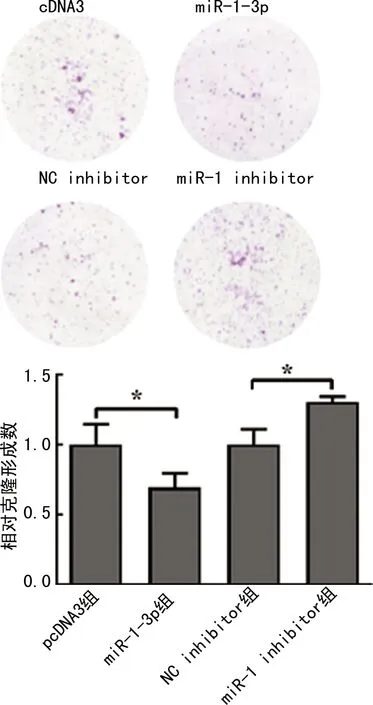
2.5 miR-1-3p对SMMC-7721细胞集落形成能力的影响
SMMC-7721中上调miR-1-3p组集落数明显少于pcDNA3组,差异有统计学意义(P<0.05);沉默miR-1-3p后集落形成数较NC inhibitor组明显增加,差异有统计学意义(P<0.05),见图5。

*:P<0.05。
*:P<0.05。
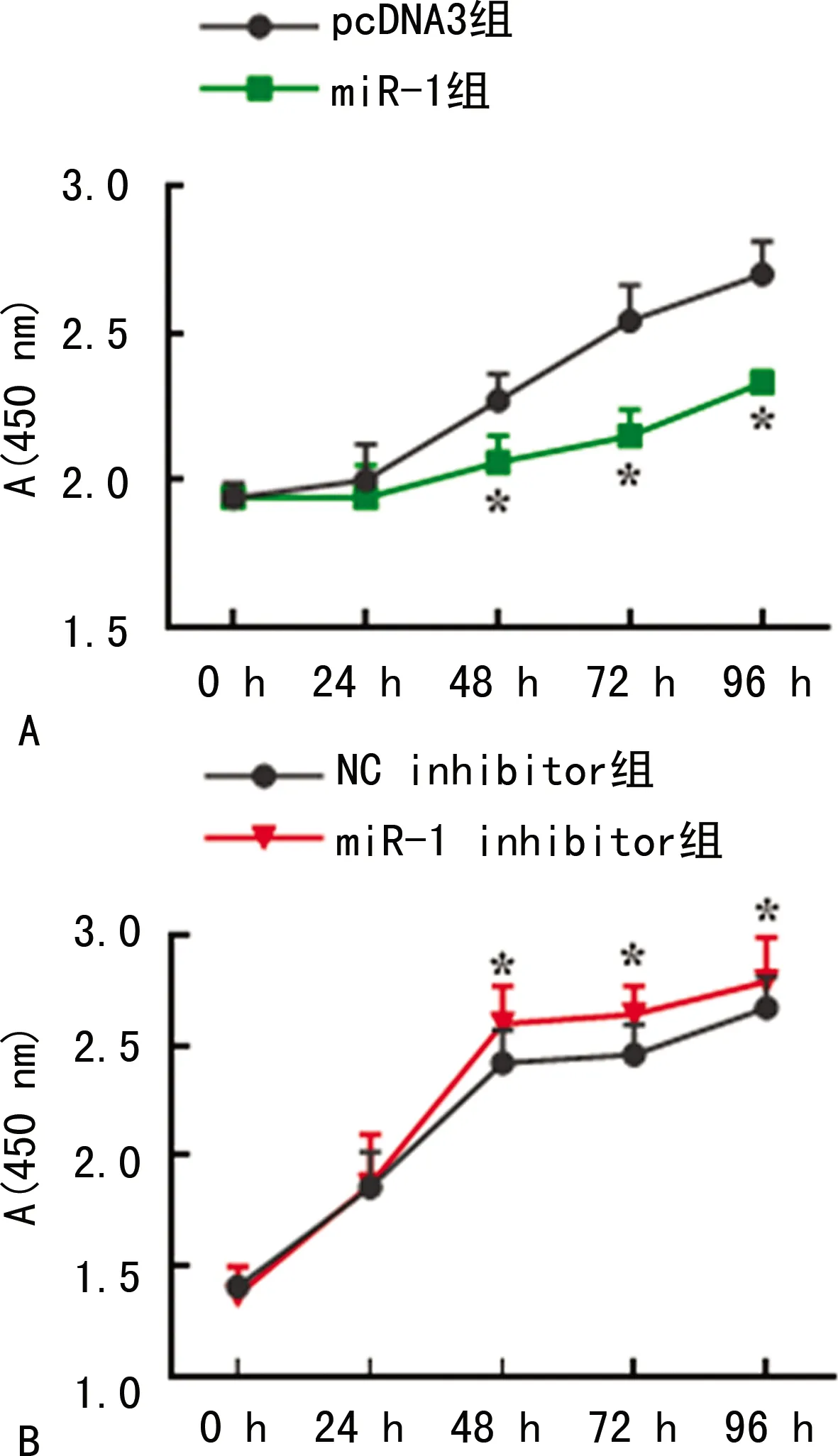
A:miR-1-3p对SMMC-7721细胞增殖的影响;B:干扰miR-1-3p对SMMC-7721细胞增殖的影响;*:P<0.05。
2.6 miR-1-3p对SMMC-7721凋亡的影响
与pcDNA3组比较,miR-1-3p组明显增强了细胞凋亡,差异有统计学意义(P<0.05)。沉默miR-1-3p后SMMC-7721凋亡率明显低于NC inhibitor组,差异有统计学意义(P<0.05),见图6A;与pcDNA3组比较,miR-1-3p组cleaved caspase3蛋白水平明显增加,差异有统计学意义(P<0.05);与NC inhibitor组比较,沉默miR-1-3p后cleaved caspase3蛋白水平明显减少,差异有统计学意义(P<0.05),见图6B。
*:P<0.05。
2.7 miR-1-3p对SMMC-7721迁移能力的影响
miR-1-3p组细胞迁移距离和迁移量均较pcDNA3组明显减少,差异均有统计学意义(P<0.05);沉默miR-1-3p后细胞迁移距离和迁移量均较NC inhibitor组明显增多,差异均有统计学意义(P<0.05),见图7。
2.8 miR-1-3p对SMMC-7721细胞侵袭能力的影响
miR-1-3p组SMMC-7721侵袭量较pcDNA3组明显减少,差异有统计学意义(P<0.05);沉默miR-1-3p后细胞侵袭量较NC inhibitor组明显增多,差异有统计学意义(P<0.05),见图8。
2.9 miR-1-3p对CAAP1靶向作用
利用miRDB、TargetScan、miRanda数据库预测miR-1-3p与CAAP1-3′UTR上存在高度保守的互补序列,见图9A;miR-1-3p与CAAP1-3′UTR-EGFP共转染组EGFP/RPF荧光强度比值明显减少,差异有统计学意义(P<0.05),见图9B;当CAAP1的3′UTR与miR-1-3p结合区域突变后过表达miR-1-3p不能影响EGFP/RPF荧光强度。上调miR-1-3p可明显降低CAAP1 mRNA和蛋白表达;相反下调miR-1-3p表达可提高SMMC-7721细胞中CAAP1 mRNA和蛋白相对表达水平,差异均有统计学意义(P<0.05),见图9C、D。
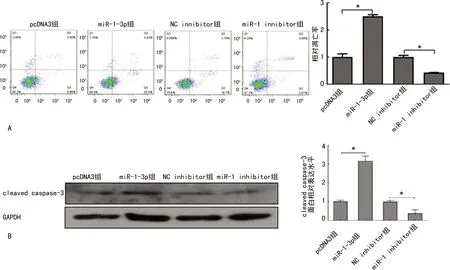
A:流式细胞术检测;B:Western blot检测;*:P<0.05。
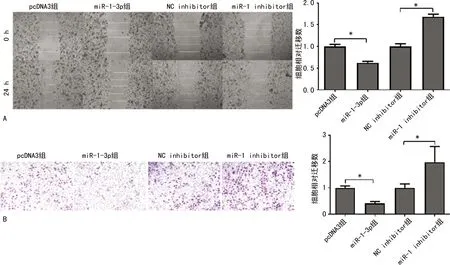
A:划痕实验;B:Transwell实验;*:P<0.05。

*:P<0.05。

A:序列比对;B:荧光素酶报告;C:RT-qPCR检测;D:Western blot检测;*:P<0.05。
3 讨 论
miRNA过度表达或下调导致蛋白质表达失调,从而通过调节细胞增殖、血管生成和侵袭而导致肿瘤的发生[12]。miRNAs在许多肿瘤发生、发展过程中均被下调,包括肝癌[13]。基于miRNA的肝癌发生、发展机制及治疗靶点研究将会对肝癌的预防、诊治具有重大意义。以往研究证实,miR-1-3p在多种癌症组织中呈现低表达,通过人为干预致其过表达可抑制多种癌细胞的增殖和迁移[6-9]。然而,在肝癌细胞增殖、迁移乃至侵袭过程中miR-1-3p及其下游靶基因的作用有待于深入研究。
本研究中首先通过对TCGA数据库肝癌相关临床数据进行初步统计和分析,结果显示,与正常对照组比较,miR-1-3p在HCC患者中表达下调,且HCC患者miR-1-3p低表达预示生存率降低,意味着miR-1-3p在HCC的发生、发展中可能具有关键作用。在此基础上本研究进一步通过体外培养肝癌细胞系SMMC-7721并给予miR-1-3p干预,结果显示,miR-1-3p不仅抑制肝癌细胞SMMC-7721的增殖乃至集落的形成,对其迁移、侵袭能力也表现出一定的拮抗作用,同时促进了该细胞的凋亡。为进一步探索miR-1-3p对上述生物学功能的具体机制,尤其是关键靶向基因,本研究利用miRDB、TargetScan、miRanda数据库筛选并推测miR-1-3p潜在靶向调控基因之一为CAAP1。CAAP1 mRNA和蛋白质水平上不同程度表达于人类来源的每个正常(成人和胎儿)和癌症组织中,并表现出具有几个良好保守结构域的进化保留结构。具体而言,通过生物信息学分析预测CAAP1的中心区域与意味着在凋亡信号传导中起作用的死亡效应域共享结构相似性。其作用需要相互依赖的caspase激活网络。在A-549、MCF-7/casp3-10b细胞系中抑制CAAP表达可诱导细胞凋亡[14]。在Sézary综合征检测到CAAP1表达水平的变化。不同研究表明,CAAP1在不同疾病中表现出致癌基因的作用[15]。本研究双荧光报告载体实验双荧光素酶报告载体实验结果显示,miR-1-3p直接与CAAP1的3′-UTR结合,证实miR-1-3p与CAAP1的靶向关系。qRT-PCR和Western blot实验证实,miR-1-3p在mRNA乃至蛋白表达水平上负调控CAAP1表达。
综上所述,本研究在证实了miR-1-3p对肝癌细胞SMMC-7721 的增殖、迁移和侵袭的明显抑制作用基础上发现其作用机制可能是通过负调控CAAP1的表达抑制肝癌细胞的上述恶性生物学行为。提示miR-1-3p可能成为HCC新的治疗靶点,为HCC临床靶向治疗提供了理论和实验依据。
