罕见M+Le(a+) HDFN病例1例并文献复习*
2021-11-20何英第漆洪波李俊男
乔 娟,何英第,张 利,漆洪波,李俊男
(重庆医科大学附属第一医院产科/重庆市胎儿医学中心 400016)
胎儿和新生儿溶血病(hemolytic disease in the fetuses and newborns,HDFN)是由于胎儿与其母体红细胞血型不相容,来自母体的免疫球蛋白G型红细胞抗体作用于胎儿红细胞从而引起溶血,严重者可导致胎儿贫血、水肿,甚至死亡,因此,必要时需进行孕期宫内输注红细胞或出生后给予输血治疗等[1]。我国大部分地区对HDFN认识有限,对孕妇的抗体筛查尚不全面,并且产前治疗也仅在少数医疗中心内开展,因此,HDFN仍然是我国胎儿和新生儿发病和死亡的常见原因[2]。
近期本中心首次发现了1例M+Le(a+)同种异体免疫导致严重HDFN的罕见病例,该病例以“不明原因胸腔积液”为首发表现住院治疗,并且既往有不明原因的新生儿死亡病史。提醒医师需要在妊娠管理中重视对胸腔积液等不典型胎儿水肿孕妇进行不规则抗体及大脑中动脉收缩期峰值流速(middle cerebral artery peak systolic velocity,MCA-PSV)筛查,警惕稀有血型不合导致HDFN的发生。
1 资料与方法
1.1 一般资料
孕妇,33岁,G3P1。孕期规律产检,行无创基因检查未见明显异常,未行羊水穿刺检查,行系统超声检查未见明显异常。孕妇血型A型,Rh(+),配偶血型O型,Rh(+)。妊娠31+3周,孕妇无明显不适,自觉胎动如常,产科超声检查提示:胎儿心胸比约0.43,室壁增厚。胸腔可见少量游离无回声区,宽度约0.3 cm。脐动脉S/D值为2.89,搏动指数(pulsatility index,PI)为1.08。大脑中动脉S/D值为5.00,PSV为86.3 cm/s。羊水指数为152 mm,后行胎儿磁共振成像检查结果与超声检查结果基本一致,遂以“胎儿贫血查因”于妊娠31+6周入院治疗。该孕妇4年前人工流产1次,3年前因“妊娠33周自觉胎动减少3 d,胎心监护无反应型”,考虑“胎儿窘迫”行急诊剖宫产术终止妊娠,术中见羊水Ⅲ度,该新生儿出生时Apgar评分3分(肤色2分、反射2分、肌张力1分、呼吸1分、心率1分),5 min Apgar评分8分(肤色2分),10 min Apgar评分9分(肤色1分),该新生儿转至新生儿重症监护病房在气管插管下积极治疗6 h后因抢救无效死亡。
1.2 诊治方法
该孕妇此次入院后给予以地塞米松促胎肺成熟、硫酸镁保护脑神经等支持治疗,并检查“不规则抗体阳性”,次日复查产科超声提示:脐动脉S/D值为2.06,PI为0.72,多次测量MCA-PSV最高达92.02 cm/s,达到2.02中位数的倍数(multiple of median,MOM),见图1。经与该孕妇沟通后拟启动胎儿宫内输血治疗,但考虑孕妇不规则抗体阳性,不排除该孕妇体内有免疫性抗体存在,故拟订先于超声引导下行脐血管穿刺确定胎儿血型,待配型成功后再予宫内输血。经脐血穿刺查胎儿血常规:红细胞1.14×12/L,血红蛋白52.0 g/L,红细胞比容17.30%,平均红细胞体积151.8 fL,平均红细胞血红蛋白量45.6 pg,平均红细胞血红蛋白浓度301.0 g/L。查胎儿血型:A型Rh(-)。胎儿血与O型Rh(-)供血及A型Rh(+)母亲血均合血失败,与O型Rh(+)父亲血合血成功,高度提示存在稀有血型不合的可能。与患方再次沟通后行急诊剖宫产术终止妊娠。术中见羊水清,新生儿出生时Apgar评分5分(呼吸1分、肌张力1分、反射1分、肤色2分),5 min Apgar评分7分(呼吸1分、肤色2分),10 min Apgar评分8分(肤色2分)。术中抽取脐动脉血查血常规:红细胞1.17×1012/L ,血红蛋白53.0 g/L ,红细胞比容17.80%,平均红细胞体积152.1 fL,平均红细胞血红蛋白量45.3 pg,平均红细胞血红蛋白浓度298.0 g/L。新生儿于新生儿重症监护病房给予输血等积极治疗,现随访1年患儿生长、发育与早产矫正同龄儿童无明显差异。
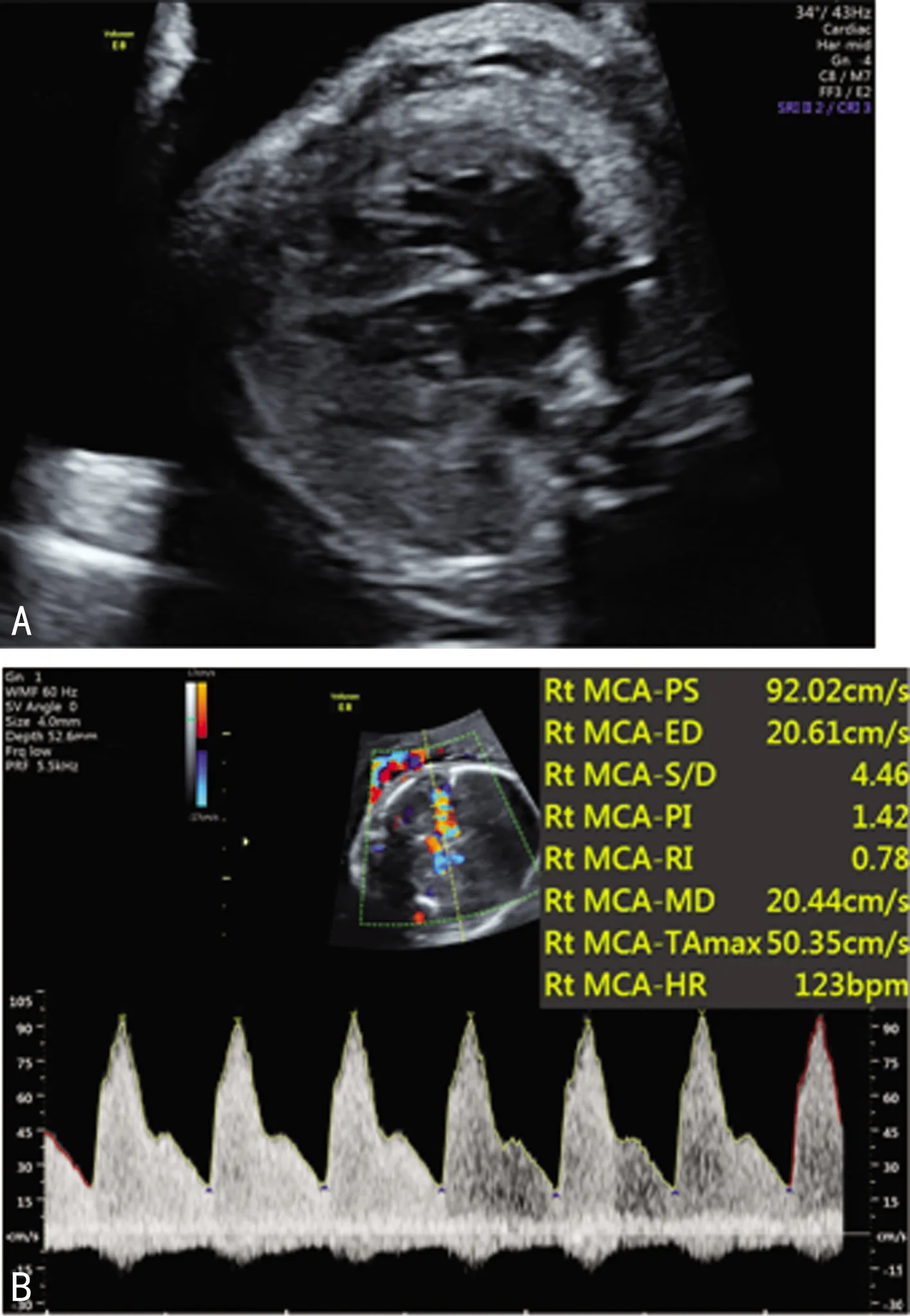
A:胎儿心胸比例增大,少量胸腔积液;B:胎儿MCA-PSV最高达92.02 cm/s。
1.3 血型检测
进一步检测父母及患儿血型结果见表1。母亲:A,CCDee,M-N+,S-s+,P2,Le(a-b+),K-k+,Fy(a+b-),Jk(a+b-);父亲:O,CCDee,M+N+,S-s+,P1,Le(a+b-),K-k+,Fy(a+b-),Jk(a-b+);患儿:A,CCdee,RhD(delEx9),M+N+,S-s+,P2,Le(a+b-),K-k+,Fy(a+b-),Jk(a+b+)。患儿与双亲的Kell血型和Duffy血型相同,与母亲的ABO血型和P血型相同,与母亲的Lewis血型和MN血型不同。虽然患儿的Rh血型、Kidd血型与双亲均不同,但胎儿期脐血与其父亲配型成功。
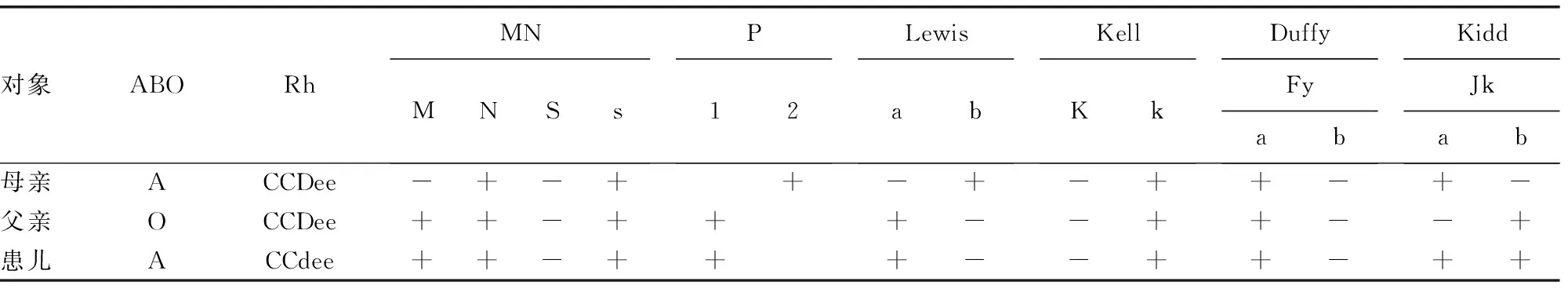
表1 患儿与双亲血型检测结果
2 结 果
该病例以“胎儿不明原因胸腔积液”为主要表现,既往有“晚孕期胎动减少、新生儿不明原因死亡”病史。经家系血型分析认为M+Le(a+)是导致该病例母儿血型不合的主要原因。结合文献分析MN血型或许与Lewis血型具有协同作用。
3 讨 论
HDFN与60多种不同红细胞抗体有关,其中抗-M抗体是目前孕妇体内发现的第2种最常见的非RhD抗体,大约有25%的孕妇缺乏M抗原[3]。虽然抗-M抗体一般无法经胎盘转移,但若胎盘屏障发生改变则会导致转运增加,因此,有关抗-M导致的 HDFN病例贫血严重程度也轻重不一[4]。近年来,亚洲人群发现抗-M同种异体免疫的病例数量较多[5]。有研究也发现,中国人群稀有血型系统中除Rh血型抗体最多外,依次为MN、Lewis、Kidd、Duffy、Diego和Kell血型抗体,而导致HDFN的病例中除Rh血型抗体外主要为MN血型抗体、Lewis血型抗体及P血型抗体[6]。
在有关中国人群中非ABO-HDFN的病例报道中,MN同种异体免疫抗体仅次于Rh血型系统,Lewis血型系统,位居第3[7]。MN系统的抗原表达在糖蛋白A、糖蛋白B或其他混合糖蛋白上,而Lewis抗原是一种容易从红细胞中洗脱和释放的外源性糖脂抗原,单纯抗-M、Lewis抗体常常不具有临床意义[6]。但有研究发现,一些有显著临床表现的HDFN中同时发现Lewis、P和MN(抗-M、抗-N)抗体存在,并且大多数涉及抗-M病例,抗-M常与其他抗体一起存在[8]。那么,与ABO血型不合对Rh同型免疫的保护作用不同[7-8],抗-M或许与Lewis等其他血型系统具有协同作用[9],使HDFN临床病情更加严重。那么,分析本例患者,可能因Le(a+)和抗-M同时存在,导致孕妇发生胎儿宫内死亡及本次妊娠出现不典型胎儿水肿的严重表现,因此,在发现存在多种稀有血型系统不合时需警惕严重HDFN的发生。
2014年英国皇家妇产科学会指南建议,MN血型不合孕妇应随访抗-M滴度水平,若抗-M>1∶64则建议进行胎儿监测和多普勒超声评估MCA-PSV MOM值。但近期有研究发现,同种异体抗-M滴度水平与HDFN严重程度无明显相关性[5]。另外免疫性溶血病常用的特异性指标——直接抗球蛋白试验(direct antiglobulin test,DAT)在79%的MN同种免疫的HDFN病例中为阴性[10],并且即使抗-M处于低滴度水平,DAT阴性或非常弱,也可能出现死胎、胎儿严重贫血等不良结局[11]。然而,多普勒超声指标——MCA-PSV诊断 HDFN病例中重度胎儿贫血的灵敏度达88%,特异性达82%,准确度达85%[12],因此,目前更加推荐采用MCA-PSV进行HDFN的孕期监测[1,13]。笔者认为,孕期首次产检中应进行父母双方血型的检查与记录,尤其是对具有不明原因死胎史、胎儿水肿史等HDFN高危孕妇,需进行血型及不规则抗体检查,以鉴别母儿血型不合情况。对HDFN高危孕妇,孕期应每月进行1次大脑中动脉多普勒血流的超声检查,关注MCA-PSV的变化及是否出现胎儿水肿等异常超声表现,以早期发现胎儿贫血状态。如高度怀疑胎儿贫血状态而血型不规则抗体阳性,那么高度提示可能存在免疫性溶血性贫血,则需进行夫妻双方ABO、Rh及稀有血型检测,以及行脐血管穿刺采样检查胎儿血型进一步确诊。
具有HDFN病史的孕妇再次妊娠时应从孕16~18周开始进行MCA-PSV监测,每周复查,如MCA-PSV>1.5 MOM则需每2~3天复查1次,如MCA-PSV持续大于1.5 MOM则需行脐血管穿刺采样检查,必要时给予宫内输血治疗,以便早期发现并早期纠正胎儿贫血状态,从而避免发生胎儿宫内死亡及围产儿不良结局[1]。
尽管HDFN的孕期治疗尚未达成共识,但目前研究较多的方法包括相容性红细胞宫内输血[14]、母体血浆置换、静脉注射免疫球蛋白及胎儿腹腔注射免疫球蛋白等。因此,对高度疑似罕见血型不合所致的HDFN病例若能转诊到相应的医疗中心进行胎儿血液取样和宫内治疗,以及开展新生儿早期救治或能最大限度地避免发生胎儿和新生儿不良围产结局。
