永生化人肝细胞中TNK1介导细胞凋亡的机制研究*
2021-11-20黄金羽韩小莹林荣团
黄金羽,韩小莹,闫 骏,蒋 媛,雷 蕾,林荣团△
(1.Lady Davis Institute,McGill University,Montreal,Canada,H3T 1E2;.天津市第一中心医院病理科 300192;3.陆军军医大学护理学院,重庆 400038)
众所周知,原发性肝癌是全球第六常见的癌症类型[1],但其恶性程度较高,易早期转移,病死率高居第2位,应重点关注。原发性肝癌最常见的类型为肝细胞癌,有资料显示约占总病例数的80%[2]。细胞凋亡是机体为维持体内环境稳定,由基因控制的细胞自主死亡的主动调控方式,是机体抑制细胞癌变的重要机制之一。在癌细胞中细胞凋亡机制多被破坏,其生长不再受限制,从而形成肿瘤。前期研究已证实,内源性途径是细胞凋亡的主要机制,其关键步骤之一是由B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因调节的线粒体外膜通透性增加导致细胞色素C释放,从而激活下游含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase),该通路在诱导细胞凋亡过程中至关重要[3]。酪氨酸激酶非受体1(tyrosine kinase non-receptor 1,TNK1)是目前已被发现的首个具有抑制肿瘤特性的酪氨酸激酶,TNK1能促进细胞凋亡,并在人胚胎肾细胞HEK293中获得初步证实,在人胰腺癌细胞中被发现具有致癌作用,TNK1在不同细胞类型中的功能和作用尚需进行个体化精准研究[4-7]。目前,对TNK1在肝癌细胞中介导细胞凋亡的机制尚少见文献报道,对该领域的深入研究必要而迫切。但由于前期研究已发现,人肝癌细胞中TNK1的表达受到明显抑制,极可能导致其引发的细胞凋亡途径无法激活,故本研究选择同一种属、同一器官的正常细胞系——人永生化肝细胞作为研究对象进行了实验研究。
1 材料与方法
1.1 材料
人永生化肝细胞系IHH购于美国AcceGen Biotechnology公司;人胚胎肾细胞系HEK293、人肝细胞癌细胞系HepG2、Huh7、Huh7.5均购于美国菌种保藏中心。盐酸多西环素粉末(#D9891)购于美国Sigma-Aldrich公司;依托泊苷粉末(#E1383)购于美国Sigma-Aldrich公司;线粒体蛋白分离试剂盒 (#89874)购于美国Thermo Fisher Scientific公司;人体组织标本由天津第一中心医院病理科闫骏博士提供,免疫组织化学法试剂盒购于美国Cell Signaling Technology公司,使用的抗体和染色包括anti-Glypican-3 (#ab216606;Abcam)、anti-TNK1 (#PA5-14795;Thermo Fisher Scientific)、H&E Staining Kit (#ab245880;Abcam)等;一抗[anti-TNK1(#4507)、anti-cleaved-PARP(Asp214;#5626S)、anti-caspase-3(#9662)、anti-cleaved-caspase-3(Asp175;#9661S)、anti-caspase-9(#9502)、anti-cleaved-caspase-9(Asp315;#20750S)、anti-Cytochrome c(#11940S)、anti-Bax(#5023S)、anti-Bak(#12105S)、anti-Bcl-2(#15071S)、anti-Bcl-xL(#2764S)、anti-Mcl-1(#94296S)]均购于美国Cell Signaling Technology公司;anti-微管蛋白(sc-5286)购于美国Santa Cruz Biotechnology公司;anti-β-actin (ABT264)购于美国Millipore公司;Annexin V APC、SYTOXTMGreen试剂盒(#V35113)购于美国Thermo Fisher Scientific公司,BD Fortessa流式细胞分析仪购于美国BD公司。
1.2 方法
1.2.1建立IHH rtTA-TNK1细胞模型
逆转录病毒载体由pTight-TNK1、pMLV-gag-pol、pVSV-G质粒瞬转染于HEK293细胞中包装完成;IHH rtTA-TNK1细胞模型由逆转录病毒载体感染IHH细胞制成。具体步骤:在100 mm细胞盘中铺入2×106HEK293细胞并培养24 h后用LipofectamineTM3000转染试剂(#L3000015;Invitrogen)转染6 μg pTight-TNK1、6 μg pMLV-gag-pol、2 μg pVSV-G质粒并培养48 h后过滤并收集上清液。在6孔细胞板中铺入3×105IHH细胞后培养24 h,加入上清液和10 μg/mL Polybrene(#638133;Millipore)并培养 24 h。将细胞转移至100 mm细胞盘中并用 2 μg/mL Puromycin (#A1113803;Thermo Fisher)筛选2周。收集储存被检验多西环素激活TNK1表达阳性后的存活细胞。
1.2.2多西环素处理
将多西环素粉末溶于水中制成多西环素溶液(1 mg/mL)。将多西环素溶液加入新鲜培养基至100 ng/mL(或其他指定质量浓度)后加入细胞板中,37 ℃处理24 h。
1.2.3依托泊苷处理
将依托泊苷粉末溶于二甲基亚砜(DMSO)中制成依托泊苷溶液(50 mmol/L)。将依托泊苷溶液加入新鲜培养基至100 μmol/L(或其他指定浓度)后加入细胞板中,37 ℃处理24 h。
1.2.4线粒体分离
收集2×107细胞并在常温3 000 r/min离心2 min后移除上清液,加入800 μL 试剂A并以中速振荡5 s后置于冰上处理2 min,加入10 μL 试剂B并以高速振荡5 s后置于冰上处理5 min且高速振荡1次,加入800 μL 试剂C来回晃动混匀后4 ℃、2 500 r/min离心10 min。将上清液转移至新离心管中于4 ℃、10 000 r/min离心15 min后分离并保存上清液(细胞质部分),用500 μL 试剂C洗涤沉淀(线粒体部分)后10 000 r/min离心5 min移除上清液。分离后样品加入2×十二烷基硫酸钠(twelve alkyl sodium sulfate,SDS)上样缓冲液并进行免疫印迹法处理。
1.2.5免疫组织化学法
对组织切片进行预处理,以3%过氧化氢去离子水孵育10 min,用磷酸盐缓冲溶液(phosphate buffered solution,PBS)冲洗;滴加一抗,室温孵育1 h,PBS浸泡冲洗3 min,重复5次;滴加enhancer增强剂,37 ℃处理30 min后PBS浸泡冲洗3 min,重复5次;滴加通用型免疫球蛋白G抗体,室温孵育1 h,PBS冲洗3 min,重复5次;使用二氨基联苯胺溶液显色;蒸馏水冲洗、复染、脱水、透明后封片,拍照。
1.2.6免疫印迹法
(1)细胞蛋白制备,收集细胞后以PBS洗涤1次,加入RIPA裂解液50 μL 后置于冰上30 min,并且每10分钟振荡破碎1次。4 ℃、13 200 r/min离心15 min后吸取上清液,转入灭菌离心管,测定蛋白浓度并标记,计算上样量与上样浓度后用PBS将样品稀释至统一浓度并置于-80 ℃保存待用。(2)SDS-聚丙稀酰胺(polyacrylamide,PAGE)电泳,解冻样品后按已计算出的各样品1/2体积加入2×SDS上样缓冲液,充分混匀,在金属加热混样器上将蛋白样品进行99 ℃加热处理10 min。按测定的蛋白相对分子质量大小制备10%的SDS-PAGE胶,冲洗上样孔2次后上样,80 V恒压电泳,待样品中溴酚蓝条带迁移到凝胶底部时,终止电泳。(3)电泳转移蛋白质,预先制备电泳转移缓冲液,将其放置于4 ℃预冷,将已完成电泳后的蛋白胶根据Marker指示按需要切取适当大小贴于硝酸纤维素膜(nitrocellulose filter membrane,NC)上,以三明治法两面覆盖3层滤纸、赶尽气泡后使用半干转仪(Bio-Rad)进行半干印迹转移。(4)抗原抗体反应,将NC膜浸泡于封闭液[含5%脱脂奶粉的磷酸盐吐温缓冲液(Phosphate Buffered Saline,PBST)液]中,于垂直摇床上室温封闭1 h后用PBST洗涤5 min,将待检测蛋白的一抗以1∶1 000比例稀释于封闭液中并覆盖在NC膜上,摇床4 ℃过夜孵育。将已完成一抗孵育处理的NC膜用PBST在水平摇床上洗涤3次,每次10 min。将相应二抗以1∶3 000(鼠抗)或1∶5 000(兔抗)比例稀释于封闭液中,覆盖在NC膜上并置于垂直摇床上室温孵育1 h后洗膜3次,进行蛋白显影检测。
1.2.7流式细胞术
收集细胞后用PBS洗涤1次,加入1×Annexin V结合缓冲液后于常温以4 200 r/min离心3 min并吸走上清液,向底部细胞加入1×Annexin V结合缓冲液重悬浮并将浓度调至1×106/mL。取1 mL样品加入5 μL APC-Annexin V和1 μL SYTOX®Green染色剂,于37 ℃处理15 min,并采用流式细胞仪进行测定。
2 结 果
2.1 TNK1在人肝细胞癌组织和细胞中的表达均明显下降
3例患者肝细胞癌组织免疫组织化学法检测显示,苏木精-伊红染色标记的细胞核呈蓝色,细胞外基质呈粉色,显示了组织切片中细胞的分布趋势;磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC-3) 抗体染色标记的肝细胞癌细胞呈黄褐色,从而区分了组织切片中的癌组织和正常组织;TNK1抗体染色标记的TNK1蛋白呈浅红色,癌组织区域中TNK1表达明显低于周边正常组织,见图1A。免疫印迹法检测结果也同样证实,TNK1在人肝细胞癌细胞系Huh7、Huh7.5、HepG2中的表达程度均明显低于人肝细胞系IHH对照组,见图1B。
2.2 多西环素诱导IHH rtTA-TNK1细胞模型中的细胞凋亡和TNK1表达升高
IHH rtTA-TNK1细胞以0、25、50、100 ng/mL多西环素处理48 h后行流式细胞测试显示,细胞凋亡现象(Annexin-V信号阳性)的细胞比例分别为6.4%、24.2%、52.7%、74.7%,见图2。IHH rtTA-TNK1细胞由100 ng/mL多西环素处理24 h后经细胞裂解处理并进行免疫印迹法检测TNK1和细胞凋亡相关蛋白(c-PARP、caspase-3、c-caspase-3、caspase-9、c-caspase-9)表达水平;IHH细胞由100 μmol/L依托泊苷予以相同处理作为阳性对照。结果显示,在IHH rtTA-TNK1细胞模型中多西环素能诱导TNK1表达升高;同时,多西环素诱导还引起了细胞凋亡相关c-PARP、c-caspase-3、c-caspase-9蛋白表达水平提高,见图3。
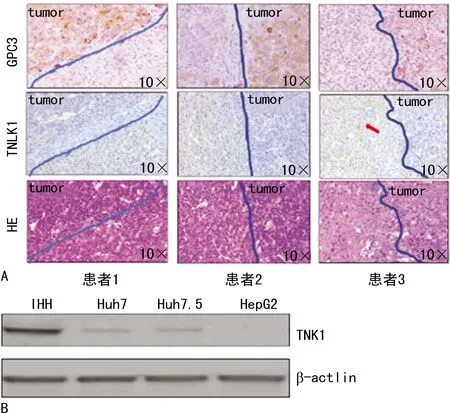
A:人肝细胞癌组织免疫组织化学法检测;B:免疫印迹法检测IHH、Huh7、Huh7.5、HepG2细胞系中TNK1和β-actin表达水平。
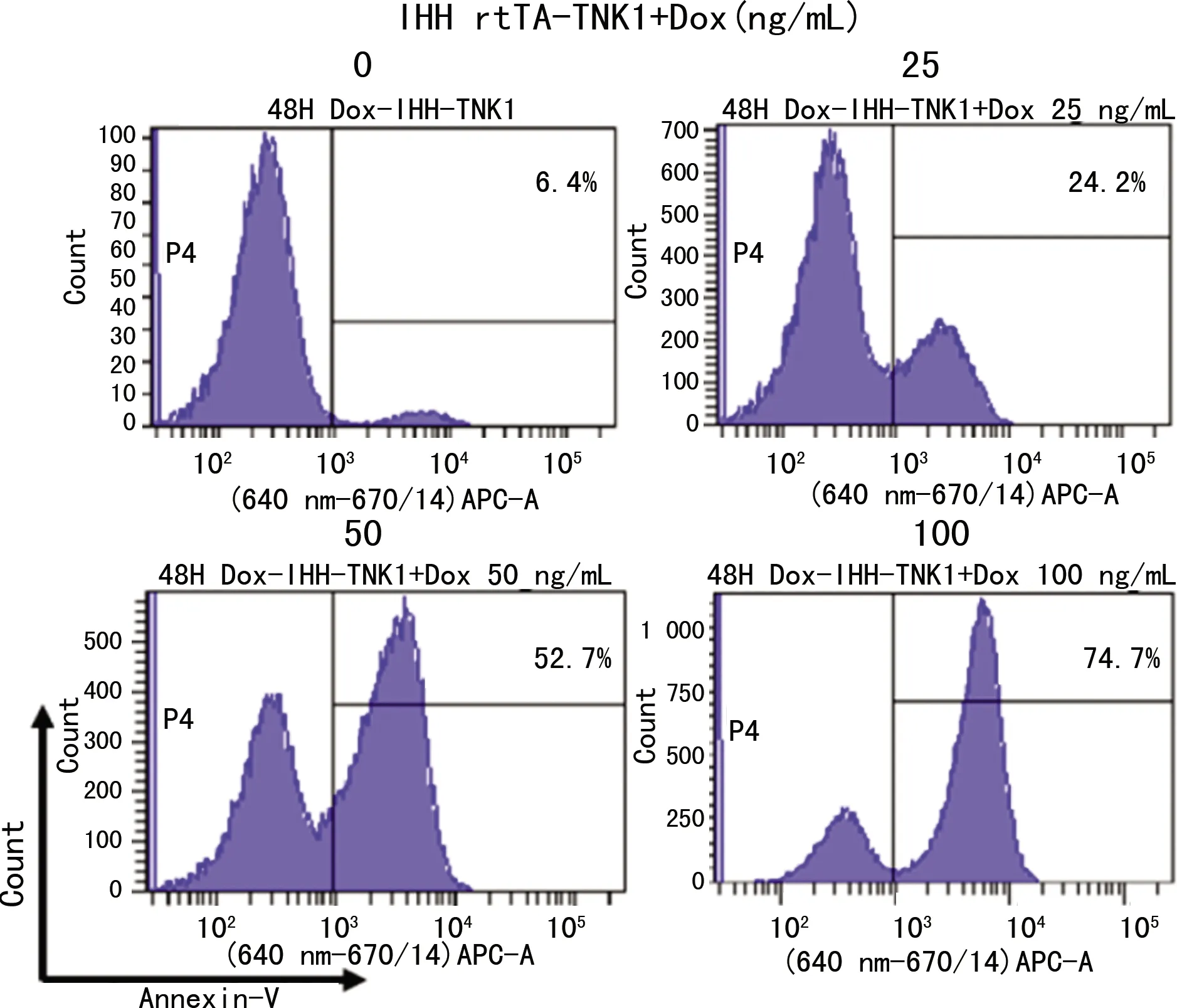
图2 多西环素诱导IHH rtTA-TNK1细胞产生细胞凋亡现象
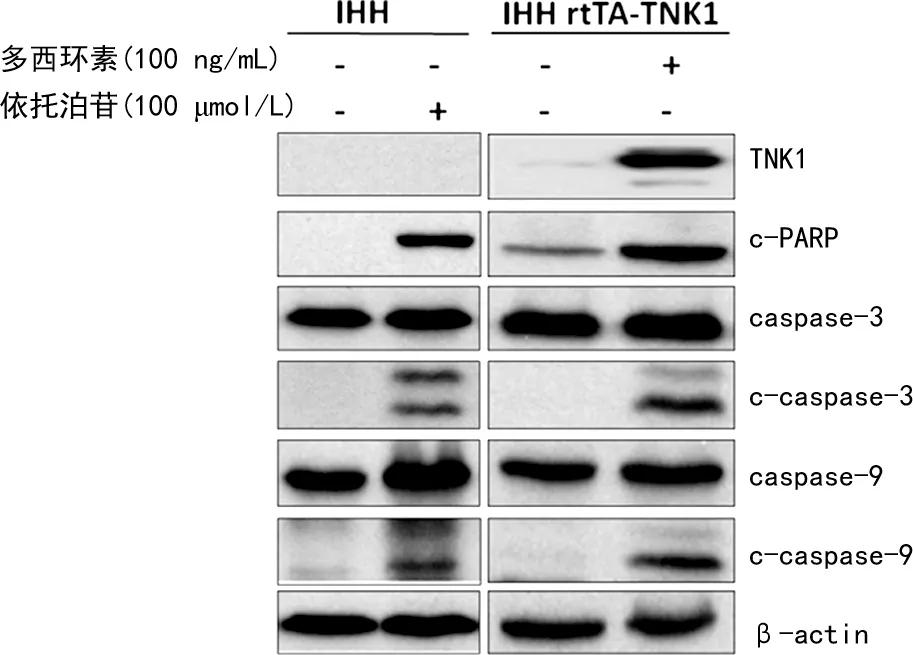
图3 在IHH rtTA-TNK1细胞中多西环素激活生产的TNK1诱导细胞凋亡相关蛋白
2.3 IHH rtTA-TNK1细胞模型中多西环素诱导表达的TNK1导致Cytochrome C转移
IHH rtTA-TNK1细胞被多西环素处理后分别通过全细胞溶解和线粒体分离处理,免疫印迹法检测显示,在全细胞溶解标本中多西环素促进TNK1表达而不影响微管蛋白和Cytochrome C的表达。经线粒体分离处理后微管蛋白集中在细胞质部分而多西环素处理不影响微管蛋白的分布;多西环素使TNK1大量出现于线粒体部分,少量出现于细胞质部分;未经多西环素处理时Cytochrome C集中在线粒体部分,而多西环素处理使线粒体和细胞质中均检测到Cytochrome C,见图4。在IHH rtTA-TNK1细胞模型中多西环素处理诱导TNK1表达,并使部分Cytochrome C从线粒体转移至细胞质中。
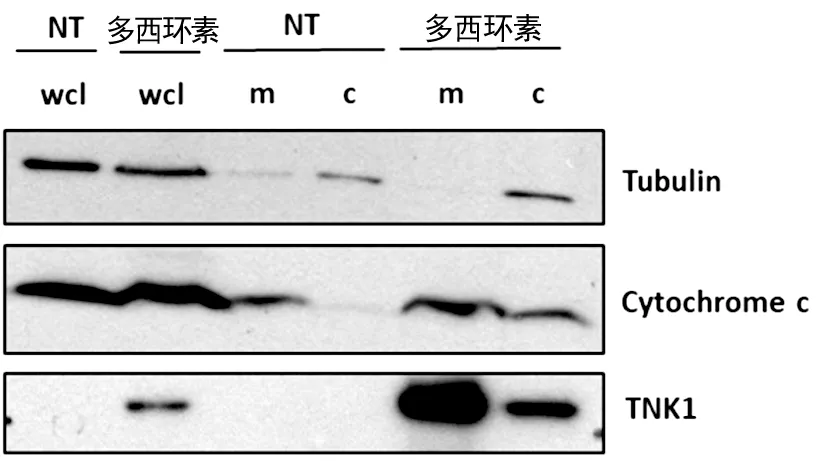
wcl:全细胞裂解产物;m:线粒体分离产物;c:细胞质分离产物。
2.4 IHH rtTA-TNK1细胞模型中多西环素诱导表达的TNK1能介导Bcl-2家族蛋白水平变化
IHH rtTA-TNK1细胞由100 ng/mL多西环素处理0、24、48 h后经细胞裂解处理并用免疫印迹法检测Bcl-2家族蛋白(Bax、Bak、Bcl-2、Bcl-xL、Mcl-1)表达水平;IHH细胞由100 μmol/L依托泊苷予以相同处理作为阳性对照。结果显示,在IHH rtTA-TNK1细胞模型中多西环素诱导的TNK1在促进Bak蛋白表达的同时降低了Bcl-xL和Mcl-1蛋白水平,而对Bax和Bcl-2的蛋白表达水平无显著影响,见图5。
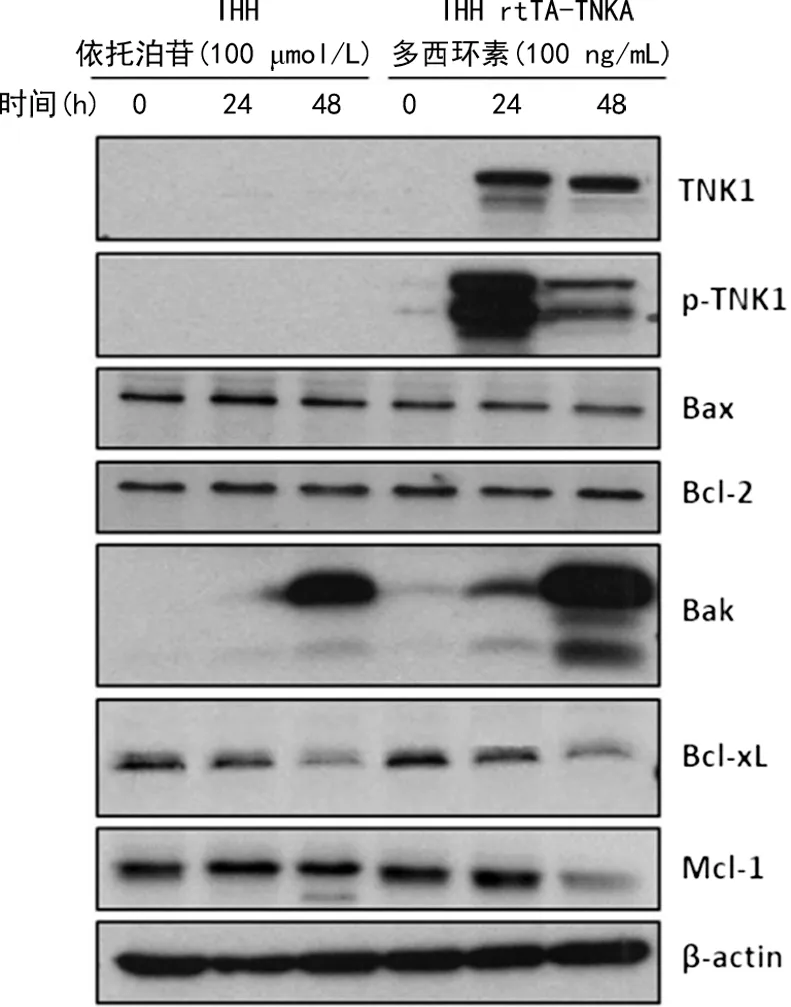
图5 在IHH rtTA-TNK1细胞中多西环素激活生产的TNK1调节Bcl-2家族蛋白表达
3 讨 论
TNK1是被发现的首个具有抑癌作用的酪氨酸激酶,通过同源重组生产的TNK1+/-和TNK1-/-小鼠均会自发地形成肿瘤,另外在患有弥漫性大B细胞淋巴瘤的小鼠中TNK1表达水平显著下降[4]。然而,TNK1也可帮助肿瘤形成。LIERMAN等[6]使用逆转录病毒插入突变扫描鉴定TNK1为致癌基因。另外也有研究证明,TNK1对霍奇金淋巴瘤细胞和胰腺癌细胞的生存和生长至关重要[7-8]。因此,确认TNK1在人肝细胞癌细胞中具有抑癌或致癌作用是必要的。本研究免疫组织化学法和免疫印迹法检测均证明了TNK1在人肝细胞癌细胞和组织中的表达水平明显低于正常细胞组织(图1),证实TNK1在人肝组织中应扮演着抑癌角色,另外TNK1也据此可能作为未来诊断早期人肝细胞癌的重要生物标志物。
多西环素属常见四环素类抗菌药物,具有抗感染、抗肿瘤等作用,其机制主要为抑制磷酸化哺乳动物雷帕霉素(phosphorylated mammalian target of rapamycin,P-mTOR)水平[9]。本研究构建了IHH rtTA-TNK1细胞系,多西环素可激活其tet-on基因表达系统,从而使细胞表达TNK1。依托泊苷可与DNA拓扑异构酶Ⅱ结合,使DNA复制过程中产生的瞬间链的断裂难以修复,导致细胞产生依托泊苷剂量依赖性DNA损伤,促进细胞凋亡[10]。因此,本研究将依托泊苷作为诱导剂,促使细胞发生凋亡现象,从而作为阳性对照。本研究流式细胞法和免疫印迹法检测均证明,在人肝细胞中TNK1过表达能使Annexin V信号呈阳性并诱导产生c-caspase-3和c-PARP,因此,TNK1可激活人肝细胞的凋亡程序(图2、3),鉴于细胞凋亡是抑制肿瘤产生和治疗癌症的重要机制之一,结合免疫组织化学法检测结果,作者认为TNK1在人肝组织中具有抑癌作用的结论成立,未来可通过过表达TNK1激活细胞凋亡程序抑制肝癌细胞增殖。但本研究发现,未经含IHH基因的逆转录病毒感染的正常IHH肝细胞TNK1表达无法通过蛋白印迹法被检测出来(图3),同样未经逆转录病毒感染的正常肝细胞TNK1表达也未能顺利被检出来(图5),作者认为这是由于激活TNK1后IHH细胞出现凋亡,导致收样细胞的总量大幅下降、样品蛋白浓度较低,为保持上样量的统一,图3、5的对照组上样蛋白总量相对图1组织蛋白总量较低所致。
内源性通路和外源性通路是激活细胞凋亡的主要机制[3,11],其中内源性通路的核心机制是由Bcl-2家族蛋白调节的线粒体外膜通透性提高导致线粒体中促凋亡酶被释放进细胞质,最终激活caspase-9并形成c-caspase-9[3,12-13]。本研究为确认TNK1是否通过内源性通路激活细胞凋亡,检测了TNK1对内源性通路内重要蛋白的影响:(1)TNK1表达激活并切割了caspase-9从而产生了内源性通路的重要终产物——c-caspase-9(图3);(2)TNK1促使线粒体中Cytochrome C被释放到细胞质中(图4);(3)TNK1上调了Bak并下调了Bcl-xL和Mcl-1蛋白水平,而不影响Bax和Bcl-2的表达(图5)。在Bcl-2家族蛋白中促凋亡的Bax和Bak与抗凋亡的Bcl-2、Bcl-xL和Mcl-1相互平衡,进而调节线粒体外膜通透性[14]。
综上所述,在人肝细胞中TNK1通过调节Bcl-2家族蛋白中Bak、Bcl-xL和Mcl-1的平衡,提高了线粒体外膜通透性,进而使Cytochrome C转移至细胞质并激活caspase-9,最终导致细胞凋亡。2015年常虹等[15]研究表明,三氧化二砷联合丹参酮胶囊能通过明显抑制细胞增殖、提高凋亡率、显著下调抗凋亡蛋白Bcl-2等表达、上调c-caspase-9等促凋亡蛋白表达等机制影响肝癌细胞的增殖和凋亡,TNK1在人肝细胞中通过内源性通路激活细胞凋亡上述机制研究也或可为新型抗肝癌药物的开发提供一种新思路。
