经股静脉血液透析导管纤维鞘剥除术治疗带隧道带涤纶套透析导管功能不全3例并文献复习
2021-11-20刘占鳌周大勇霍桂军曹俊杰沈利明
刘占鳌 周大勇 黄 剑 霍桂军 曹俊杰 沈利明 汤 尧
南京医科大学姑苏学院/南京医科大学附属苏州医院/苏州市立医院(本部)血管外科,江苏 苏州 215002
目前,随着透析技术的提高,维持性血液透析患者的透析间时在不断延长,难免会导致血液透析通路失去功能。虽然动静脉内瘘因具有诸多优点而成为血液透析首选的通路,但对于一些等待内瘘成熟、血管条件不佳而无法建立内瘘的患者而言,颈内静脉带隧道带涤纶套透析导管(tunneled cuffed catheter,TCC)又称长期血液透析导管,仍是重要的血管通路[1-2]。研究已证实,所有类别的中心静脉通路装置均有纤维鞘形成,纤维鞘可以直接导致血液透析导管功能不全,同时也是中心静脉狭窄的一个重要危险因素,故引起肾内科、血管外科医师的广泛关注[3-5]。对于纤维鞘所致的血液透析导管功能不全,目前报道的处理方法主要包括经导管溶栓药物灌注、原位导管更换、异位穿刺导管更换、球囊破坏纤维鞘等[6-8]。以上方法均各具有优缺点。南京医科大学姑苏学院/南京医科大学附属苏州医院/苏州市立医院(本部)收治了3例行维持性血液透析出现血液透析导管功能不全后行经股静脉血液透析导管纤维鞘剥除术的患者,本文对其病历资料进行回顾性分析,并结合相关文献对患者的临床特征和治疗情况进行探讨,分析经股静脉血液透析导管纤维鞘剥除术治疗TCC功能不全的疗效和安全性。
1 病历资料
1.1 病例1
患者女性,85岁,因“血液透析导管流量不佳1个月,无法维持血液透析1 d”就诊,患者有尿毒症病史1年余,使用顶端阶梯一体式右颈内静脉TCC行维持性血液透析1年,否认高血压、糖尿病、冠心病等病史。1个月前血液透析导管均可满足220~250 ml/min的血流量,近1个月出现流量不佳,经血液透析导管透析时泵控血流量低于200 ml/min,于当地医院血透室曾因导管流量不佳行3次经血液透析导管尿激酶灌注溶栓治疗(10万单位尿激酶溶于10 ml生理盐水,其浓度为10 000 U/ml,使用微量泵连接功能不良的导管端,以2 ml/h的速度缓慢匀速泵入溶栓液,结束后肝素加尿激酶封管,连用3 d),溶栓后血液透析导管血流量改善但短期内复发。查体:血压139/90 mmHg(1 mmHg=0.133 kPa),心率76次/分钟,心律齐。右胸壁可见血液透析导管在位良好,皮肤未见红肿、渗出,右上肢无肿胀,胸壁未见静脉曲张。患者近期心脏超声检查无肺动脉高压、右向左分流。入院血常规、凝血功能、肝功能、电解质等未见明显异常。患者及家属拒绝行上肢动静脉瘘造瘘术,告知可行原位血液透析导管更换术,或保留该血液透析导管,行经股静脉血液透析导管纤维鞘剥除术,患者及家属选择行经股静脉血液透析导管纤维鞘剥除术。
治疗过程:先经血液透析导管动脉端行造影明确纤维鞘形成,并排除上腔静脉血栓、闭塞。右股静脉穿刺置入8 F鞘管,将260 cm超滑导丝从血液透析导管动脉端送至下腔静脉,通过圈套器圈套导丝并自股静脉鞘管引出体外,建立牵张操作轨道。圈套器自鞘管外套住牵张导丝后送入鞘管至上腔静脉,从而圈套器直接上行,便将血液透析导管顺利圈套。收紧圈套器后用力下拉,手术方法见图1。若纤维鞘可以完整撕脱呈环状,撕脱后仍包裹于牵张导丝周围,可以将其拉入股静脉鞘管内,并保留牵张导丝,将鞘管同圈套器一同拔除,冲洗鞘管,将纤维鞘冲出,再组装鞘管,经牵张导丝送入体内,重复剥除纤维鞘至拔除牵张导丝后血液透析导管双腔均抽回血通畅。术中、术后患者无胸闷不适或脉氧下降的情况发生,行血液透析时,流量维持在220 ml/min以上,透析过程顺利。术后随访6个月,血液透析导管仍功能良好。
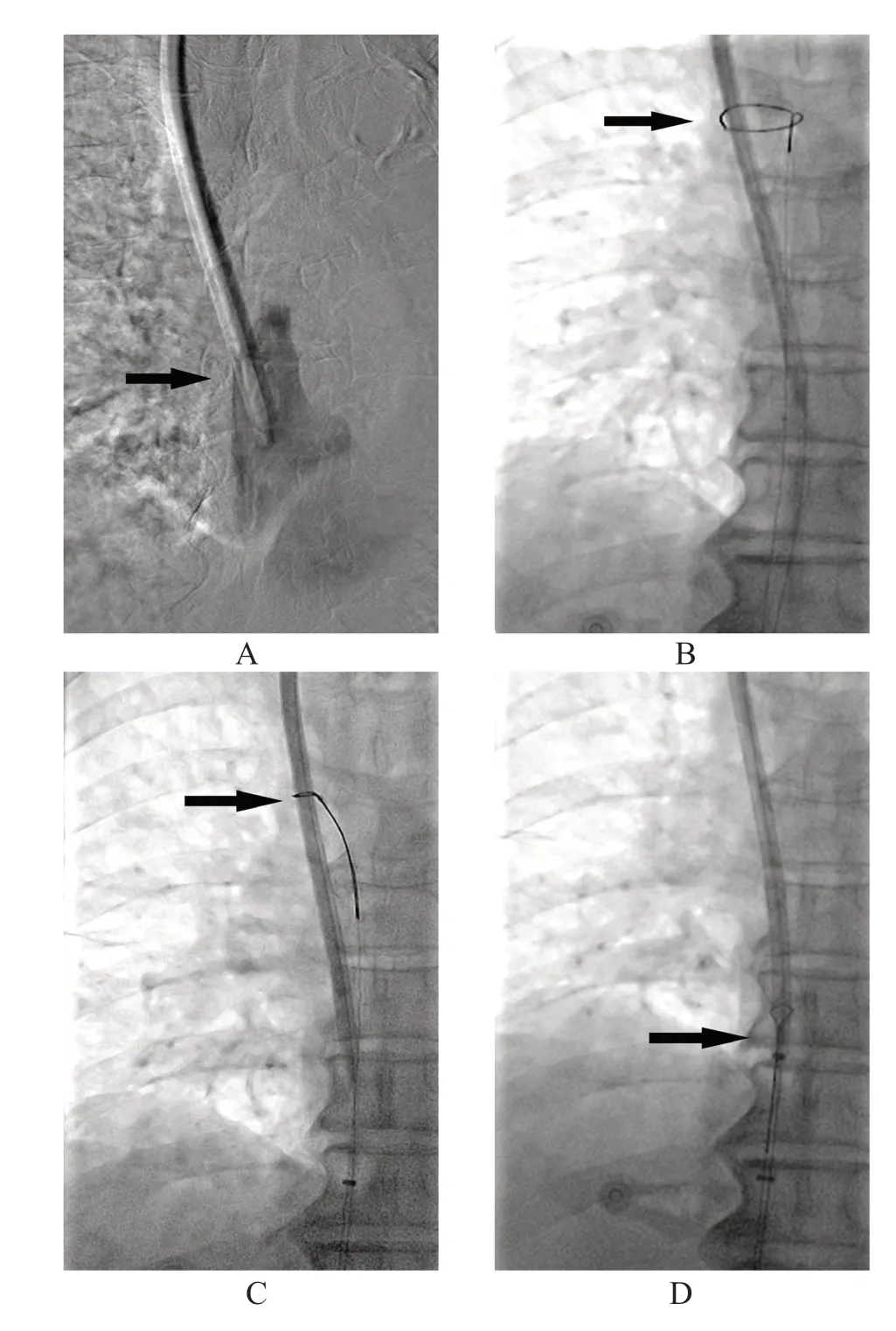
图1 术中造影及操作
1.2 病例2
患者女性,76岁,因“血液透析导管流量不佳2个月,加重4 d”就诊,患者尿毒症病史5年余,使用顶端阶梯一体式右颈内静脉TCC行维持性血液透析5年余,高血压病史十余年,血压经口服降压药物控制良好,否认糖尿病、冠心病等病史。近5年来,该血液透析导管均可满足220~250 ml/min的血流量;近2个月出现血液透析导管动脉端引血不畅,于当地医院血透室曾行2次经导管尿激酶灌注溶栓治疗(方法同上),溶栓后导管抽回血改善,但短期内复发,近4 d透析时流量小于180 ml/min。查体:血压127/71 mmHg,心率87次/分钟,心律齐。右胸壁可见血液透析导管在位良好,皮肤未见红肿、渗出,右上肢无肿胀,胸壁未见静脉曲张。心脏超声检查结果显示无肺动脉高压、右向左分流。入院行血常规、凝血功能、肝功能、电解质等检查,未见明显异常。告知可行原位血液透析导管更换术,或保留该血液透析导管行经股静脉血液透析导管纤维鞘剥除术,患者及家属选择纤维鞘剥除术。手术方法同上,剥除效果满意,抽回血通畅,术中、术后患者无胸闷不适或脉氧下降的情况发生,术后血液透析时流量维持在220 ml/min以上,血液透析过程顺利。术后,随访3个月,血液透析导管仍功能良好,之后患者因血液透析导管流量不佳原位更换导管。
1.3 病例3
患者男性,70岁,因“血液透析导管流量不佳2个月,无法维持血液透析1 d”就诊。患者尿毒症病史3年余,使用顶端分裂式右颈内静脉TCC行维持性血液透析3年余,高血压病史十余年,血压经口服降压药物控制良好,否认糖尿病、冠心病等病史。近3年来,该血液透析导管均可满足220 ml/min的血流量;近2个月出现血液透析导管动脉端血流量不佳,导致血液透析不充分,于当地医院血透室曾行2次经导管尿激酶灌注溶栓治疗,溶栓后,导管抽回血有所改善,但短期内复发。入院行血常规、凝血功能、肝功能、电解质等检查,未见明显异常。查体:血压141/69 mmHg,心率70次/分钟,心律齐。右胸壁可见血液透析导管在位良好,皮肤未见红肿、渗出,右上肢无肿胀,胸壁未见静脉曲张。心脏超声检查结果显示无肺动脉高压、右向左分流。入院行血常规、凝血功能、肝功能、电解质等检查,未见明显异常。告知可行原位血液透析导管更换术,或保留该血液透析导管行经股静脉血液透析导管纤维鞘剥除术,患者及家属选择后者。手术方法同上,剥除效果满意,抽回血通畅,术中、术后患者无胸闷不适和脉氧下降发生,术后血液透析时流量维持在220 ml/min以上,血液透析过程顺利。术后随访6个月时,血液透析导管仍功能良好。
2 讨论
对于使用TCC行维持性血液透析的患者,纤维鞘是包裹于血液透析导管表面的膜状物,其由细胞成分和非细胞成分组成,是机体对于异物的一种保护性反应,是机体自身修复的产物。TCC起始于血液透析导管入血管接触静脉壁处,在导管入静脉壁处逐渐包裹整个导管,血液透析导管被拔除后,纤维鞘仍然存在,并不会随着导管的拔除而被移除[9-11]。纤维鞘可导致血液透析导管功能不全、血栓形成、感染,甚至中心静脉狭窄、闭塞,目前仍是临床上的一个棘手问题[12]。
目前,对于纤维鞘的诊断尚无金标准,通常通过一些经验性分析结合影像学检查进行诊断。临床上,若血液透析导管突然出现流量不佳、透析静脉压升高、引血困难但回推无明显阻力,均提示纤维鞘形成。目前,经血液透析导管静脉造影尤其是将导管适当回撤后,造影见原导管所在位置留有与导管形状一样的管状鞘样影像,是普遍认同并较准确的诊断方法[3,13]。
对于部分纤维鞘机械活瓣形成、经导管溶栓药物灌注治疗效果不佳及无更换导管条件的患者,在排除上腔静脉血栓、闭塞、负荷量较大的纤维鞘,以及肺动脉高压、右向左分流后,经股静脉血液透析导管纤维鞘剥除术是一种可供选择的微创治疗方案。本研究的3例患者经初步诊断为纤维鞘所致的血液透析导管功能不全,考虑到原位更换血液透析导管亦存在纤维鞘继续包裹血液透析导管的情况,没有理想的异位深静脉穿刺点用来重置血液透析导管,可以尝试先保留长期血液透析导管,行经股静脉血液透析导管纤维鞘剥除术,以期不更换长期血液透析导管并达到较好的治疗效果。
经股静脉血液透析导管纤维鞘剥除术在国内鲜有相关研究报道,但是,国外学者曾使用该手术方式对血液透析导管失功能的患者进行治疗,并获得不劣于原位更换血液透析导管的治疗效果[14-15]。Brady 等[14]对131例患者实施了经股静脉血液透析导管纤维鞘剥除术,即刻技术成功率为95.6%,经过纤维鞘剥除后,其平均一期通畅时间为89 d;所有患者均未出现肺栓塞。本研究的3例患者也达到了预期的治疗效果,是因为该治疗方法具有不需要更换血液透析导管、创伤较小、可以反复多次进行的优势,但是,理论上,该方法的肺栓塞发生风险是客观存在的。本研究的3例患者亦未出现肺栓塞,在行纤维鞘剥除时,先经血液透析导管送入一根260 cm超滑导丝,从股静脉鞘管引出体外,建立操作轨道,既方便于上腔静脉圈套血液透析导管,又使剥除的部分环形纤维鞘可以顺着牵张导丝进入股静脉鞘管并冲出体外,从而可以减少肺栓塞的发生;有2例患者术中见到鞘管内冲出少量纤维鞘组织,肺栓塞的发生风险降低。
针对纤维鞘所致血液透析导管功能不全的其他治疗方法亦存在其各自的局限性。目前,主要解决方法包括经导管溶栓药物灌注溶栓、原位更换导管、异位穿刺置管、原位置管同时球囊破坏纤维鞘的血管成形术等[6]。经导管溶栓药物灌注溶栓疗法对于一些纤维鞘形成合并血栓形成的患者较为有效,纤维鞘仅在早期含有纤维蛋白成分,成熟后则不含该成分。含纤维蛋白的血栓可以被溶栓药物溶解,而成熟的纤维鞘则是致密纤维结缔组织,不能被溶解[9]。导管更换时,无法避免重新送入的血液透析导管仍然被置于纤维鞘的包裹之中,血液透析导管的头端会再度被纤维鞘覆盖,从而可能再次出现功能不全。
詹申等[16]报道了使用10~12 mm高压球囊于导管退出后将纤维鞘扩张,纤维鞘被撑破后,再循导丝送入新的血液透析导管,通过球囊扩张破坏纤维鞘从而提高血液透析导管的通畅率。然而,经过球囊扩张后,纤维鞘的组织仍然漂浮于中心静脉中,可能会引起血栓形成、远期中心静脉狭窄等[17-18]。避开原置管位置重新穿刺置管是一个可行的方法,但是,血液透析患者因长期置管、静脉条件不佳、可供置血液透析导管的理想穿刺位点有限而限制了该方法的使用。以上方法均需要更换新的血液透析导管,相对而言,经股静脉血液透析导管纤维鞘剥除术是一种可以保留血液透析导管的治疗方法,创伤更小,患者的认可度更高。
经股静脉血液透析导管纤维鞘剥除术治疗血液透析导管功能不全,其不需要更换血液透析导管,创伤小,可以反复进行。理论上,经股静脉血液透析导管纤维鞘剥除术治疗存在肺栓塞的发生风险,但是,本病例所探讨的技术细节可以降低肺栓塞的发生率,对于原位换管预期效果不佳、无法原位换管、纤维鞘活瓣形成的患者,经股静脉血液透析导管纤维鞘剥除术不失为一种解决纤维鞘所致血液透析导管功能不全的有效方法[7,9]。对于经股静脉血液透析导管纤维鞘剥除术,单次手术过程中的剥除次数与通畅性的关系,以及对于肺栓塞发生情况的详细影像学评估情况,仍需进一步研究。经股静脉血液透析导管纤维鞘剥除术对于原位换管预期效果不佳、无法原位换管、纤维鞘活瓣形成等情况的患者安全、有效,并且可以反复进行,有利于改善血液透析导管功能不全。
