系统性红斑狼疮相关肠道损伤的研究进展
2021-11-19谢敏珠靳政玺综述胡伟新审校
谢敏珠 靳政玺 综述 胡伟新 审校
系统性红斑狼疮(SLE)是多器官受累的自身免疫病,皮肤、关节、肾脏、血液和神经系统受累发生率高,有较高临床认知度,但SLE导致的消化道受累认识不足。SLE患者出现消化道症状临床更多考虑其他原因所致(表1),如感染、药物等原因,导致误诊。如不及时作出正确判断和处理,不仅症状难以控制,而且会带来一系列合并症。大量研究表明SLE的胃肠道受累并不罕见,因症状不明显或无症状而发生率在临床上可能被低估。50%以上的SLE患者病程中出现消化道症状,其中10%以消化道症状首发[1]。尸检研究发现[2],60%~70%的SLE患者有腹膜炎证据,而生前仅约10%被临床诊断。

表1 系统性红斑狼疮患者消化道症状病因
SLE可侵犯从口腔到直肠的消化道任何部位,以小肠多见[3],病情也较严重,治疗延误可能会危及生命。SLE常见的肠道损伤类型有狼疮性肠炎(LE)、假性肠梗阻(IPO)和蛋白丢失性肠病(PLE),以LE最多见。本文重点阐述LE、SLE相关IPO和SLE相关PLE的临床表现(表2)、诊断及治疗,以期提高临床早期诊断和治疗效果,改善患者预后。
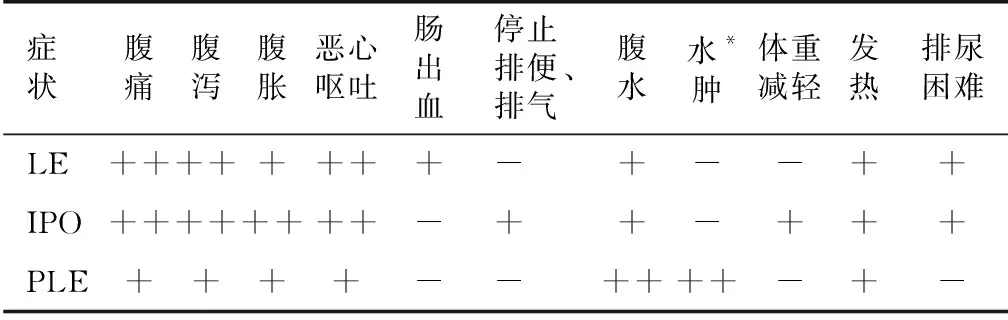
表2 系统性红斑狼疮常见肠道损伤类型及其临床表现
狼疮性肠炎(LE)
临床表现LE以往有多种名称[3],BILAG 2004中定义为“狼疮血管炎”或“狼疮小肠炎症”。LE是引起SLE患者腹痛最常见的原因,患病率为0.2%~9.7%,在急性腹痛的SLE患者中达29%~65%[4],易被误诊为“急腹症”而行不必要的手术,死亡率高达53%[5]。在我们中心3 430例狼疮肾炎(LN)队列中LE发生率为2.6%[6],与既往研究一致。目前已知多种因素可诱发LE,如细菌感染、巨细胞病毒、药物反应、嗜酸性粒细胞增多、某些食物(包括生冷食物、不洁饮食)等[7]。
LE早期无特异性,可以为SLE首发症状,大多数表现为弥漫性或持续性腹痛(70%~100%),或不同程度的恶心呕吐(60%~80%)、腹泻(30%~60%)[8],常伴腹胀和腹部压痛,肠鸣音亢进或缓慢。并发腹膜炎或穿孔可出现反跳痛,肠出血较罕见。腹泻多表现为水样便或稀便,严重者每天十余次甚至数十次,无黏液脓血便,无里急后重,有别于溃疡性结肠炎。少数病程中无腹痛,仅表现为慢性腹泻或顽固性呕吐[9]。
LE常与活动性SLE相关,可见肾脏(69.1%)、心脏(40.0%)、中枢神经(10.3%)等受累,SLE-DAI评分高(15.10±6.84)[4]。但也有仅活动性LE的报道(SLE-DAI<4分)[10]。此外LE常常合并LN,占65.0%~69.1%[4,11],表明活动性LN患者可能更易发生LE。
影像学特征腹部X线平片无特异性。多种原因(如缺血、脓毒症、尿毒症或电解质紊乱)可引起腹腔内游离气体、肠积气或肠梗阻。腹部超声可见水肿增厚的肠壁,用于LE诊断和随访。
腹部CT是目前LE的最佳诊断工具,还可识别其他病变,如腹腔内脓肿、胰腺假性囊肿等。肠壁水肿增厚(>3 mm)、肠壁异常强化(靶征)和肠袢扩张、肠系膜血管充盈(梳齿状征)及腹水是LE典型CT表现[12](图1)。然而胰腺炎、腹膜炎、肠梗阻及炎症性肠病(IBD)也可出现上述现象[7]。CT还可区分LE和血栓栓塞性疾病,后者的肠壁增厚常局限于血管区域。
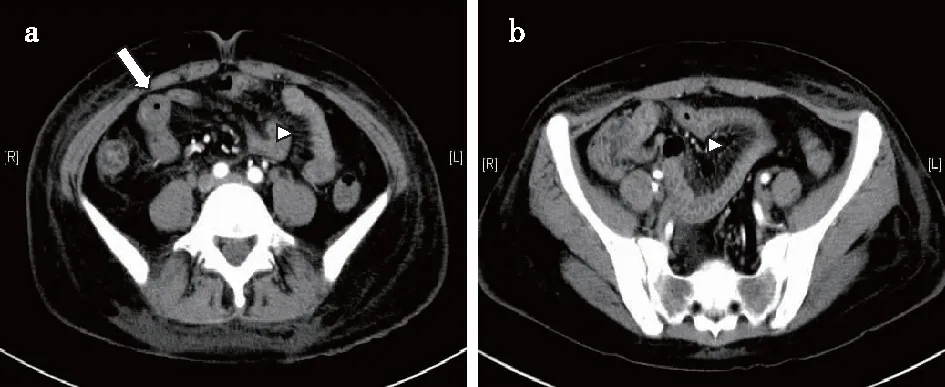
图1 狼疮性肠炎患者腹部增强CT影像学改变22岁女性患者,以呕吐、腹泻为首发症状。腹部CT显示肠壁增厚、水肿、靶征(↑),肠系膜血管增强明显呈“梳齿状征”(△)
磁共振成像(MRE)是诊断小肠疾病的一种敏感方法,能提供肠腔内外及肠壁信息,主要用于IBD严重程度的评估[13]。Cicero等[14]发现局灶或弥漫性肠壁增厚、黏膜下层水肿或出血,T2加权像的“拇指印征”等(图2)均提示与LE相关,无辐射的MRE有望成为替代腹部CT的一项安全可靠检查。
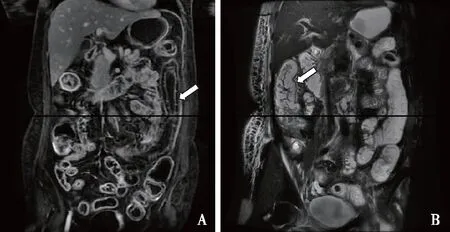
图2 狼疮性肠炎肠道磁共振成像改变56岁女性患者,表现为反复腹痛腹泻。LAVA增强系列(A)及T2压脂系列(B)示多发肠管壁增厚、黏膜下水肿(↑),以结肠为著
病理机制LE典型病变在小肠黏膜下层的小血管,病理示纤维素样坏死和炎细胞浸润,可见免疫复合物、补体C3和纤维蛋白原沉积。继发于免疫复合物沉积的血管炎和继发于循环抗磷脂抗体的肠血管血栓形成是LE可能致病机制[7]。两者相互激活导致凝血系统活化和微血栓形成,从而引起胃肠道症状。狼疮活动时过度补体激活并伴内皮细胞活化,诱导中性粒细胞-内皮细胞黏附,可致斑块阻塞性血管病变[1]。Kwok等[15]认为血清中高水平IgG型抗内皮细胞抗体可能也参与了LE免疫发病。
诊断及鉴别诊断LE是排他性诊断,需结合临床表现及辅助检查结果。LE常发生于SLE活动时,白细胞减少、贫血、血小板减少和补体减低等实验室指标、特征影像表现及其他脏器受累有助于鉴别。此外LE腹痛位置多不局限,区别于急性胃肠炎、消化性溃疡、急性胰腺炎部位的局限或固定。内镜检查可排除IBD、溃疡及肿瘤。
治疗LE对皮质类固醇反应好,轻者可口服[泼尼松0.5~1 mg/(kg·d)],重者需大剂量静脉注射(甲泼尼龙0.25~1 g/d,3~5d)。多数患者经静脉甲泼尼龙40 mg/d~1 mg/kg/d,平均4d(1~34d)后临床症状改善;严重器官受累(如LN)可加用环磷酰胺(CYC)0.5~0.75 g/m2[8,16]。延长激素治疗时间或联合免疫抑制剂治疗[吗替麦考酚酯(MMF)750~1 000 mg/d、硫唑嘌呤(AZA)100 mg/d及利妥昔单抗]可有效预防LE复发[8]。并且大剂量CYC[>1.0 g/(m2·月)]被证实是复发的保护因素[4]。对高剂量激素联合CYC冲击反应差的复发LE,他克莫司(FK506)0.05~0.1 mg/(kg·d)治疗有效[17]。此外血清总补体活性(CH50)可作为难治或复发LE的预测因子,低水平预示着治疗反应不佳[18]。
LE的患者应给予肠道休息和静脉输液,排除其他疾病后进行免疫抑制治疗。方案应基于个体的收益-风险比,考虑其他脏器受累及潜在的妊娠意愿。若病情无改善或怀疑内脏梗阻与穿孔、腹腔出血,应尽快外科手术。
假性肠道梗阻(IPO)
临床表现SLE相关IPO相对罕见,但容易误诊,误诊率高达78%[19]。IPO临床可表现为恶心、呕吐、腹痛、腹泻或便秘等肠梗阻征象,但肠腔无闭塞性病变,病程长的患者体重可明显减轻,可有排尿困难、尿频等膀胱炎表现,少数伴有胆道扩张。SLE导致胃肠道、泌尿道和胆道等空腔脏器同时扩张被称为内脏肌肉运动障碍综合征(VMDS)[20],较为罕见,可能与内脏平滑肌损伤有关。在SLE相关IPO患者中有7.1%可表现为VMDS,在SLE患者中仅占0.1%[19]。另外SLE相关IPO患者抗ds-DNA和红细胞沉降率常升高,抗Ro/SSA也有较高阳性率,但并未发现与IPO相关。
影像学特征腹部平片常存在多个气液平及肠袢扩张(小肠多见)。腹部CT示肠管明显扩张伴积气积液(图3),部分肠壁可增厚,可有轻度腹水,无机械阻塞,常伴肾输尿管积水和膀胱壁增厚。本中心报道30例SLE相关IPO中7例伴有肾输尿管积水[21]。十二指肠测压运动试验表现为食管蠕动差、胃排空延迟及肠运动不足,有助于IPO诊断。结肠镜和双气囊小肠镜[22]提供了其他方法无法到达的部分小肠和大肠的信息,以及进行活检的可能优势。小肠MRI可动态观察消化道的动力功能,为胃肠动力检查带来了新方法。
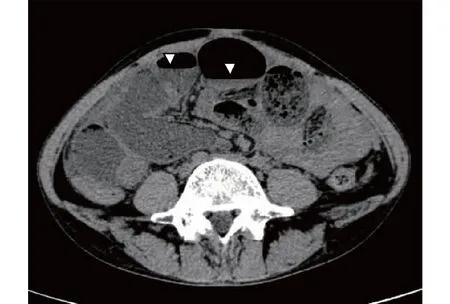
图3 系统性红斑狼疮相关假性肠梗阻腹部CT影像学改变31岁女性患者,表现为腹胀、呕吐。腹部CT显示肠管明显扩张伴积气积液,见气液平(△)
病理机制SLE相关IPO的发病机制尚不清楚。肠道平滑肌运动障碍是否由原发性肌病、神经病变或针对肠壁平滑肌的抗体所致仍待进一步研究,也可能不同致病机制导致相同的临床表现。很多学者认为[23],SLE相关IPO是LE的晚期表现,表现为内脏平滑肌血管炎,造成内脏平滑肌损伤和功能障碍,但肠道组织学上并无血管炎改变。SLE相关IPO的组织学检查[22]显示肠固有层肌细胞广泛坏死伴炎细胞浸润,甚至萎缩,浆膜层见活动性浆膜炎伴增厚、纤维化,肌间神经支配正常,且并未见血管炎的证据。这提示SLE相关IPO的发生可能与血管炎及神经损伤无关,而是存在针对平滑肌及浆膜的自身免疫反应。此外IPO常与肾输尿管积水密切相关,VMDS的发生也提示抗平滑肌相关抗体可能参与了致病过程,造成肠道、泌尿道及胆道三者平滑肌功能障碍[20]。另外有研究认为[24],抗U1-RNP抗体可能也参与了IPO肌动力障碍的病理过程。
诊断及鉴别诊断IPO的诊断基于临床特征和影像学并排除机械梗阻,还应与任何导致运动障碍和胃肠外症状的疾病相区别,尤其是系统性硬化症。对反复出现肠梗阻的年轻女性,特别是合并空腔脏器扩张者,应高度怀疑SLE相关IPO,寻找可能与SLE有关的信息。
治疗SLE相关IPO患者病情重,常伴狼疮活动,住院死亡率达7.1%[19]。目前尚无相关治疗指南,最常用激素冲击(甲泼尼龙500~1 000 mg/d,2~5d)联合免疫抑制剂(CYC最常用)[22]。口服激素联合环孢素A(CsA)、甲氨蝶呤(MTX)、AZA可用于SLE-IPO维持期阶段。对上述治疗反应不佳且累及泌尿道患者,可改用FK506诱导[25]。抗B细胞、抑制免疫复合物形成和自身抗体形成的制剂也可作为替代方案。对伴有感染患者,可静脉注射人免疫球蛋白(IVIG,2~5d内总剂量2 g/kg)[26]。IVIG既能免疫抑制也能免疫调节,为感染者提供良好的安全性。此外SLE相关IPO患者需要肠外营养、补液和止痛、广谱抗生素、胃肠促动力剂以及生长抑素等支持对症治疗。
蛋白丢失性肠病(PLE)
临床表现SLE相关PLE是一种由肠道血清蛋白过度丢失引起的严重低蛋白血症和严重水肿,早期诊断困难,通常会延迟几个月,甚至延迟2年。SLE相关PLE发病率约0.94%~7.5%[27-28],亚洲女性多见,是否由遗传或环境因素造成尚待阐明。临床主要表现为低蛋白血症,腹泻或腹痛等症状不常见,可见高脂血症和低钙血症。一项大型回顾性分析[26]示93.75%SLE相关PLE患者表现为低蛋白血症,其他可见腹泻(39.58%)、腹痛(16.67%)、恶心呕吐(9.90%)及腹胀(5.73%)。红细胞沉降率升高,低补体血症和抗ds-DNA阳性率以及SLE-DAI评分高均提示SLE相关PLE与狼疮活动有关。
影像学特征Tc99m标记的白蛋白显影(Tc99mHSA)可显示PLE的病变部位,渗漏部位以小肠多见(75.90%),其次是结肠(27.71%)、胃(9.64%),12.05%SLE相关PLE患者出现多部位病变[25]。钡餐和腹部CT不能确诊,可显示正常、黏膜水肿、非特异性肠炎或肠壁增厚。
病理机制内镜检查示SLE相关PLE典型病变为小肠黏膜水肿,非特异性炎症或伴溃疡。组织活检可见淋巴管扩张及非特异性炎症,或显示正常[1]。目前认为肠壁微血管/内皮通透性增加[29]是SLE相关PLE的发病机制,可能与补体的活化及细胞因子(如肿瘤坏死因子α和白细胞介素6)的参与,或补体介导的血管或黏膜损伤,或SLE累及肠系膜、肠血管的非坏死性血管炎导致肠毛细血管通透性增加,或淋巴管扩张有关。此外抗Ro/SSA作为SLE相关PLE中最常见的自身抗体[26],可能作用于肠柱状上皮细胞引起肠道损伤。
诊断及鉴别诊断SLE相关PLE的诊断条件:(1)SLE诊断明确;(2)低蛋白血症并排除肝脏疾病、肾脏疾病、进食障碍或不足、蛋白质合成障碍、分解代谢加速等情况;(3)Tc99mHSA及24h α1抗胰蛋白酶清除率测定明确病变。对于同时合并LN患者,SLE相关PLE的诊断存在一定困难。当尿蛋白定量<0.8 g/24h而血清白蛋白<22 g/L时应考虑是否合并PLE。有研究发现LN和PLE可相继或同时出现,56.8%的PLE患者入院时合并LN[27]。此外抗SSA被证实与SLE相关的PLE呈正相关,可能有助于诊断。
治疗多数SLE相关PLE对激素治疗反应良好,激素治疗反应不佳者可联合免疫抑制剂。一项研究发现[27],44例SLE相关PLE患者中88.9%经激素和免疫抑制剂(CYC、MMF或MTX)治疗在6个月内病情缓解。另外FK506通过抑制肠黏膜上皮细胞及巨噬细胞表达淋巴细胞趋化因子及一氧化氮合成酶,降低肠黏膜炎症反应对SLE相关PLE产生一定治疗作用[30]。此外SLE相关PLE需要积极的支持治疗,包括输注血清白蛋白、应用利尿剂和生长抑素。生长抑素能有效地调节肠道微血管血流,改善淋巴管扩张。通过水肿、肠道症状、血清白蛋白和补体C3及胆固醇水平的变化可评估疗效。
小结:SLE相关肠道损伤可首发或在病程中出现,常与狼疮活动相关,病程早期误诊率高,其实际患病率可能远高于目前报道的数据,需要更多的研究进行验证。加强对SLE相关肠道损伤的认识,结合影像学检查,可提高早期诊断率。早期识别,及时应用激素和免疫抑制剂治疗可避免不必要的手术并改善预后。
