STYK1基因在前列腺癌中的表达及意义
2021-11-19杜丽娜苏燕胜张武合吴剑维
杜丽娜,苏燕胜,张武合,吴剑维,陈 鹏
前列腺癌是男性最常见的泌尿生殖系统肿瘤之一,在我国的发病率和病死率逐年增高[1-2]。然而,前列腺癌发生发展的分子机制目前尚未完全阐明,临床上仍然缺少持续有效的治疗策略。寻找新的前列腺癌诊断和治疗靶点,探索其致病机制,具有重要的科学意义。STYK1(serine threonine tyrosine kinase 1),也称NOK(novel oncogene with kinase domain),属于受体型蛋白酪氨酸激酶家族成员,在肺癌、结肠癌、乳腺癌、卵巢癌等多种肿瘤的致病过程中发挥作用,被认为是一种新的癌基因[3-6]。然而,STYK1在前列腺癌中的表达及意义目前仍不完全清楚。为此,本研究通过“UALCAN、GEPIA、LinkedOmics”等数据库分析STYK1基因在前列腺癌中的表达及生物学功能;收集前列腺癌组织样本,利用实时定量PCR法研究STYK1基因的表达及与临床病理特征之间的关系;构建STYK1低表达的前列腺癌细胞系,通过CCK8实验和流式细胞周期检测研究STYK1对前列腺癌细胞增殖的影响,以期为前列腺癌的防治提供新的思路。
1 材料与方法
1.1 组织样本来源 随机入组2019年1月—2020年8月在空军986医院及西京医院行手术切除的前列腺癌标本67例,均经病理科医师明确诊断。年龄54~83岁,中位年龄64岁,病例资料完整,取病理前均未进行放化疗及内分泌治疗。TNM分期依据美国癌症分期联合会(AJCC)第8版进行[7]。本研究经空军军医大学伦理委员会批准同意,入组患者均签署知情同意书。
1.2 生物信息学分析 利用生物信息学在线工具THE HUMAN PROTEIN ATLAS、UALCAN分析STYK1在前列腺癌中的表达情况;GEPIA分析STYK1与PSA、PSMA、AR、PCA3的表达相关性;利用LinkedOmics进行STYK1基因的功能富集分析。
1.3 细胞培养与转染 LNCaP细胞购自上海科学院细胞库,在37 ℃,5%CO2条件下,用含10%胎牛血清的1640培养基(Gibco公司,美国)常规培养。用于干扰STYK1基因表达的shRNA设计及慢病毒包装由上海吉凯公司完成。为了避免脱靶效应,采用2种针对STYK1基因设计的shRNA进行实验。shSTYK1#1序列:5' -CCGGGAAGCAGTATGAAGTGATTATCTC GAGATAATCACTTCATACTGCTTCTTTTTTG-3';shSTYK1#2序列:5'-CCGGGCCCATCTTTCGAGCC AATATCTCGAGATATTGGCTCGAAAGATGGGC TTTTTG-3'。
1.4 实时定量PCR TRIzol法提取总RNA,SuperScript III First-Strand Synthesis kit试剂盒(Invitrogen公司,美国)进行逆转录,PCR反应在Funglyn Biotech PCR仪上(Fuang lyn,加拿大)进行,以GAPDH作为内参照。STYK1的引物序列为F:5' - CATCTTTCGAGCCAATATGAACAC-3',R:5' -TGGAATTGGATTCGCCCTAA-3'。GAPDH的引物序列为F:5' -TGACTTCAACA GCGACACCCA-3',R:5' -CACCCTGTTGCTGTA GCCAAA-3'。反应条件为:95 ℃预变性10 min,然后按92 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s进行40个循环,72 ℃ 7 min延伸。STYK1基因相对表达量用2-∆∆Ct法进行计算[8-9]。
1.5 Western blot 收取对数生长期细胞后用RIPA缓冲液提取总蛋白,BCA法测定蛋白质浓度。分别取等量(20 µg/孔)的待测样品进行SDS-PAGE凝胶电泳,之后电转至PVDF膜上。室温下5%脱脂牛奶封闭1 h,4 ℃条件下加入STYK1K抗体(1:1 000;ab220262,abcam公司,英国)孵育过夜,之后加入二抗(1:5 000;ZB-2301,中杉金桥公司,中国)室温下孵育2 h。增强发光法显色,ImageJ软件测量灰度值。目的蛋白表达量=目的蛋白灰度值/内参GAPDH灰度值。
1.6 CCK8绘制生长曲线 每个96孔板中接种100 µl细胞悬液,调整细胞密度至3×103个/孔,每隔24 h取出一块96孔板,弃上清后加入混合液(CCK-8:RPMI1640=1:10)100 µl,孵育1 h后检测450 nm处光密度值(OD)。
1.7 流式细胞周期检测 待测细胞以1×106个/ml的浓度悬浮后,用75%乙醇在4 ˚C下固定过夜,冷PBS液洗涤后,加入染色液(50 µg/ml PI和20 µg/ml RNase)在37˚C条件下染色30min。使用流式细胞仪(BD Biosciences公司,美国)在488 nm激发波长下对细胞DNA含量进行分析。
1.8 统计学处理 应用SPSS 19.0软件对数据进行统计分析,计量资料以±s表达。2组数据比较采用t检验或Mann-Whitney U检验,表达率的比较采用Fisher精确检验,3组数据间的比较采用one-way ANOVA和Tukey检验。受试者工作特征曲线(receiver operating characteristic,ROC)分析评价STYK1表达水平对于前列腺癌的诊断价值。以P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析STYK1在前列腺癌中的表达 通过THE HUMAN PROTEIN ATLAS数据库分析发现,STYK1在肺癌、乳腺癌、胰腺癌等多种肿瘤组织中都存在较高水平的表达,其中STYK1在前列腺癌组织中的高表达尤为明显(图1A)。通过UALCAN数据库进一步分析发现,STYK1基因在前列腺癌组织中的表达具有明显的种族差异性,其在白种人前列腺癌中的表达水平明显高于正常前列腺组织(P<0.05),而在非洲裔美国人中这种差异并不明显(图1B)。此外,通过GEPIA数据库分析发现,STYK1基因表达水平与前列腺癌发病中的多种关键分子及诊断标志物具有相关性(P<0.05),如雄激素受体(AR,图1C),前列腺特异性膜抗原(FOLH1/PSMA,图1D),前列腺特异性抗原(KLK3/PSA,图1E),前列腺癌基因3(PCA3,图1F)。

图1 生物信息学分析STYK1在前列腺癌中的表达
2.2 实时定量PCR检测前列腺癌组织中STYK1基因的表达 收集67例在我院行手术治疗的前列腺癌患者的临床资料及手术样本。利用实时定量PCR检测STYK1基因在癌组织及癌旁组织中的表达,并计算相对表达量。与癌旁组织比较,STYK1基因在前列腺癌组织中的表达明显升高(图2A)(P<0.05))。以STYK1基因表达水平作为检验指标,绘制诊断前列腺癌的ROC曲线(图2B ),曲线下的面积为0.925(95%CI:0.867~0.964),当截断值为1.83时,灵敏度为85.07%,特异度为82.09%,约登指数为0.67。进一步对患者进行分组后,发现TNM(Ⅰ-Ⅱ)期的前列腺癌患者肿瘤组织中STYK1基因表达水平显著低于TNM(Ⅲ-Ⅳ)的肿瘤患者(图2C,P<0.05)。依据术前PSA检测水平进行分组后,结果显示PSA<10 mg/L组的STYK1基因表达水平显著低于PSA≥10 mg/L组(图2D,P<0.05)。根据中位数值将STYK1基因表达水平分为高/低表达组,利用Fisher精确检验分析STYK1基因表达与前列腺癌患者临床病理特征之间的关系。术前PSA≥10 mg/L组中STYK1基因的高表达率显著高于PSA<10 mg/L组(70.15% vs 8.96%,P<0.05),TNM Ⅰ~Ⅱ期组中STYK1基因的高表达率显著低于TNM Ⅲ~Ⅳ组(25.37% vs 53.73%,P<0.05),而患者的年龄、Gleason评分高低对STYK1基因表达水平无显著影响(P>0.05)(表1)。

表1 STYK1基因表达与前列腺癌临床病理特征的关系
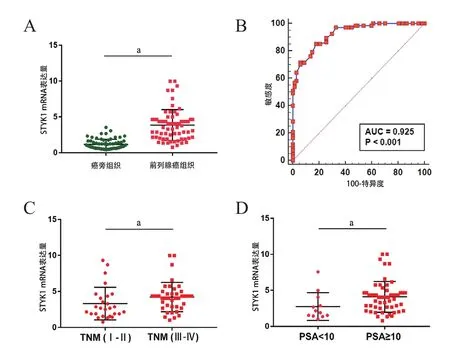
图2 STYK1基因在前列腺癌组织中的表达
2.3 前列腺癌中STYK1相关差异基因及功能富集分析 利用LinkedOmics数据库分析497例前列腺癌样本中与STYK1相关的差异表现基因(TCGA_PRAD,UNC,RNAseq,Pearson Correlation test)。选取与STYK1表达呈显著正相关和负相关的前20个基因绘制热图,结果显示,与STYK1呈正相关的基因有CD9、SLC45A3、LPCAT3、LIPH等;呈显著负相关的基因有SYNGR3、PHC2、SLC2A6等(图3A)。GO功能富集分析结果显示,差异基因主要与核苷酸-糖代谢过程、细胞氨基酸代谢过程、脂质分解代谢过程、辅酶代谢过程等功能相关(图3B),其中涉及多种细胞代谢反应,提示STYK1可能影响前列腺癌细胞的生长和增殖。

图3 前列腺癌中STYK1相关差异基因及功能富集分析
2.4 STYK1对前列腺癌细胞增殖的影响 通过慢病毒转染,构建了两株STYK1稳定低表达的LNCaP细胞系。利用实时定量PCR(图4A)和Western blot检测(图4B)证实,在构建的LNCaP-shSTYK1#1和LNCaP-shSTYK1#2细胞中,STYK1的表达均受到了显著抑制(P<0.05)。利用CCK8法绘制生长曲线,结果显示从培养第4天开始,LNCaP-shSTYK1#1和LNCaP-shSTYK1#2细胞的增殖水平显著低于未转染的LNCaP细胞(P<0.05,图4C)。流式细胞周期检测的结果显示,LNCaP-shSTYK1#1和LNCaP-shSTYK1#2细胞的S期细胞比例显著低于LNCaP细胞(20.67±0.81,21.57±0.80 vs 28.87±0.68,P<0.05)(图4D)。

图4 抑制STYK1基因表达对LNCaP细胞增殖的影响
3 讨论
由于STYK1基因在前列腺癌中的表达及作用尚不清楚,因此本研究首先对STYK1的表达水平进行了生物信息学分析。分析结果显示,STYK1在前列腺癌中呈现较高的表达水平,甚至高于肺癌、乳腺癌、胰腺癌等其他类型的肿瘤,而STYK1在肺癌、乳腺癌等肿瘤发病中的作用已被广泛报道[5,10-11]。进一步分析还发现,在前列腺癌中,STYK1基因的表达与AR、PSA、PSMA、PCA3等基因的表达之间存在显著的相关性。AR是前列腺癌发生发展的重要驱动因素,也是一种常用的治疗靶点[12-13]。PSA、PSMA、PCA3则是前列腺癌的特征性蛋白,在前列腺癌中特异性高表达,是目前常用的前列腺癌诊断标志物[14-16]。这些结果都提示STYK1可能在前列腺癌的发病中发挥作用。此外,生物信息学的分析结果还提示,STYK1的表达具有种族差异性。白种人前列腺癌组织中STYK1的表达水平显著高于正常前列腺组织,而在非洲裔美国人中则未发现这种差异性表达。这也从侧面说明了研究亚裔人群前列腺癌中STYK1表达及作用的必要性。
利用实时定量PCR的方法,检测了67例在我院行手术治疗的前列腺癌患者中STYK1基因的表达情况,证实STYK1基因在前列腺癌组织中的表达水平显著高于癌旁组织,而且STYK1表达水平和患者的TNM分期、术前PSA水平等临床病理特征之间存在关联。ROC曲线结果显示STYK1基因的表达水平对于前列腺癌具有显著的诊断意义,这与之前的生物信息学分析结果(STYK1和PSA/PSMA/PCA3的表达具有相关性)一致。STYK1在前列腺癌中的特异性高表达说明其可能在前列腺癌的发生发展中扮演重要角色。为此,本研究利用LinkedOmics数据库进行了功能富集分析,发现STYK1相关的差异表现基因涉及了多个细胞代谢信号通路,提示STYK1可能影响前列腺癌细胞的增殖过程。
为了证实STYK1基因在前列腺癌细胞增殖中的作用,利用慢病毒转染构建了STYK1低表达的前列腺癌细胞系。通过CCK8法绘制生长曲线和流式细胞周期检测,发现抑制STYK1基因表达后,前列腺癌细胞的增殖能力也受到了明显的抑制。已有研究证实,STYK1作为一种蛋白酪氨酸激酶,能够影响PI3K、AKT等多种下游信号分子的活性,而后者在肿瘤细胞的增殖过程中发挥重要作用[17-18]。这与本研究结果一致,都提示STYK1可能通过影响肿瘤细胞增殖来参与前列腺癌的发病过程。
综上所述,本研究通过生物信息学分析和临床样本检测,证实STYK1基因在前列腺癌中特异性高表达,表达水平与TNM分期等临床要素相关,且具有潜在的诊断价值,细胞功能学实验进一步证实STYK1能够影响前列腺癌细胞的增殖能力。这些结果提示STYK1有望成为新的前列腺癌诊疗靶点。
