达格列净治疗2型糖尿病合并心力衰竭的效果分析
2021-11-18乔琛琛李科民刘安全
乔琛琛 李科民 刘安全



摘 要 目的:评价达格列净在2型糖尿病合并心力衰竭患者中应用的临床效果。方法:选取152例2型糖尿病合并心力衰竭患者作为研究对象,分成对照组和观察组各76例,对照组患者行常规药物治疗,观察组选择常规药物加达格列净治疗,比较两组患者6个月后生化指标及心功能指标情况。结果:用药6个月与用药前相比,观察组的体质量等心血管危险因素及左心室舒张末期内径(LVEDD)、N末端B型利钠肽(NT-proBNP)水平均降低且低于对照组(P<0.05),而左心室射血分数(LVEF)水平则上升。结论:对于2型糖尿病合并心力衰竭患者,达格列净除降糖作用外,能够显著改善患者心功能,值得临床试用。
关键词 心力衰竭 2型糖尿病 达格列净
中图分类号:R977.15; R587.1 文献标志码:A 文章编号:1006-1533(2021)21-0028-04
Effect of dapagliflozin on heart failure in type 2 diabetes mellitus
QIAO Chenchen, LI Kemin, LIU Anquan
(Department of Cardiology, the First Peoples Hospital of Bengbu, Bengbu 233000, China)
ABSTRACT Objective: To analyze the effect of dapagliflozin on heart failure in patients with type 2 diabetes mellitus(T2DM). Methods: Clinical data from 152 cases of T2DM patients with heart failure were collected and the patients were divided into a control group (treated with conventional medication) and an observation group (treated with conventional medication plus dapagliflozin) with 76 cases each. The biochemical indexes and cardiac function indexes were collected and analyzed 6 months after treatment. Results: The levels of cardiovascular risk factors such as body mass and the left ventricular end-diastolic dimension (LVEDD) and the N-terminal-pro-B-type natriuretic peptide (NT-proBNP) were all decreased while the left ventricular ejection fraction (LVEF) levels were increased in the observation group at 6 months after treatment compared with those before treatment (P<0.05). Conclusion: Dapagliflozin is a valuable option for the management of patients with T2DM and heart failure because it can improve heart failure besides hypoglycemia effect and is worthy of clinical trial.
KEy wORDS heart failure; type 2 diabetes mellitus; dapagliflozin
随着生活水平的提高和人口老龄化,2型糖尿病(type 2 diabetes mellitus,T2DM)合并心力衰竭的发病率和流行率在全球都在增加,早在2007年美国弗雷明汉镇心脏研究所就发现了2型糖尿病患者的心血管疾病罹患率增加了2~4倍[1],近年来研究发现2型糖尿病患者的心血管疾病死亡风险增加了2~3倍[2],约有25%的糖尿病患者同时患有心力衰竭[3],因此糖尿病患者的心功能保护变得异常重要。2型糖尿病和心力衰竭的双重流行使得我们迫切需要找到对这两种疾病均有效的疗法,从而解决这些患者家庭及社会的高額负担[4]。近来,新型降糖药物钠-葡萄糖协同转运蛋白-2(sodium-glucose cotransporter-2,SGLT-2)抑制剂正受到广泛研究和关注,因其除了可降低血糖,还被证实有许多心血管益处[5]。3项大型随机临床试验,坎格列净的心血管评估研究(CANVAS)[6]、达格列净对心血管事件的影响试验(DECLARE-TIMI58)[7]、恩格列净对2型糖尿病的心血管结局和死亡率试验(EMPA-REG OUTCOME)[8],发现SGLT-2可降低动脉粥样硬化患者主要心血管不良事件发生的风险。SGLT-2抑制剂以其独特的优势,在2017年3月以达格列净为代表的首个SGLT-2抑制剂在中国批准上市。本研究主要观察达格列净应用于2型糖尿病合并心力衰竭患者的临床效果。
1 资料与方法
1.1 一般资料
选取2019年9月—2020年3月在本院心内科收治的2型糖尿病合并心力衰竭患者152例为研究对象,均符合2016年美国糖尿病学会(ADA)公布的2型糖尿病的诊断标准,美国纽约心脏病学会(NYHA)分级Ⅱ~Ⅳ级。年龄50~75岁,平均年龄(62.4±5.44)岁。该研究方案经本院伦理委员会批准,所有入选患者均签署知情同意书。
排除标准:①近期接受过SGLT-2抑制剂治疗或既往出现过与SGLT-2相关的无法接受的副作用者;②1型糖尿病患者;③2型糖尿病合并其他脏器功能严重不全者;④急性肾损伤和肾功能损害患者(内生肌酐清除率<60 mL/min);⑤2型糖尿病6个月内合并乳酸酸中毒及酮症酸中毒者;⑥病毒、细菌感染,风湿性瓣膜和心包疾病,代谢功能异常及贫血所致的心力衰竭;⑦反复发生低血糖者;⑧并存恶性肿瘤者。
1.2 方法
1.2.1 分组及给药方法
152例2型糖尿病合并心力衰竭患者随机分为2组,对照组76例接受标准治疗,观察组76例给予标准治疗药物加达格列净10 mg/d(商品名安达唐,美国阿斯利康制药有限公司生产,规格为每片5 mg)。入院时检测胆固醇、高密度脂蛋白、尿酸、空腹血糖、血肌酐等常规生化指标和N末端B型利钠肽(N-terminal-pro-B-type natriuretic peptide,NT-proBNP),随访6个月后复查上述指标,随访期间定期检测患者常规生化指标,如发现患者内生肌酐清除率低于60 mL/min则退出。随访过程中,对照组有1例失访,观察组有1例因费用问题停用达格列净,两组均无因肾功能恶化退出者,最终纳入观察组和对照组各75例。
1.2.2 实验标本的采集和处理
采集所有入选对象治疗前及治疗6个月后清晨空腹静脉血,标本分离血清后置于-20 ℃低温冰箱保存,同批待测胆固醇、高密度脂蛋白、尿酸、空腹血糖采用美国贝克曼生化分析仪Au5800测定,NT-proBNP采用全自动化学发光仪Maglumi 2000 Plus测定。
1.2.3 超声心动图检测
应用美国GE公司VividE9彩色多普勒超声心动仪分别测定治疗前后左心室射血分数(left ventricular ejection fraction,LVEF)、左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)。
1.2.4 统计学处理

2 结果
2.1 一般资料比较
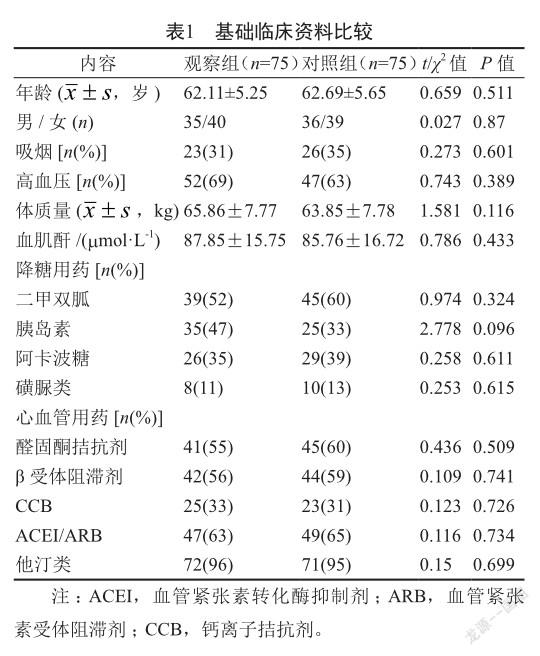
两组临床特征,如年龄、性别、吸烟、高血压、体质量及血肌酐水平情况比较,差异均无统计学意义(P>0.05);两组患者在服用降糖药物及心血管药物情况比较,差异也均无统计学意义(P>0.05,表1)。
2.2 达格列净对心血管危险因素的影响
两组患者治疗前体质量、胆固醇、高密度脂蛋白、尿酸、空腹血糖、收缩压及舒张压比较,差异均无统计学意义(P>0.05)。观察组患者治疗6个月后较治疗前上述指标均明显改善(P<0.05,表2)。治疗后观察组的体质量、胆固醇、尿酸、空腹血糖、收缩压及舒张压均优于对照组(P<0.05,表3)。

2.3 达格列净对心功能的影响
两组患者治疗前血清NT-proBNP水平、LVEF、LVEDD比较,差异均无统计学意义(P>0.05)。观察组治疗6个月后较治疗前血清NT-proBNP水平降低、 LVEF上升、LVEDD减小(P<0.05),且治疗6个月后血清NT-proBNP及LVEDD水平比较,观察组优于对照组(P<0.05,表4)。

2.4 不良反应比较
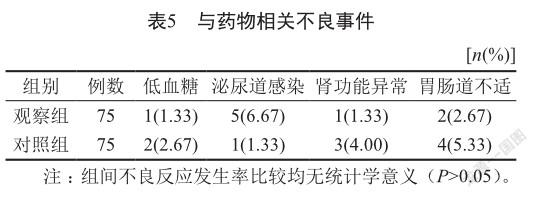
观察组5例出现尿频、尿急等泌尿道感染症状,考虑与达格列净增加尿葡萄糖浓度有关,嘱患者多饮水稀释尿液后症状均可缓解;2例出现胃肠道不适,症状不重可耐受能自行缓解;对照组4例出现胃肠道不适,症状均可自行缓解(表5)。
3 討论
SGLT-2抑制剂作为一种降糖药,可显著改善2型糖尿病患者的心血管预后。EMPA-REG OUTCOME结果显示恩格列净在因心血管疾病死亡或因心力衰竭导致住院的事件终点上,其作用在有无心衰病史患者之间无明显差异,相比之下,在CANVAS计划中,坎格列净干预后,心力衰竭患者组因心血管疾病死亡或因心力衰竭导致住院的风险有了更大的降低。但上述两试验均未限定左室射血分数值作为入选条件,DECLARE-TIMI58试验则特定的选择射血分数≤40%的患者进行达格列净干预,而且它是迄今为止最大的SGLT-2抑制剂心血管预后试验,该研究涉及20个国家,410个研究中心。达格列净是我国上市的首个SGLT-2抑制剂,2018年公布的DECLARETIMI 58实验研究和2019年3月最新公布的DECLARE研究均显示显示,对于射血分数降低性心力衰竭,达格列净能显著降低患者住院率或心血管死亡率[9-10]。相比之下,本研究则显示无论是否合并射血分数降低性心力衰竭,达格列净观察组患者在心血管危险因素指标(体质量、胆固醇、尿酸、空腹血糖、收缩压及舒张压)、血清NTproBNP水平及LVEDD等方面均显著优于对照组,故此类药物很可能成为治疗和预防心力衰竭的一把利剑。
心力衰竭可定義为由心室充盈和射血过程中任何结构和功能损伤引起的复杂临床综合征。其患病率随着年龄的增长而增加,并常伴随高血压、肥胖、2型糖尿病等合并症。在2型糖尿病患者中最常见的早期左室功能障碍是左室舒张功能障碍,并且在无明显冠脉疾病且血压正常的糖尿病患者中,高达75%的患者存在无症状左室舒张功能障碍。从无症状舒张功能障碍到晚期有症状心衰,可能需要数年的进展,其特征是微血管顺应性改变、间质纤维化、左室壁厚度增加。Matsutani等[11]进行了一项前瞻性单中心研究,以评估坎格列净对37例2型糖尿病合并心衰患者的左室舒张功能影响,发现3个月后,以二尖瓣流入量E/二尖瓣e环形速度(E/e)和左室质量指数(LVMI)评估的左室舒张功能明显改善。Soga等[12]对患有心衰的2型糖尿病患者亦进行了前瞻性多中心试验,结果显示SGLT-2抑制剂可改善左室舒张功能参数(包括E/e、LVMI和左房体积指数LAVI)。与国外研究结果一致,本研究结果显示达格列净可显著改善心衰指标(NT-proBNP水平及LVEDD),但反应左室收缩功能的特异性指标左室射血分数(LVEF)在组间比较并无统计学差异,亦进一步提示SGLT-2抑制剂以改善左室舒张功能为主。SGLT-2抑制剂改善左室舒张功能的机制可能如下:①减轻体质量及调节血脂SGLT-2抑制剂增加体液和热量排泄引起脂肪减少[13],进而改善内皮功能障碍,减少心外膜脂肪累积等改善了心脏舒张功能[14-16]。②降低血尿酸 研究显示长期高尿酸血症会导致心舒张功能下降[17],SGLT-2抑制剂可通过抑制尿酸重吸收,间接降低血尿酸水平[18]。本实验及国内其他学者亦通过实验证实SGLT-2抑制剂组尿酸水平可下降达26.16 mmol/L[19]。③减少心脏前负荷 SGLT-2抑制剂减少容量负荷,改善心脏舒张功能[20]。④改善心肌能量代谢SGLT-2抑制剂可增强脂肪动员,促进酮体生成,从而改善心脏功能。SGLT-2抑制剂在心肌细胞能量代谢中的其他机制的研究尚在进行中[21]。
终上所述,达格列净作为首个在中国批准上市的SGLT-2抑制剂,除了降糖之外还表现出良好的心功能保护作用,2019年美国心脏病学会(ACC)在心血管疾病一级预防指南中指出,在生活方式干预及使用二甲双胍的基础上,推荐将SGLT-2抑制剂应用于伴有其他心血管危险因素的2型糖尿病患者(Ⅱb推荐)[22]。但由于本研究仅单科室研究,选取的样本量有限,观察时间亦相对较短,且基于入选排除标准的存在,故有一定局限性,长期用药的安全性也尚需进一步研究明确。
参考文献
[1] Fox CS, Coady S, Sorlie PD, et al. Increasing cardiovascular disease burden due to diabetes mellitus—the Framingham Heart Study[J]. Circulation, 2007, 115(12): 1544-1550.
[2] Dey AK, Groenendyk J, Mehta NN, et al. The effect of sodium-glucose cotransporter 2 inhibitors and glucagon-like peptide 1 agonists on cardiovascular disease in patients with type 2 diabetes[J]. Clin Cardiol, 2019, 42(3): 406-412.
[3] Arnold SV, Echouffo-Tcheugui JB, Lam CS, et al. Patterns of glucose-lowering medication use in patients with type 2 diabetes and heart failure. Insights from the diabetes collaborative registry (DCR)[J]. Am Heart J, 2018, 203: 25-29.
[4] Cavender MA, Steg PG, Smith SC, et al. REACH registry investigators. Impact of diabetes mellitus on hospitalization for heart failure, cardiovascular events, and death: outcomes at 4 years from the Reduction of Atherothrombosis for Continued Health (REACH) Registry[J]. Circulation, 2015, 132: 923-931.
[5] Davies MJ, Dalessio DA, Fradkin J, et al. Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD)[J]. Diabetes Care, 2018, 41(12): 2669-2701.
[6] Mahaffey KW, Neal B, Perkovic V, et al. Canagliflozin for primary and secondary prevention of cardiovascular events: results from the CANVAS Program (Canagliflozin Cardiovascular Assessment Study)[J]. Circulation, 2018, 137(4): 323-334.
[7] McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in patients with heart failure and reduced ejection fraction[J]. N Engl J Med, 2019, 381(21): 1995-2008.
[8] Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes[J]. N Engl J Med, 2015, 373(22): 2117-2128.
[9] Wiviott SD, Rae I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med, 2019, 380(4): 347-357.
[10] Kato ET, Silverman MG, Mosenzon O, et al. Effect of dapagliflozin on heart failure and mortality in type 2 diabetes mellitus[J]. Circulation, 2019, 139(22): 2528-2536.
[11] Matsutani D, Sakamoto M, Kayama Y, et al. Effect of canagliflozin on left ventricular diastolic function in patients with type 2 diabetes[J]. Cardiovasc Diabetol, 2018, 17(1): 73.
[12] Soga F, Tanaka H, Tatsumi K, et al. Impact of dapagliflozin on left ventricular diastolic function of patients with type 2 diabetic mellitus with chronic heart failure[J]. Cardiovasc Diabetol, 2018, 17(1): 132.
[13] Ferrannini E, Solini A. SGLT2 inhibition in diabetes mellitus: rationale and clinical prospects[J]. Nat Rev Endocrinol, 2012, 8(8): 495-502.
[14] Solini A, Giannini L, Seghieri M, et al. Dapagliflozin acutely improves endothelial dysfunction, reduces aortic stiffness and renal resistive index in type 2 diabetic patients: a pilot study[J]. Cardiovasc Diabetol, 2017, 16(1): 138.
[15] Kim SR, Lee YH, Lee SG, et al. The renal tubular damage marker urinary N-acetyl-beta-D-glucosaminidase may be more closely associated with early detection of atherosclerosis than the glomerular damage marker albuminuria in patients with type 2 diabetes[J]. Cardiovasc Diabetol, 2017, 16(1): 16.
[16] Kusaka H, Koibuchi N, Hasegawa Y, et al. Empagliflozin lessened cardiac injury and reduced visceral adipocyte hypertrophy in prediabetic rats with metabolic syndrome[J]. Cardiovasc Diabetol, 2016, 15(1): 157.
[17] Ndrepepa G. Uric acid and cardiovascular disease[J]. Clin Chim Acta, 2018, 484: 150-163.
[18] Chino Y, Samukawa Y, Sakai S, et al. SGLT2 inhibitor lowers serum uric acid through alteration of uric acid transport activity in renal tubule by increased glycosuria[J]. Biopharm Drug Dispos, 2014, 35(7): 391-404.
[19] 吳兵书. SGLT-2抑制剂联合胰岛素治疗糖尿病对心血管疾病危险因素的影响——一项随机对照试验的荟萃分析[D]. 沈阳: 中国医科大学, 2018.
[20] Lopaschuk GD, Verma S. Mechanisms of cardiovascular benefits of sodium glucose co-transporter 2 (SGLT2) inhibitors[J]. JACC Basic Transl Sci, 2020, 5(6): 632-644.
[21] Borghetti G, von Lewinski D, Eaton DM, et al. Diabetic cardiomyopathy: current and future therapies. Beyond glycemic control[J]. Front Physiol, 2018, 9: 1514.
[22] Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/ AHA guideline on the primary prevention of cardiovascular disease: a report of the American College of Cardiology/ American Heart Association task force on clinical practice guidelines[J]. Circulation, 2019, 140(11): e596-e646.
