木瓜蛋白酶辅助提取丹皮中多酚、总黄酮的响应面优化及抗氧化活性研究
2021-11-18马晓,陈刚
马 晓,陈 刚
(1.河南职业技术学院,河南 郑州450046;2.郑州师范学院,河南 郑州450044)
牡丹(PaeoniasuffruticosaAndr.)是毛茛科芍药属落叶灌木,是原产自中国的名贵木本花卉[1]。丹皮是牡丹干燥的根皮,味道微苦、辛,微寒,据《本草纲目》记载有凉血清热、活血化瘀的效用[2]。植物多酚是植物体内广泛存在的一种芳香族羟基衍生物的总称,已知的酚类物质已有8 000种以上[3]。20世纪中期以后,植物多酚抗氧化、清除自由基等功效被逐步发现,相关研究日益增多[4-5],在医学上表现出抑菌、镇痛、抗过敏、提高机体免疫功能等多种功效。纯天然的黄酮类物质具有一定的抗氧化活性[6-7],还具有抗肿瘤[8]、增强免疫力[9]等功效,可用来研发黄酮类保健饮料、黄酮类速食保健品等,同时黄酮类物质的抗辐射功能也在化妆品的研发上越来越受到重视。DPPH自由基(DPPH·)是一类具有单电子稳定性的、以氮为中心的顺磁化合物,当有自由基清除剂存在时,DPPH·接受一个电子或氢原子形成稳定的DPPH-H化合物[10],DPPH·清除率为考察物质抗氧化性的常用指标。各类自由基在生物体内具有一定的生物活性,但是过量的自由基会对体内代谢产生破坏作用,导致正常细胞和组织损坏,引发心血管疾病、帕金森症、人体衰老等[11-12]。响应面分析法是一种采用多元二次回归方程来拟合因素与响应值函数关系的优化方法[13],具有精密度高、预测性好、便于观察等优点[14]。本研究以丹皮为原料,以木瓜蛋白酶酶解辅助提取丹皮中的多酚和总黄酮,并采用响应面分析法优化多酚、总黄酮得率以及DPPH自由基清除率,预测3个指标分别达到最优时的试验因素水平以及3个指标同时达到较优时的试验因素水平,获得多元二次回归方程,以期为丹皮的开发利用提供技术支持。
1 材料与方法
1.1 材料与试剂
选取七年生植株的新鲜、无病虫害、无霉变的“凤丹”丹皮为试验材料,于65℃烘至质量恒定,粉碎后过孔径150μm筛,取筛下物贮于棕色广口瓶封口保存备用。木瓜蛋白酶,宁夏和氏璧生物技术有限公司,10 000 U/g;福林试剂、1,1-二苯基-2-三硝基苯肼(DPPH)、无水乙醇、亚硝酸钠、无水碳酸钠、氢化氧钠、硝酸铝等,均为市售分析纯。
1.2 提取液制备与响应面优化设计
准确称取1.00 g丹皮粉末于烧杯中,按表1中的实验方案添加不同Na2HPO4-柠檬酸缓冲液体积与丹皮粉末质量的比(液料比,mL∶g)、不同pH值、不同木瓜蛋白酶添加量(以丹皮粉末质量计)的提取液,搅拌均匀后置于45℃水浴锅内酶解相应时间,期间不断搅拌,提取结束后,以三层滤纸过滤后得到提取液用于后续测定。
选取酶添加量(X1)、液料比(X2)、pH值(X3)和酶解时间(X4)为影响因素,设计响应面分析试验,共29个试验点,其中零水平重复5次,设为5个中心点,用以估计试验误差,其余24个试验点为析因点,分别分析4个影响因素对多酚得率(Y1)、总黄酮得率(Y2)和DPPH自由基清除率(Y3)的影响。
1.3 分析方法
1.3.1多酚得率的测定参考蔡庆生[15]的方法,配制质量浓度为0.05 g/L的没食子酸标准液。分别移取0、0.2、0.4、0.6、0.8和1.0 mL的没食子酸标准液于试管,分别加入蒸馏水6、5.8、5.6、5.4、5.2、5.0 mL,加入福林试剂1 mL,最后加入3 mL 7.5%的碳酸钠溶液,充分摇匀后静置反应2 h。在765 nm处测定吸光度,并计算得线性回归方程:y=0.014 8x-0.018 6,R2=0.997 9,其中y为吸光度,x为没食子酸质量浓度(mg/L),试验结果显示没食子酸质量浓度在10~50 mg/L之间与吸光度有良好的线性关系。吸取1 mL丹皮提取液(如浓度过大,应适当稀释)于试管中,分别加入福林试剂和碳酸钠溶液反应,并测定765 nm处吸光度。根据标准曲线计算该反应体系中多酚(以没食子酸表示)的质量并根据式(1)计算多酚得率,重复3次,取平均值。

式中:Y1—多酚得率,mg/g;C—根据标准曲线计算的反应体系中多酚的质量浓度,mg/L;N—提取液稀释倍数;V—多酚提取液总体积,mL;m0—所取丹皮的质量,g。
1.3.2总黄酮得率的测定参考徐曌[16]的方法,精确配制质量浓度为0.2 g/L的芦丁标准溶液。精确量取0、1.0、2.0、3.0、4.0和5.0 mL的标准溶液于25 mL容量瓶中,各加体积分数为70%的乙醇溶液至10 mL,分别加入5%亚硝酸钠溶液0.5 mL,混合均匀,室温下静置5 min;再各加入10%硝酸铝溶液0.5 mL,混合均匀,室温下静置6 min;再分别加入4%氢氧化钠溶液5 mL,混合均匀,用70%乙醇定容至25 mL,室温下静置15 min,以第一瓶反应液作为空白对照,于510 nm处测其吸光度,将所得结果作标准曲线,求得回归方程为:y=11.479x-0.005 6,R2=0.999 3,x为芦丁质量浓度(g/L),y为吸光度。吸取1 mL的丹皮提取液(如浓度过大,应适当稀释)于25 mL容量瓶中,按标准曲线制作的操作方法测定吸光度值,计算出总黄酮(以芦丁表示)的质量浓度,并根据式(2)计算总黄酮得率,重复3次,取平均值。

式中:Y2—总黄酮得率,mg/g;C'—总黄酮质量浓度,g/L。
1.3.3DPPH自由基清除率的测定 参考孙丽萍等[17]的方法。精确称取0.019 7 g的DPPH粉末,用无水乙醇溶解定容至250 mL,配制成0.2 mmol/L的DPPH储备液,0℃下保存。取酶解后的丹皮提取液0.5 mL,加入2.5 mL的DPPH储备液,在28℃恒温水浴锅中反应30 min;同时以无水乙醇代替丹皮提取液作为空白对照,于517 nm测定样品溶液及空白对照的吸光度值,按式(3)计算DPPH自由基(DPPH·)清除率,重复3次,取平均值。

式中:Y3—DPPH·清除率,%;A空白—无水乙醇代替样品溶液所得吸光度;A样品—样品溶液的吸光度值。
1.4 数据处理
试验数据均为3次试验的平均值,用Microsoft Excel 2010整理,用Design-Expert 7.0进行回归分析与显著性检验。
2 结果与分析
2.1 响应面优化试验
响应面试验设计与结果见表1。
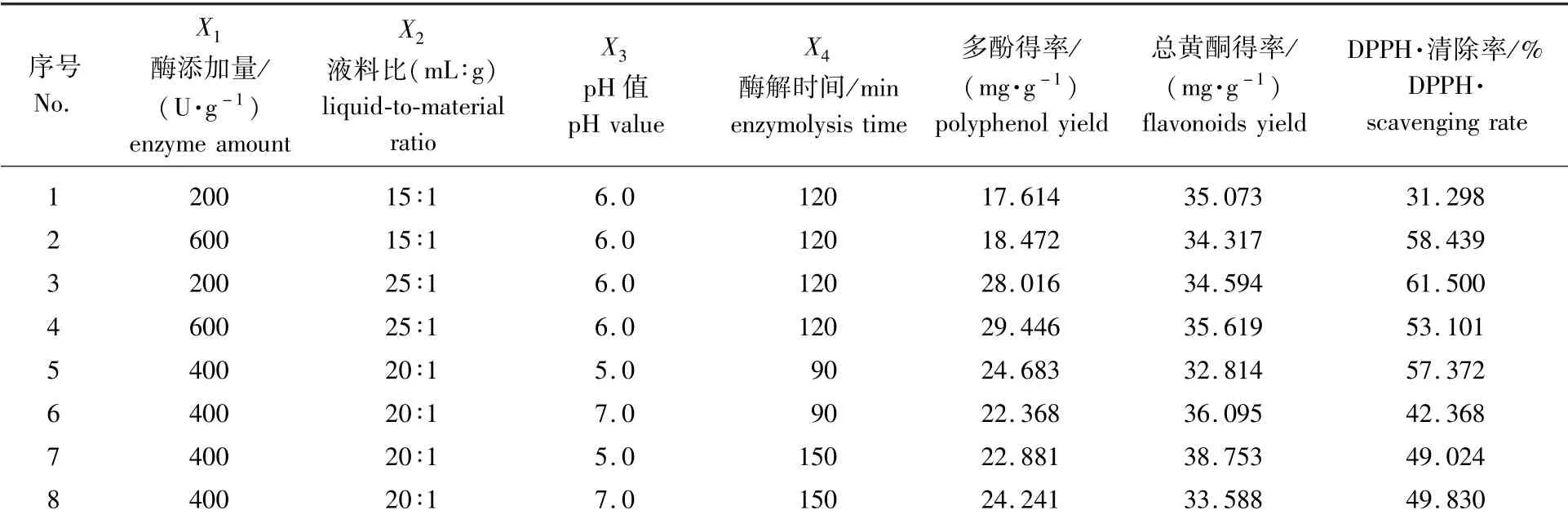
表1 响应面试验设计与结果Table 1 Design and results of response surface experiment
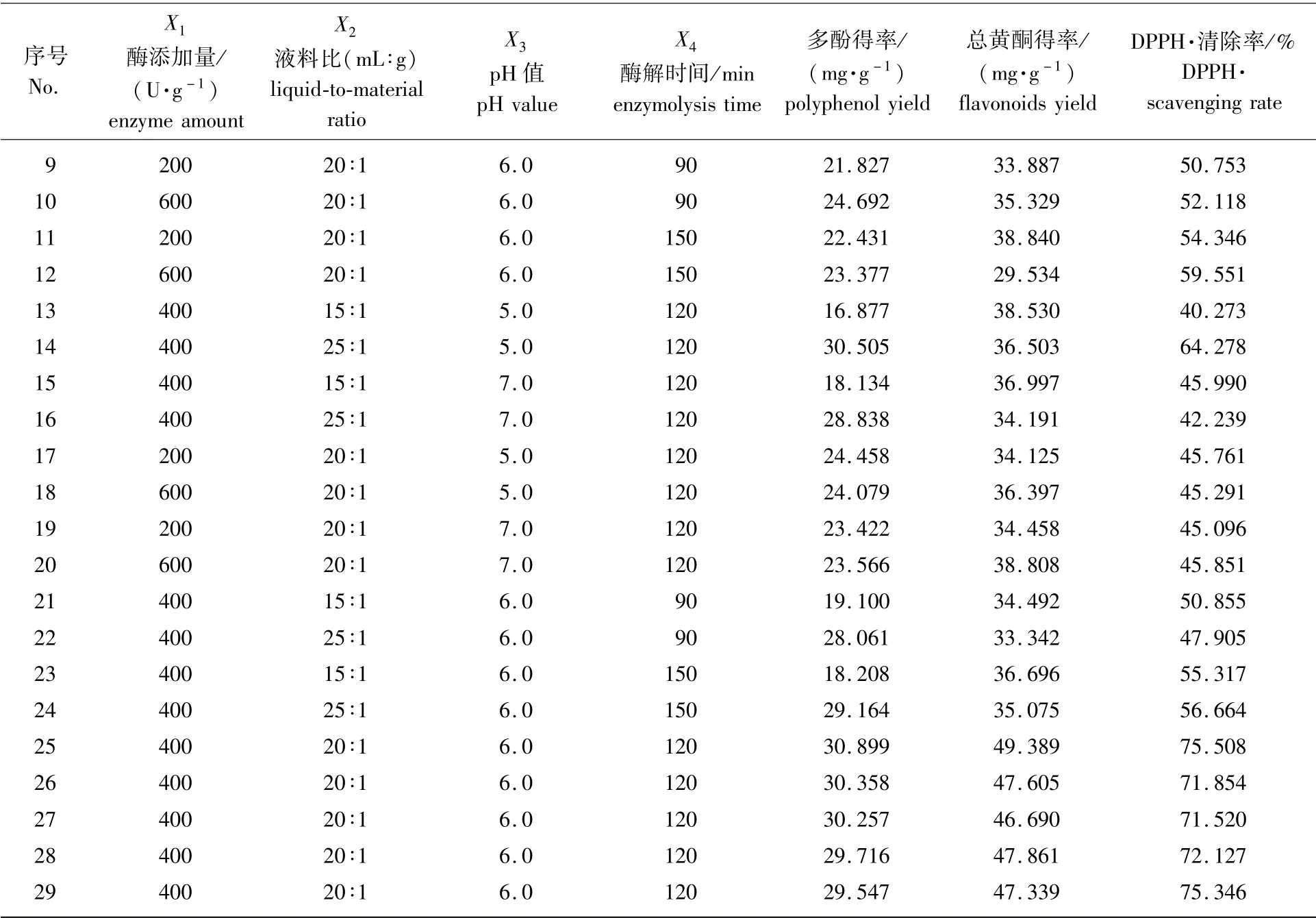
续表1
2.2 多酚得率的响应面优化
2.2.1模型建立与方差分析据表1中多酚得率的试验结果,建立关于4个影响因素X1、X2、X3、X4与多酚得率(Y1)之间的多元二次回归模型,得到方程如下:
模型的回归决定系数(R2)为0.988 7,表明有98.87%的响应面值符合此模型,受试验因素影响较大,相关性高;校正决定系数为0.977 3,说明有97.73%的试验数据变化可用此模型作参考;精密度是有效信号与噪音的比值,大于4.0视为合理,本试验精密度值为27.295,方程有较好的拟合效果;变异系数为2.71%,数值较小,说明此方程具有较高的稳定性和可靠性。
多酚得率回归方程的方差分析结果见表2。由表2可知,失拟项P值为0.315 3,说明模型失拟不显著,表明试验因素选择恰当,该方程具有较高的拟合度,误差小;该模型方程P<0.000 1,说明该模型显著性极好。项影响极显著(P<0.000 1),X2X3、X3X4项影响显著(P<0.05)。分析F值可知,4个影响因素对多酚得率的影响顺序为液料比>酶添加量>pH值>酶解时间。
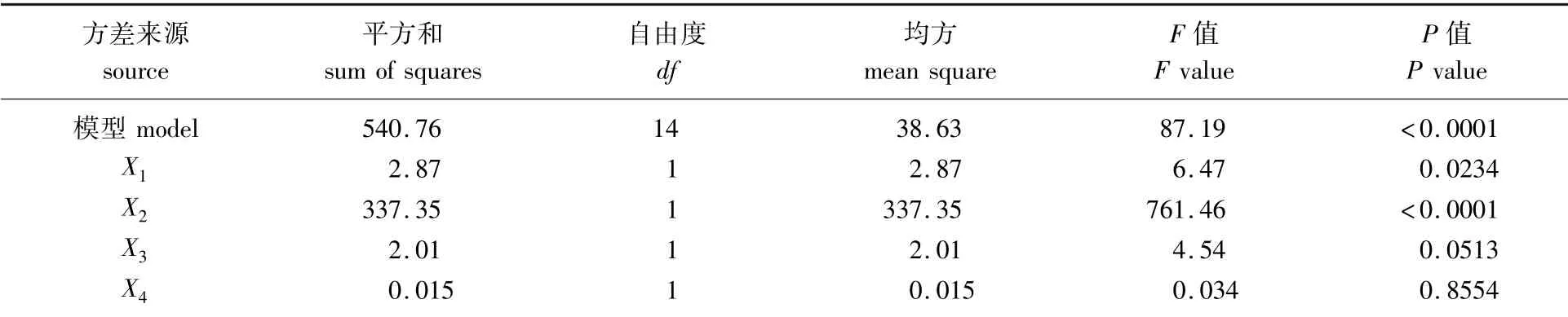
表2 多酚得率回归方程的方差分析Table 2 Analysisi of variance for the regression equation of polyphenol yield
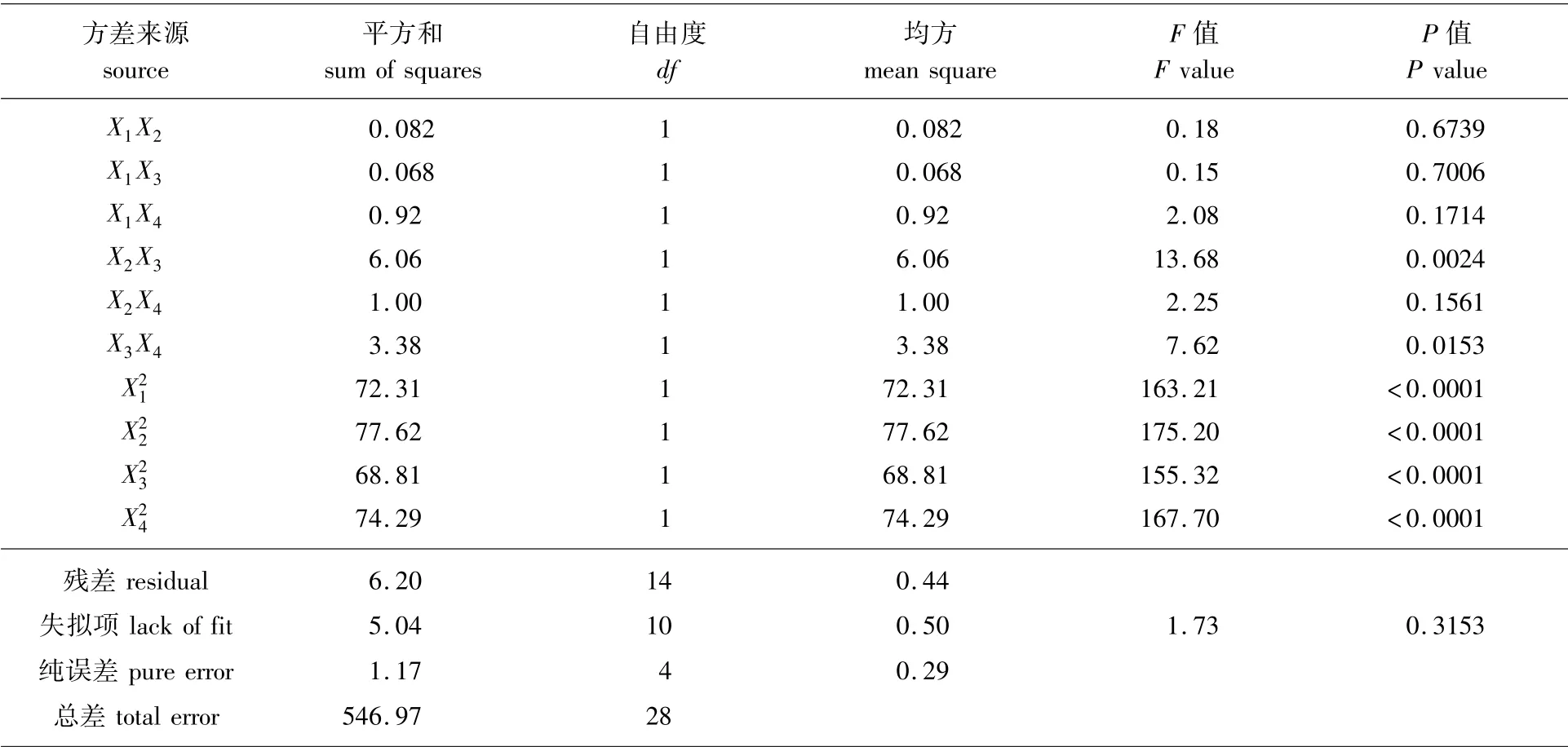
续表2
2.2.2验证实验通过回归模型优化计算得到多酚提取的最佳工艺为酶添加量418 U/g,液料比20.7∶1(mL∶g,下同),pH值5.7,酶解时间119.8 min,为操作方便,将最佳工艺调整为酶添加量400 U/g,液料比21∶1,pH值5.5,酶解时间119 min。经过验证,调整工艺条件下多酚得率为28.96 mg/g,与预测的得率31.69 mg/g,比预测值低8.61%。
2.3 总黄酮得率的响应面优化
2.3.1模型建立与方差分析据表1中总黄酮得率的响应面试验结果,建立关于4个影响因素X1、X2、X3、X4与总黄酮得率(Y2)之间的多元二次回归模型,得到方程如下:
总黄酮得率回归方程的R2为0.941 2,说明有94.12%的响应面值符合此模型,试验因素影响较大,相关性高;为0.882 5,说明有88.25%的试验数据变化可用此模型作参考;精密度值为13.033,说明方程有较好的拟合效果;变异系数为4.74%,数值较小,说明此方程具有较高的可靠性。
总黄酮得率回归方程的方差分析结果见表3。根据表3可知,失拟项P值较大,说明该方程失拟项不显著,具有较高的拟合度,误差小;该模型方程P<0.000 1,说明该模型显著性极好。X1X4项均表现出极显著的影响(P<0.01),X3X4项影响显著(P<0.05)。分析F值可得,4个影响因素对总黄酮得率的影响由大到小顺序为液料比>酶解时间>pH值>酶添加量。
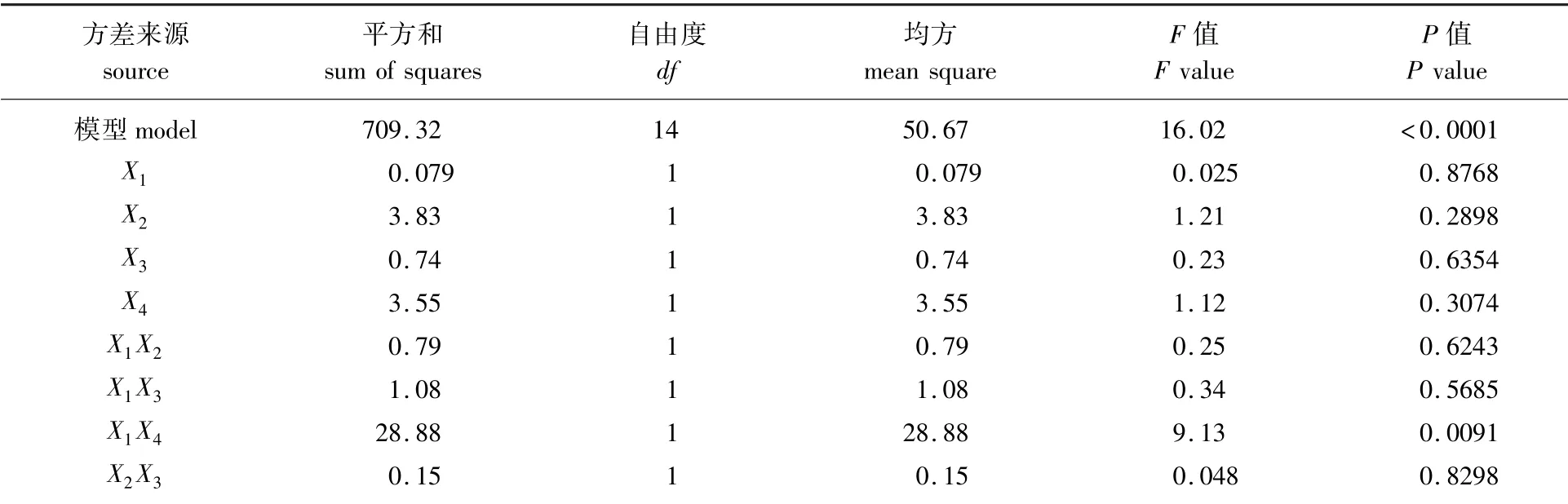
表3 总黄酮得率回归方程方差分析Table 3 Analysis of variance for the regression equation of flavonoids yield
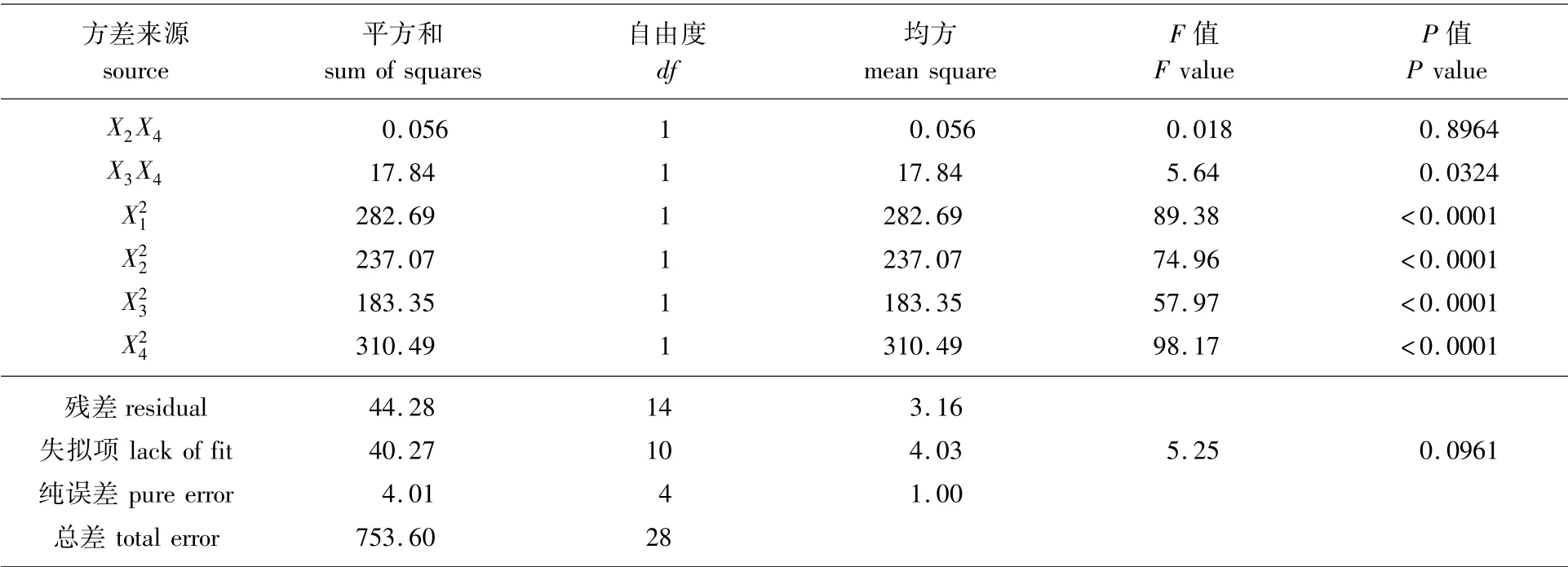
续表3
2.3.2验证实验通过回归模型优化计算得到总黄酮得率的最佳工艺为酶添加量396 U/g,液料比19.7∶1,pH值5.9,酶解时间121.5 min。为操作方便,将最佳工艺调整为酶添加量400 U/g,液料比20∶1,pH值6.0,酶解时间121 min。经过验证,调整工艺条件下总黄酮得率为44.32 mg/g,与预测的得率47.80 mg/g,比预测值低7.28%。
2.4 DPPH·清除率的响应面优化
2.4.1模型建立与方差分析据表1中DPPH·清除率的响应面试验结果,建立关于4个影响因素X1、X2、X3、X4与DPPH·清除率(Y3)之间的多元二次回归模型,得到方程如下:
DPPH·清除率回归方程的R2为0.930 7,说明有93.07%的响应面值符合此模型,试验因素影响较大,相关性高;为0.861 4,说明有86.14%的试验数据变化可用此模型作参考;精密度值为12.285,说明方程有较好的拟合效果;变异系数为7.72%,说明此方程具有较高的合理性。
DPPH·清除率回归方程方差分析结果见表4。根据表4可知,失拟项的P值较大,说明该模型具有较高的拟合度,误差小;该模型方程P<0.000 1,说明该模型显著性极好。项均表现出极显著的影响(P<0.01),分析F值可得,4个影响因素对DPPH·清除率的影响顺序由大到小为液料比>pH值>酶添加量>酶解时间。
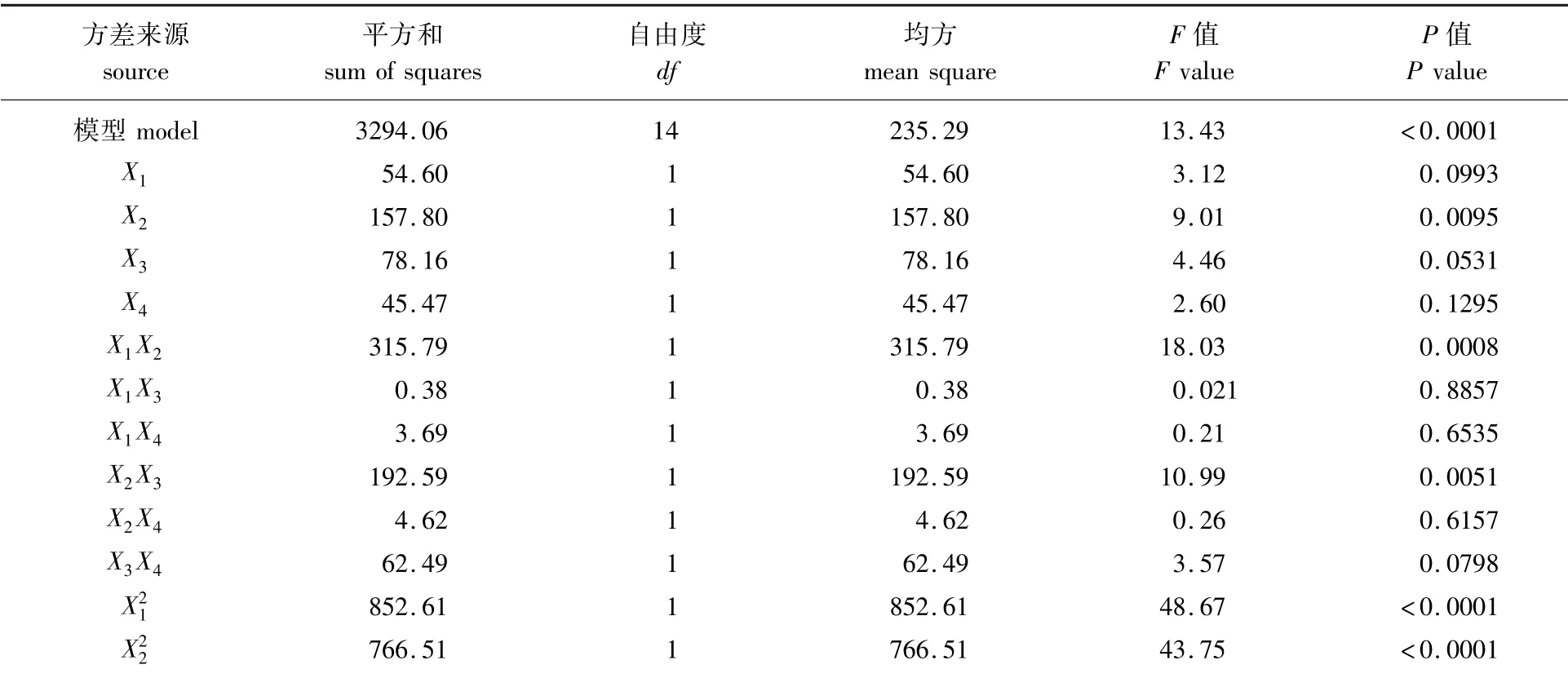
表4 DPPH自由基清除率回归方程方差分析Table 4 Analysis of variance for the regression equation of DPPH radical scavenging rate
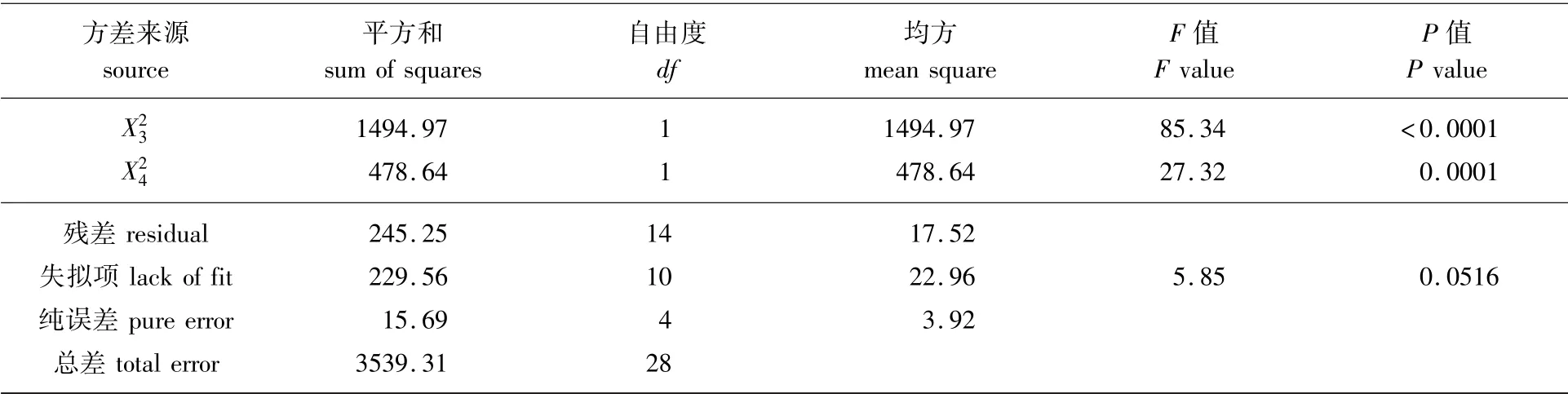
续表4
2.4.2验证实验通过回归模型优化计算得到DPPH·清除率的最佳工艺为酶添加量404 U/g,液料比21∶1,pH值5.8,酶解时间123 min。为操作方便,将最佳工艺调整为酶添加量400 U/g,液料比21∶1,pH值6.0,酶解时间123 min。经过验证,调整工艺条件下DPPH·清除率为66.87%,与预测的得率73.90%,比预测值低9.51%。
2.5 最佳组合工艺的确定及验证
通过回归模型计算得到以多酚得率、总黄酮得率、DPPH·清除率同时为优化对象的最佳工艺为酶添加量401 U/g,液料比20.7∶1,pH值5.9,酶解时间121.8 min,为操作方便,将最佳工艺调整为酶添加量400 U/g,液料比21∶1,pH值6.0,酶解时间122 min。经过验证,调整工艺条件下多酚得率、总黄酮得率和DPPH·清除率分别为28.25 mg/g、42.96 mg/g和66.72%,与预测的多酚得率、总黄酮得率和DPPH·清除率30.89 mg/g、47.55 mg/g和73.84%,分别比预测值低8.54%、9.65%和9.64%。各项指标的实际值与理论值的误差均小于10%,表明用响应面法可以有效地预测丹皮提取液多酚得率、总黄酮得率及DPPH·清除率。
为考察木瓜蛋白酶对多酚得率、总黄酮得率和DPPH·清除率的影响,在优化的提取条件,但不加木瓜蛋白酶的情况下进行了验证,该条件下多酚得率、总黄酮得率和DPPH·清除率分别为25.43 mg/g、38.16 mg/g与47.80%。可以看出,使用木瓜蛋白酶的优化提取条件的多酚得率、总黄酮得率与DPPH·清除率分别提高了11.09%、12.58%与39.58%,表明木瓜蛋白酶对多酚、总黄酮的提取得率以及DPPH·清除率有较大的提升作用。
3 结 论
采用木瓜蛋白酶法辅助提取丹皮中的多酚和总黄酮,以多酚得率、总黄酮得率以及DPPH自由基(DPPH·)清除率为考察指标,采用响应面法对提取条件(酶添加量、液料比、pH值和酶解时间)进行优化,建立多元二次回归方程模型,通过对模型的分析,预测3个指标分别达到最优的最佳提取工艺以及3个指标同时达到较优时的提取工艺并进行验证,最优工艺为酶添加量400 U/g,液料比21∶1(mL∶g),pH值6.0,酶解时间122 min,该条件下多酚得率、总黄酮得率与DPPH·清除率分别为28.25 mg/g、42.96 mg/g与66.72%。试验表明,采用响应面法建立的回归方程模型,具有较好的拟合效果和可靠性,能准确预测丹皮多酚得率、总黄酮得率以及DPPH·清除率。
同时发现,与未添加木瓜蛋白酶相比,添加木瓜蛋白酶辅助提取后的多酚得率、总黄酮得率与DPPH·清除率分别提高了11.09%、12.58%与39.58%。生产中可通过添加木瓜蛋白酶的方法提高多酚得率、总黄酮得率与DPPH·清除率,对提高DPPH·清除率效果明显。
