奥沙利铂联合卡培他滨在晚期结直肠癌患者治疗中的应用研究
2021-11-18毛学文杨乾俊
毛学文,杨乾俊,涂 丹
(遵义市第五人民医院肿瘤科,贵州 遵义 563099)
结直肠癌是指发生在结肠与直肠部位常见的消化系统恶性肿瘤,目前其主要病因尚未明确,多与环境、饮食习惯、遗传等多种因素有关。早期结直肠癌并无明显症状,病情发生与发展极为隐秘,直至病情发展至晚期患者才逐渐出现大便习惯改变、便血、腹痛、腹部包块等症状,严重时可侵犯周边或远处组织,致使结直肠癌患者生存周期大大缩短。目前临床上对结直肠癌早期患者多以手术治疗为主,但晚期患者多以化疗方式为主。卡培他滨是临床上治疗晚期结直肠癌的常用药物,该药是一种可在人体内转化成5- 氟尿嘧啶(5-FU)的抗代谢氟嘧啶脱氧核苷氨基甲酸酯类药物,其对癌细胞具有靶向作用,能有效影响癌细胞DNA合成过程,抑制癌细胞活跃程度,但服用后患者易产生胃肠道反应、骨髓抑制等不良反应,且整体治疗效果不佳[1]。奥沙利铂为第3代水溶性铂类抗癌药物,可通过产生水化衍生物干扰DNA合成过程,进而抑制肿瘤细胞活性,影响肿瘤细胞分裂,抗癌效果显著,且其细胞毒性较小[2]。本研究旨在探讨奥沙利铂联合卡培他滨对晚期结直肠癌患者免疫功能的影响,现将本次研究结果作如下报道。
1 资料与方法
1.1 一般资料 选取2019年3月至2020年5月遵义市第五人民医院收治的80例晚期结直肠癌患者,按照随机数字表法分为对照组和研究组,每组40例。对照组患者中男性19例,女性21例;年龄47~71岁,平均(59.37±3.83)岁;癌症类型:结肠癌17例,直肠癌23例;肿瘤分期[3]:Ⅲ期8例,Ⅳ期32例;肿瘤病理分型:腺癌13例(高分化腺癌3例,中分化腺癌8例,低分化腺癌2例),黏液腺癌9例,印戒细胞癌10例,腺鳞癌5例,其他3例。研究组患者中男性18例,女性22例;年龄45~73岁,平均(61.33±4.13)岁;癌症类型:结肠癌15例,直肠癌25例;肿瘤分期:Ⅲ期11例,Ⅳ期29例;肿瘤病理分型:腺癌12例(高分化腺癌4例,中分化腺癌5例,低分化腺癌3例),黏液腺癌8例,印戒细胞癌11例,腺鳞癌5例,其他4例。两组一般资料比较,差异无统计学意义(P> 0.05),组间具有可比性。纳入标准:符合《结直肠癌规范化诊疗》[4]中的相关诊断标准者;经临床病理检查确诊为晚期结直肠癌者;预计生存时间>3个月者;癌细胞远端转移、不能进行手术治疗者;口服药物未存在困难者等。排除标准:合并其他类型恶性肿瘤者;存在化疗相关禁忌证者;合并血液系统、免疫系统疾病者;凝血功能存在障碍者;对本研究所用药物过敏者等。本研究经遵义市第五人民医院医学伦理委员会审核批准,患者及家属均自愿签署知情同意书。
1.2 方法 入院后两组患者均进行常规检查,如心电图、血尿常规、肝肾功能等。对照组患者在常规检查的基础上采用卡培他滨片(齐鲁制药有限公司,国药准字 H20133361,规格:0.5 g/片)口服治疗,1 000 mg/m2,2次/d,连续服用14 d后,停药7 d,21 d为1个疗程。研究组患者在对照组的基础上将130 mg/m2注射用奥沙利铂(远大医药黄石飞云制药有限公司,国药准字H20103130,规格:50 mg)加入至500 mL 5%葡萄糖溶液中进行3~4 h的静脉滴注,于服用卡培他滨第1天开始滴注,之后停药20 d,21 d 1个疗程。两组患者均持续治疗3个疗程。
1.3 观察指标 ①比较两组患者治疗后临床疗效。参照《实体瘤免疫治疗疗效评价标准》[5]中的相关标准进行评定,患者治疗后病灶完全消失,且消失时间>1个月视为完全缓解(CR);患者治疗后病灶缩小≥30%,且缩小时间>1个月视为部分缓解(PR);患者治疗后病灶缩小程度<30%视为稳定(SD);恶化:患者治疗后病灶增大>20%或结直肠内出现新增病灶视为进展(PD)。客观缓解率=(CR+PR)例数/总例数×100%。②比较两组患者治疗前后T淋巴细胞亚群水平。于治疗前后分别抽取两组患者清晨空腹静脉血5 mL,采用流式细胞仪检测CD4+、CD8+百分比,并计算CD4+/CD8+比值。③比较两组患者治疗前后生活质量评分。使用卡式功能状态评分(KPS)[6]与体力状况评分(ZPS)[7]评估患者治疗前后生活质量,其中KPS评分分值为0~100分,得分越高代表患者健康状况越好;ZPS评分分值为0~5分,得分越低代表患者体力状况越好。④不良反应。记录并对比两组患者治疗期间不良反应发生情况,包括骨髓抑制不良、白细胞减少及血小板减少等。
1.4 统计学方法 应用SPSS 23.0统计软件分析数据,计数资料以[ 例(%)]表示,行χ2检验;计量资料以(±s)表示,行t检验。以P< 0.05为差异有统计学意义。
2 结果
2.1 临床疗效 治疗后,研究组患者客观缓解率显著高于对照组,差异有统计学意义(P< 0.05),见表1。
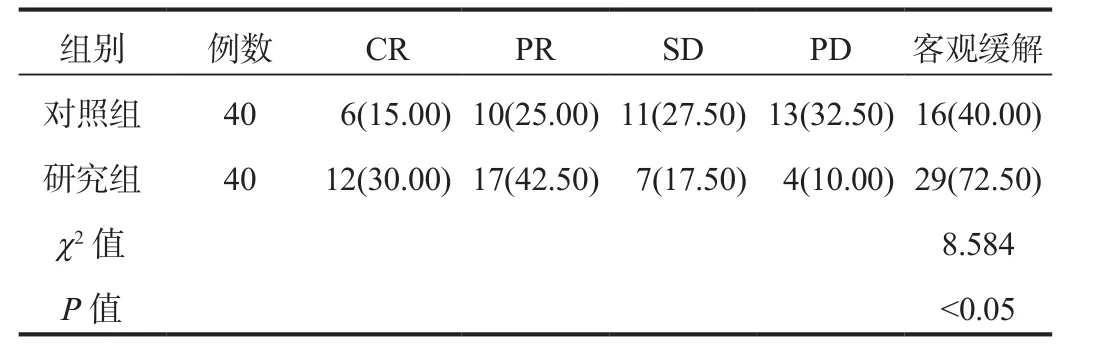
表1 两组患者临床疗效比较[ 例(%)]
2.2 T淋巴细胞亚群水平 与治疗前比,治疗后两组患者CD4+百分比、CD4+/CD8+比值均显著降低,但研究组显著高于对照组;两组患者CD8+百分比均显著升高,但研究组显著低于对照组,差异均有统计学意义(均P< 0.05),见表 2。
表2 两组患者T淋巴细胞亚群水平比较( ±s)

表2 两组患者T淋巴细胞亚群水平比较( ±s)
注:与治疗前比,*P<0.05。
组别 例数 CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 40 39.28±4.67 31.54±5.05* 34.87±4.28 42.51±4.31* 1.12±0.41 0.74±0.12*研究组 40 39.46±4.18 35.35±4.79* 34.05±4.73 38.09±4.13* 1.15±0.35 0.93±0.14*t值 0.182 3.462 0.813 4.683 0.352 6.517 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 生活质量 与治疗前比,治疗后两组患者KPS评分均显著升高,且研究组显著高于对照组;两组患者ZPS评分均显著降低,且研究组显著低于对照组,差异均有统计学意义(均P< 0.05),见表3。
表3 两组患者生活质量评分比较( ±s ,分)
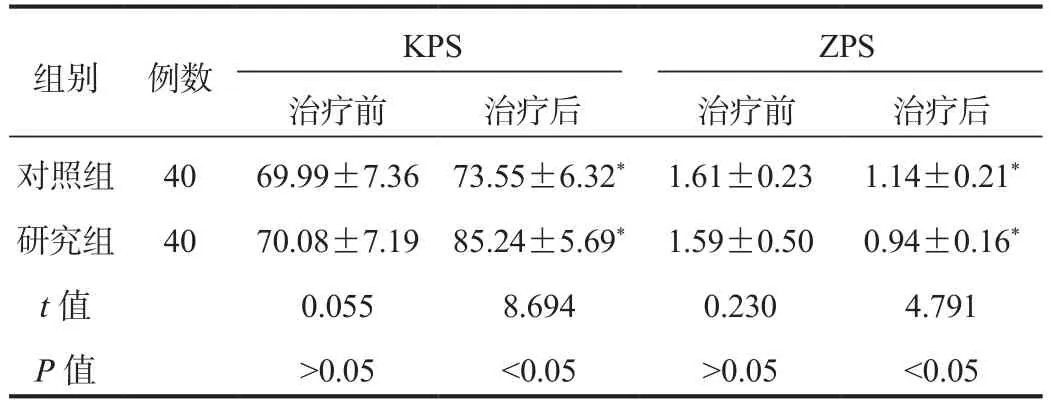
表3 两组患者生活质量评分比较( ±s ,分)
注:与治疗前比,*P < 0.05。KPS:卡式功能状态评分;ZPS:体力状况评分。
组别 例数 KPS ZPS治疗前 治疗后 治疗前 治疗后对照组 40 69.99±7.36 73.55±6.32* 1.61±0.23 1.14±0.21*研究组 40 70.08±7.19 85.24±5.69* 1.59±0.50 0.94±0.16*t值 0.055 8.694 0.230 4.791 P值 >0.05 <0.05 >0.05 <0.05
2.4 不良反应 治疗期间,两组患者骨髓抑制不良、白细胞减少及血小板减少等不良反应发生率相比,差异均无统计学意义(均P> 0.05),见表4。
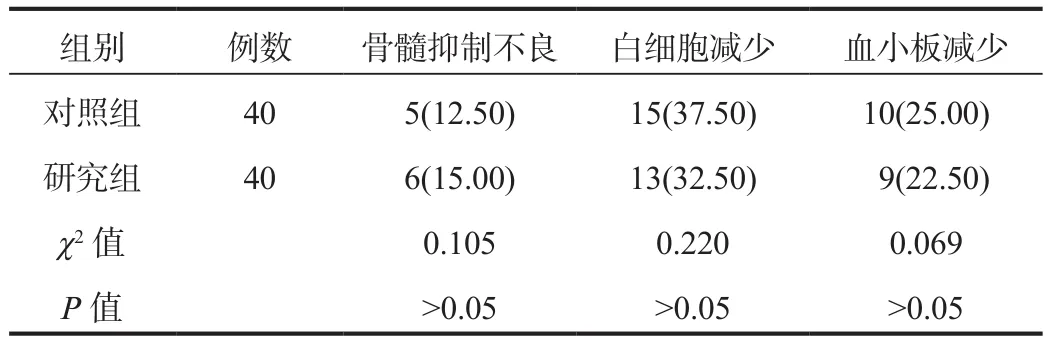
表4 两组患者不良反应发生情况比较[ 例(%)]
3 讨论
结直肠癌指来源于大肠上皮的癌症疾病,与患者的饮食习惯、遗传、环境、运动锻炼、慢性病变等多种因素有关,且晚期患者生存时间较短。卡培他滨是胃肠道肿瘤常用化疗药物,多见于结肠癌与乳腺癌的临床一线治疗,该药口服后经胃肠道吸收,到达结直肠癌肿瘤时经胸苷磷酸化酶催化为氟尿嘧啶,对癌细胞具有高度选择性与特异性,且能有效干扰蛋白质合成过程,抑制肿瘤生长[8]。但卡培他滨转化而来的氟尿嘧啶相对来说细胞毒性较大,可对患者肝肾功能造成一定损害,降低其白细胞及血小板水平,且长期服用患者易出现不同程度的胃肠道刺激、皮肤黏膜改变等不良反应[9]。
奥沙利铂属铂类衍生常用化疗药物,较顺铂毒性更小,临床多与氟尿嘧啶类药物联合使用,为胃肠道恶性肿瘤常用化疗方案,其内含铂原子,以DNA为靶作用部位,可与癌细胞DNA形成交叉联结,破坏DNA复制过程,杀伤结直肠癌机体内肿瘤细胞,且效果较为理想[10]。本研究结果显示,治疗后,研究组患者客观缓解率、KPS评分均显著高于对照组,ZPS评分显著低于对照组,且治疗期间,两组患者骨髓抑制不良、白细胞减少及血小板减少等不良反应发生率相比,差异无统计学意义,表明奥沙利铂联合卡培他滨可有效提高晚期结直肠癌患者临床治疗效果,使得患者生活质量得到有效提升,且不增加患者不良反应发生。
相关研究显示,免疫功能可参与结直肠癌病情发生、发展的全过程,其中CD4+作为细胞免疫功能指标,能有效反映机体免疫能力,其水平降低代表结直肠癌患者免疫力下降,病情进一步发展。CD8+作为T淋巴细胞毒性细胞抗原,能有效杀伤病毒感染细胞与肿瘤细胞,该水平升高代表结直肠癌患者病情加重。CD4+/CD8+比值作为免疫调节的一项敏感指标,其水平降低可代表结直肠癌患者细胞免疫功能紊乱[11]。本研究结果显示,与治疗前比,治疗后CD4+百分比、CD4+/CD8+比值均降低,CD8+百分比升高,而研究组患者CD4+百分比、CD4+/CD8+比值均显著高于对照组,CD8+百分比显著低于对照组,表明奥沙利铂联合卡培他滨能有效增强结直肠癌患者免疫功能,利于病情恢复。分析其原因可能为:治疗期间,化疗药物在抑制癌细胞生长的同时也会对免疫细胞产生危害,进而导致患者免疫力下降;而奥沙利铂联合卡培他滨通过抑制肿瘤细胞的增殖,加速T淋巴细胞形成的作用,减轻化疗对免疫功能的损伤程度,进而改善患者的免疫功能[12]。
综上,奥沙利铂联合卡培他滨能有效减轻结直肠癌患者临床症状,改善免疫能力,提高生活质量,且不增加患者不良反应发生,较单一使用卡培他滨疗效更佳,值得临床推广与应用。
