育龄期女性乳腺癌中TIPE2 的表达与VEGF、增殖能力的相关性分析
2021-11-18赵志廉陆玲玲菅凤国付振鹏刘明海
赵志廉,陆玲玲,郭 曼,菅凤国,付振鹏,刘明海
(昌邑市妇幼保健院病理科1,妇产科2,超声科3,外科4,山东 昌邑 261300)
乳腺癌(breast cancer)是激素依赖性肿瘤,也是全球范围内女性患病率最高的恶性肿瘤[1]。乳腺癌的发病率逐年升高,严重威胁中国女性的生命健康。乳腺癌是育龄期女性癌症导致死亡的首要原因[2]。育龄期女性由于其特殊的性质,乳腺癌可严重影响其身心健康。目前乳腺癌的治疗仍存在诸多问题,尤其对于妊娠期合并乳腺癌的治疗,需要多学科联合进行[3]。近半个世纪以来,世界各国的多项研究已证实,乳腺癌筛查是提高早期诊断率、患者生存率及生存质量的最为有效的方法。世界卫生组织已明确将早期乳腺癌列为可治愈性疾病,早期诊断早期治疗是提高乳腺癌治愈率的最佳途径[1]。寻找用于乳腺癌早期诊断和评估预后的新的临床指标是癌症研究的难题和热点。肿瘤坏死因子-α-诱导蛋白8(TNFAIP8)家族又称为TIPE 家族,包括TIPE、TIPE1、TIPE2 和TIPE3。人正常的TIPE2 可以表达于多种免疫细胞,参与免疫反应的调节。它也表达于多种非免疫细胞中,包括脑的神经元细胞、肝细胞、食管鳞状上皮细胞等[4],这提示TIPE2 不仅参与免疫调节,还有其他的功能。研究指出[5-8],TIPE2 在恶性肿瘤中出现异常表达。在乳腺癌、食管癌、胃癌、直肠腺癌等研究中发现,TIPE2 在癌组织中明显低表达。TIPE2 在上述肿瘤的生长过程中可能抑制肿瘤的发生,并且与肿瘤的侵袭性、转移等恶性生物学行为呈负相关。本实验通过免疫组织化学方法检测育龄期女性乳腺癌组织中TIPE2、VEGF、β-catenin、cyclinD1 的表达情况,并分析TIPE2、VEGF、βcatenin、cyclinD1 和各临床病理参数之间的意义及TIPE2与VEGF、β-catenin、cyclinD1 之间的相关性,进一步探讨TIPE2 在育龄期女性乳腺癌发生发展过程中的机制。
1 材料与方法
1.1 材料来源 选取2012 年1 月-2017 年8 月昌邑市妇幼保健院病理科术前未行任何治疗的乳腺浸润性导管癌标本100例作为为实验组,均为育龄期女性,年龄23~47岁,平均年龄(37.50±6.25)岁。术后常规病理诊断为浸润性导管癌。同时随机选取30例实验组距离癌旁1 cm 的正常乳腺组织作为对照组。100例标本中,年龄≥37岁63例,<37岁37例。不伴有淋巴结转移者62例,伴有淋巴结转移者38例;浸润性导管癌Ⅰ级9例,浸润性导管癌Ⅱ、Ⅲ级91例;同时按照TNM分期标准进行分期,Ⅰ~Ⅱ期65例,Ⅲ~Ⅳ期35例。Ki-67 高表达者58例,Ki-67低表达者42例。ER 高表达者66例,ER 低表达者34例。PR 高表达者59例,PR 低表达者41例。Her-2 高表达者36例,HER-2 低表达者64例。肿瘤>2 cm 者32例,≤2 cm 者68例。
1.2 免疫组化染色 所有切除的标本采用福尔马林固定。TIPE2、VEGF、β-catenin、cyclinD1 兔抗人多克隆抗体(工作浓度1∶50),均买自武汉三鹰生物科技有限公司。即用型ER、PR、HER-2、Ki-67 抗体买自福建迈新生物技术有限公司。所有乳腺癌蜡块标本均经两位病理医师独立确诊。常规石蜡4 μm 切片,免疫组织组织化学方法采用SP 法。切片在70 ℃烤箱中烤2 h,经过二甲苯、无水乙醇、梯度酒精、蒸馏水进行脱蜡水化,柠檬酸pH=6.0 高温高压修复4 min,然后滴上适当剂量的一抗工作液,放入湿盒中,并放于4 ℃冰箱过夜。经PBS 溶液冲洗3 min,共3 次。加入二抗,37 ℃孵育30 min。滴加适量结合有辣根过氧化物酶的生物素试剂,然后用PBS 溶液冲洗。DAB 显色,蒸馏水充分冲洗,苏木素染细胞核1 min左右,蒸馏水冲洗,PBS 返蓝。用PBS 液替代一抗作为阴性对照。
1.3 观察指标 比较不同年龄、TNM分期、浸润程度、肿块大小、Ki-67、ER、PR、HER-2 阳性表达患者的TIPE2、VEGF、β-catenin 和cyclinD1 表达情况,分析乳腺癌组织中TIPE2 的表达与VEGF、β-catenin、cyclinD1 的相关性。
1.4 结果判定 依据美国临床肿瘤学会ASCO分级对TIPE2、VEGF、β -catenin、cyclinD1、ER、PR、HER -2、Ki-67 行结果判读。TIPE2、VEGF 阳性:呈棕黄色颗粒定位在细胞浆;ER、PR、Ki-67、cyclinD1 阳性:呈棕黄色颗粒定位在细胞核;HER-2、β-catenin 阳性:呈棕黄色颗粒定位在细胞膜。根据染色阳性的肿瘤细胞面积<5%、5%~25%、26%~50%、51%~75%、>75%,分别计数为0、1、2、3、4分。根据肿瘤细胞着色强度分别标记为-、+、++、+++,对应计数为0、1、2、3分。得到的两组数值相乘,<8分判读为低表达,≥8分判读为高表达。
1.5 统计学分析 数据采用SPSS 16.0 软件处理,计量资料采用(±s)表示,组间比较行t检验;计数资料采用[n(%)]表示,行χ2检验,相关性采用Spearman相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 TIPE2、VEGF、β-catenin、cyclinD1 在乳腺癌中的表达 乳腺浸润性导管癌在显微镜下呈异常的导管癌细胞在纤维间质中浸润性生长,排列成腺样结构或实体团块。TIPE2、VEGF 阳性:呈棕黄色颗粒定位在乳腺癌细胞的细胞浆;ER、PR、Ki-67、cyclinD1 阳性:呈棕黄色颗粒定位在乳腺癌细胞的细胞核;HER-2、β-catenin 阳性:呈棕黄色颗粒定位在乳腺癌细胞的细胞膜。TIPE2 在乳育龄期女性腺癌组织中呈低表达,VEGF、β-catenin、cyclinD1 在育龄期女性乳腺癌组织中呈高表达,见图1。

图1 正常乳腺组织及乳腺癌免疫组化表达(×400)
2.2 TIPE2、VEGF、β-catenin、cyclinD1与临床病理参数间的关系 TIPE2 在乳腺癌组织中呈低表达,低于正常乳腺组织,差异有统计学意义(P<0.05);VEGF、β-catenin、cyclinD1 在乳腺癌组织中呈高表达,高于正常乳腺组织,差异有统计学意义(P<0.05)。TIPE2、VEGF、β-catenin、cyclinD1 在乳腺癌组织中的表达分别与肿瘤TNM分期、淋巴结转移、组织学分级、Ki-67 指数高相关(P<0.05),但与ER、PR、HER-2的表达、肿瘤大小、年龄无关(P>0.05),见表1。

表1 乳腺癌中TIPE2 表达与临床病理参数的关系(n)
2.3 TIPE2、VEGF、β-catenin、cyclinD1 间的相关性TIPE2 的表达分别与VEGF(r=-0.326,P<0.001)、β-catenin(r=-0.208,P=0.019)、cyclinD1(r=-0.295,P=0.002)的表达呈负相关。VEGF 的表达分别与β-catenin(r=0.349,P<0.001)、cyclinD1(r=0.298,P=0.001)的表达呈正相关,β-catenin 的表达与cyclinD1(r=0.285,P=0.002)的表达呈正相关,见图2。
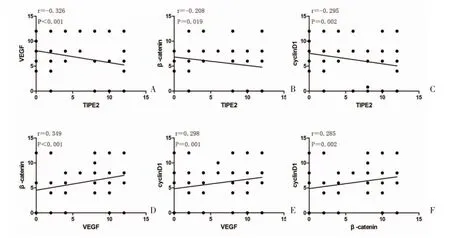
图2 TIPE2、VEGF、β-catenin、cyclinD1 之间的相关性
3 讨论
根据世界卫生组织的统计,我国女性乳腺癌发病率和死亡率在全球处于比较低的水平,但近年来呈迅速增长的趋势,尤其是农村地区近10 年来上升趋势明显。育龄期乳腺癌在我国农村发病率较高,早期缺乏明显症状,易被漏诊,治疗效果较差[9]。乳腺癌的早期发现和早期治疗是当今医学界研究的重点。
TIPE2 约21 kDa,是一种新发现的与caspase-8结合的天然免疫和适应性免疫的负性免疫调节因子。TIPE2 在免疫组织和非免疫组织中均有表达,与caspase-8 的结合可抑制活化蛋白-1(AP-1)和核因子-κB(NF-κB)的活性,最终促进Fas 诱导的免疫细胞凋亡,从而参与机体的免疫稳态[10]。在感染性和自身免疫性疾病患者中,TIPE2 显著下调,TIPE2 的缺失导致严重的炎症疾病。近年来,越来越多的证据表明TIPE2 是一种理想的生物标志物,在多种肿瘤类型中起到抑瘤作用[11]。TIPE2 的低表达与多种上皮源性恶性肿瘤预后不良有关,包括结直肠癌、食管鳞状细胞癌、胃癌、肺癌[5-8]。由此可见,TIPE2 在癌症中作为一个抑癌基因抑制肿瘤的发生发展,并可能作为评估预后的独立指标。本实验通过免疫组织化学方法结果进一步证明,TIPE2 在育龄期女性乳腺癌组织中呈现低表达,可能参与抑癌癌症发展的过程。
对于TIPE2 在肿瘤中的作用机制,近年也有深入的研究。Wnt 信号通路在细胞的分化、增殖和凋亡等生理过程中,以及在细胞癌变、肿瘤侵袭等病理过程中均发挥了重要的调控作用。β-catenin 介导的信号通路是Wnt 信号传导通路中的经典信号通路,当Wnt 信号途径被激活时,β-catenin 由于细胞分泌的Wnt 蛋白增多,影响β-catenin 的降解,大量沉积在胞质中,后进入细胞核并与TCF 因子结合,从而促进Wnt 靶基因的表达,如c-Myc 和cyclinD1。CyclinD1 是β-catenin 重要的下游靶基因[12]。TIPE2 可能通过Wnt/β-catenin 信号通路促进人直肠腺癌细胞凋亡[8]。磷酯酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)是调节细胞生存和增殖的重要因子。Akt/PKB 是一种丝氨酸/苏氨酸蛋白激酶,作为PI3 激酶的下游调节因子,是目前公认的调节细胞细胞凋亡重要的途径。TIPE2 过表达可通过抑制PI3K/Akt 信号通路抑制前列腺癌细胞的增殖,迁移和侵袭[13]。
血管内皮生长因子(VEGF)是一种分子量约为45 kDa 的同二聚糖蛋白,是新生血管生成的关键介质。VEGF 是肿瘤血管生成的关键介质,其表达受癌基因表达、多种生长因子及缺氧等因素的上调。血管生成对癌症的发展和生长至关重要,VEGF 作用下形成的肿瘤血管在结构和功能上都有异常,如血管形状不规则,弯曲,有盲端,不形成小静脉、小动脉和毛细血管,也有渗漏和出血,导致间质高压。这些特点意味着肿瘤血流不理想,导致缺氧,进一步产生VEGF。VEGF 在肿瘤血管生成中的中心作用使其成为抗肿瘤治疗的合理靶点[14-16]。特异性短干扰RNA敲除TIPE2 可提高TNF-α、IL-1β 和VEGF 的表达水平,特别是在脂多糖刺激下。考虑到血管内皮生长因子在新生血管最后阶段的重要作用,抗炎TIPE2也具有抗血管生成作用[17]。在肺癌的发生发展研究机制中发现[18],TIPE2 通过抑制Rac1 的激活,进而减弱其下游效应,包括F-actin 聚合和VEGF 表达,从而抑制肿瘤的侵袭性和血管生成。
本实验发现,TIPE2 在育龄期女性乳腺癌组织中的表达低于周围正常乳腺组织,而VEGF、βcatenin、cyclinD1 在育龄期女性乳腺癌组织中的表达高于周围正常乳腺组织。同时,TIPE2、VEGF、βcatenin、cyclinD1 的异常表达与乳腺癌的组织分级、TNM分期、Ki-67 高表达临床病理参数相关,表明TIPE2、VEGF、β-catenin、cyclinD1 在一定程度上作用于乳腺癌的发生发展。相关性分析显示,乳腺癌中TIPE2 的表达分别与VEGF、β-catenin、cyclinD1的表达呈负相关,VEGF与β-catenin、cyclinD1 的表达呈正相关,而β-catenin 的表达与cyclinD1 的表达也呈正相关。这说明TIPE2 在乳腺癌中的作用机制与VEGF、β-catenin 和cyclinD1 的表达相关,可以推断KPNA2 通过Wnt 通路和VEGF 介导的血管形成作用于乳腺癌的侵袭发展过程。
乳腺癌现在的治疗主要通过传统的手术、放疗、化疗、内分泌治疗。这对于育龄期女性的身心健康影响重大。如能及时发现并确诊,并给予合理的治疗,可提高育龄期乳腺癌患者的生存率及生存质量[19,20],因此需要进一步寻找新的用于临床治疗的基因靶点。
综上所述,在育龄期女性乳腺浸润性导管癌中,TIPE2 的低表达与多种临床病理特征相关,TIPE2可能成为一个重要的靶点分子,通过Wnt 通路和VEGF 介导的血管形成过程从而影响乳腺癌的侵袭发展。但Wnt 通路如何调控VEGF 的作用,还需要进一步研究。后续研究方向是通过更复杂的体内外实验明确TIPE2 在乳腺癌中与Wnt 通路和VEGF之间的作用机制,构建TIPE2 参与细胞信号通路的模型,利于对育龄期女性乳腺癌的评估和临床治疗提供新的研究方向。
