miR-122 在糖尿病肾病小鼠肾组织中表达变化及作用机制
2021-11-17樊东哲张晓斌牟淑敏
樊东哲,张晓斌,牟淑敏
(1.山东中医药大学第二附属医院肾病诊疗中心,济南 250000;2.山东中医药大学附属医院内分泌科,济南 250000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症之一,是世界范围内导致终末期肾疾病的主要原因,其发病率逐年上升,严重危害人类的健康[1]。 在中国,DN 已经成为我国公共卫生的主要问题之一,给个人、家庭和社会带来了巨大的负担。 肾小球肥大增生、基底膜增厚、细胞外基质增多是DN 的病理特征,随着DN 的进展,逐渐发展为肾小球硬化、间质纤维化,导致肾功能的丧失。 DN 的发生发展机制复杂,目前尚未完全阐明,并且目前尚无有效的治疗方法。
目前随着研究的深入,微小RNA(miRNAs)被发现对包括糖尿病肾病在内的多种疾病的发生发展均有着重要的调控作用[2-3]。 miR-122 定位于人染色体18q21.31 上,在肝中高表达,与精子发生、肝细胞发育、脂质代谢、胆固醇合成以及恶性肿瘤的发生关系密切[4]。 近期研究发现 DN 患者血清miR-122 水平明显升高,并且血清miR-122 水平与蛋白尿、肾小球滤过率显著相关,提示miR-122 可能参与了DN 的发生进展,但具体作用机制尚不明确[5]。 因此,本研究中,我们通过建立 DN 小鼠模型,观察miR-122 在DN 小鼠肾组织的表达变化,并进一步观察沉默miR-122 对DN 小鼠肾组织的影响及可能的机制。
1 材料和方法
1.1 实验动物
健康雄性SPF 级C57BL/6 小鼠50 只,鼠龄8~9 周,体重(24.5±1.6)g,购自山东斯科贝斯生物科技公司[SCXK(鲁)2016-0001],在山东中医药大学附属医院实验动物中心屏障环境[SYXK(鲁)2018-0015]常规饲养。 本研究经本院伦理委员会批准(IACUC2019081501),所有操作均符合动物实验学“3R”原则。
1.2 主要试剂与仪器
链脲佐菌素(STZ)(美国 Sigma 公司,批号:S0130);TRIzol 试剂(美国 Invitrogen 公司,批号:15596018);反转录试剂盒、qRT-PCR 试剂盒(北京全式金生物公司,批号:AH341-01、AQ321-01);过碘酸雪夫(PAS)染色试剂盒(北京索莱宝公司,批号:G1280);antagomir-122、antagomir-NC(上海吉玛制药公司);谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒(南京建成生物公司,批号:A005-1-1、A003-1-2、A001-3-1);一抗 Sirt1、fibronectin、GAPDH 抗体(英国 Abcam 公司,批号:ab189494、ab268021、ab8245);一抗α-SMA、HPR 标记的二抗 (武汉博士德公司,批号:BM0002、BA1050)。
1.3 实验方法
1.3.1 DN 模型制备及动物分组
50 只C57BL/6 小鼠适应性喂养1 周后,随机选取40 只小鼠采用STZ 腹腔注射联合高糖高脂饮食建立DN 小鼠模型,剩余10 只小鼠作为正常对照组。 建立DN 模型的小鼠首先给予高脂高糖饲料喂养8 周,给予STZ(30 mg/kg)单次腹腔注射一次后,继续给予高脂高糖饲料喂养4 周后,选取空腹血糖(FPG)≥16.7 mmol/L,24 h 尿蛋白定量≥20 mg 的小鼠作为DN 模型小鼠[6-7],最终成功造模30 只。正常对照组给予正常饲料常规喂养,给予腹腔单次注射等量的柠檬酸缓冲液。 将30 只DN 小鼠随机分成分为模型组、antagomir-NC 组、antagomir-122组,每组 10 只。 antagomir-122 组和 antagomir-NC 组造模后,每7 d 分别给予尾静脉注射antagomir-122(30 mg/kg)和antagomir-NC(30 mg/kg)进行干预,模型组和正常对照组给予尾静脉注射等量生理盐水代替。 干预8 周后,取得小鼠血、24 h 尿液后处死小鼠,获取肾标本。
1.3.2 肾功能检测
取小鼠血,3000 r/min 离心15 min 取得上层血清,使用全自动生化分析仪检测小鼠血清尿素氮(BUN)和肌酐(Cr)水平;取小鼠24 h 尿液,全自动生化分析仪检测小鼠24 h 尿蛋白定量。
1.3.3 组织病理学分析
小鼠处死后,取出左肾,应用10%中性甲醛固定,经石蜡包埋后,连续切4 μm 切片,应用PAS 试剂盒进行染色,光学显微镜下观察肾组织病理学改变,每张切片随机选取5 个不同视野,参考文献的方法进行肾小球硬化评分[8]。
1.3.4 qRT-PCR 检测肾组织中 miR-122 的表达水平
取小鼠部分右肾皮质组织,TRIzol 试剂提肾皮质组织总RNA,鉴定总RNA 浓度和纯度后,应用反转录试剂盒反转录合成cDNA。 按照qRT-PCR 试剂盒说明书配置扩增反应体系,miR-122 引物序列,正向:5’-GGGTGGAGTGTGACAATGG-3’,反向:5’-TGCGTGTCGTGGAGTC-3’,以 U6 作为内参照,引物序列, 正 向: 5’-GCTTCGGCAGCACATATACTAAA AT-3’,反向:5’-CGCTTCACGAATTTGCGTGTCAT-3’。 反应条件:95℃ 30 s,60℃ 20 s,72℃ 20 s,共40 个循环。 miR-122 表达水平用 2-△△Ct法表示。
1.3.5 Western blot 检测肾组织 Sirt1、α-SMA、fibronectin 蛋白的表达水平
小鼠处死后,取部分右肾皮质组织,RIPA 裂解液裂解组织,提取组织总蛋白,Bradford 法测得总蛋白浓度,取得 30 μg 蛋白样本,行 10% SDS-PAGE 凝胶电泳,转至PVDF 膜,室内封膜1 h,分别加入一抗Sirt1(稀释度 1 ∶1000)、α-SMA(稀释度 1 ∶2000)、fibronectin(稀释度 1 ∶1000)和 GAPDH(稀释度 1 ∶5000)抗体,4℃孵育过夜,加入二抗后,37℃孵育1 h,曝光,显影,最后使用Image-J 软件分析各组蛋白的条带灰度值。
1.3.6 氧化应激水平检测
小鼠处死后,取部分右肾皮质组织,裂解匀浆后测定蛋白浓度,分别应用 GSH-Px、MDA、SOD 试剂盒参照说明书操作,检测各组小鼠肾组织GSHPx、MDA、SOD 的水平。
1.4 统计学方法
SPSS 20.0 进行统计分析,计量数据以平均数±标准差()表示,组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠肾功能的比较
与正常对照组比较,模型组小鼠血清Cr、BUN水平及24 h 尿蛋白定量水平均明显增高(P<0.05);模型组与antagomir-NC 组比较,各项指标差异无统计学意义(P>0.05);与antagomir-NC 组比较,antagomir-122 组小鼠血清 Cr、BUN 水平及 24 h尿蛋白定量水平均明显降低(P<0.05)。 见图1。
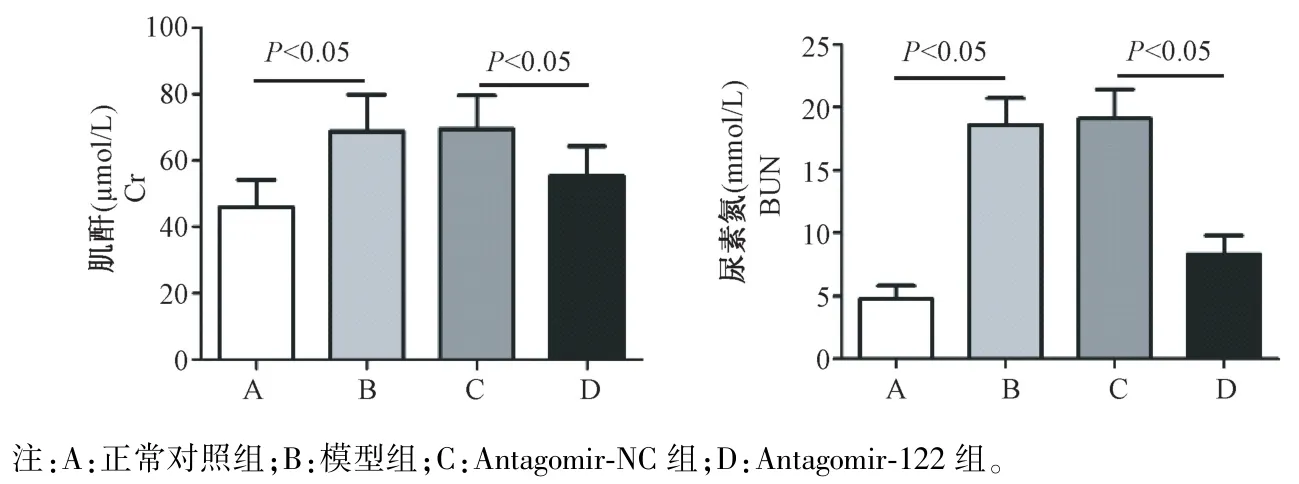
图1 各组小鼠肾功能的比较Note. A, Normal control group. B, Model group. C, Antagomir-NC group. D, Antagomir-122 group.Figure 1 Comparison of renal function in each group
2.2 各组小鼠肾小球硬化的比较
与正常对照组比较,模型组小鼠肾小球硬化评分明显增高(P<0.05);模型组与antagomir-NC 组比较,差异无统计学意义(P>0.05);与antagomir-NC组比较,antagomir-122 组小鼠肾小球硬化评分明显降低(P<0.05)。 见图 2。
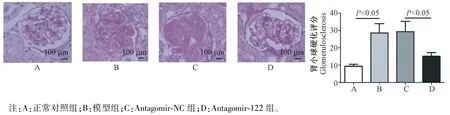
图2 各组小鼠肾小球硬化的比较Note. A, Normal control group. B, Model group. C, Antagomir-NC group. D, Antagomir-122 group.Figure 2 Comparison of glomerulosclerosis in each group
2.3 各组小鼠肾组织miR-122 和Sirt1 蛋白表达的比较
与正常对照组比较,模型组小鼠肾组织miR-122 的表达水平明显增高(P<0.05),而Sirt1 蛋白的表达水平明显降低(P<0.05);模型组与antagomir-NC 组比较,各项指标差异无统计学意义(P>0.05);与antagomir-NC 组比较,antagomir-122 组小鼠肾组织miR-122 的表达水平明显降低(P<0.05),而Sirt1蛋白的表达水平明显升高(P<0.05)。 见图3。
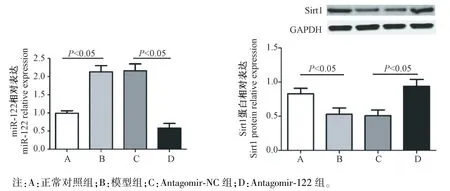
图3 各组小鼠肾组织miR-122 和Sirt1 蛋白表达的比较Note. A, Normal control group. B, Model group. C, Antagomir-NC group. D, Antagomir-122 group.Figure 3 Comparison of miR-122 and Sirt1 protein expression in renal tissue of mice in each group
2.4 各组小鼠肾组织氧化应激水平的比较
与正常对照组比较,模型组小鼠肾组织MDA水平明显增高(P<0.05),而GSH-Px 和SOD 水平明显降低(P<0.05);模型组与antagomir-NC 比较,各项指标差异无统计学意义(P>0.05);与antagomir-NC 组比较,antagomir-122 组小鼠肾组织MDA 水平明显降低(P<0.05),而GSH-Px 和SOD 水平均明显升高(P<0.05)。 见图 4。
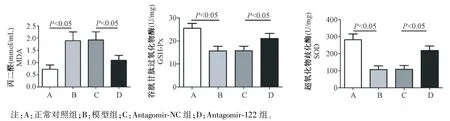
图4 各组小鼠肾组织氧化应激水平的比较Note. A, Normal control group. B, Model group. C, Antagomir-NC group. D, Antagomir-122 group.Figure 4 Comparison of oxidative stress levels in kidney of mice in each group
2.5 各组小鼠肾组织α-SMA、fibronectin 蛋白表达水平的比较
与正常对照组比较,模型组小鼠肾组织α-SMA、fibronectin 蛋白表达水平均明显增高(P<0.05);模型组与antagomir-NC 组比较,各项指标差异无统计学意义(P>0.05);与antagomir-NC 组比较,antagomir-122 组小鼠肾组织 α-SMA、fibronectin蛋白表达水平明显降低(P<0.05)。 见图5。
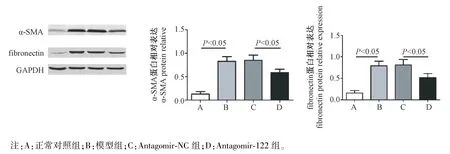
图5 各组小鼠肾组织α-SMA、fibronectin 蛋白表达水平的比较Note. A, Normal control group. B, Model group. C, Antagomir-NC group. D, Antagomir-122 group.Figure 5 Comparison of the expression levels of α-SMA and fibronectin in renal tissues of mice in each group
3 讨论
DN 是糖尿病患者晚期的一个主要并发症,以肾小球硬化和肾小管间质纤维化为主要病理特点,据研究报道,至少大约1/3 的1 型糖尿病和1/2 的2型糖尿病会出现不同程度的肾功能不全,是终末期肾疾病的主要原因[9]。 DN 发生发展进展复杂,涉及多种基因的异常表达和多种信号通路的异常改变,至今尚不完全明确[10]。 研究证据表明,miR-31[11]、miR-124a[12]、miR-320a[13]等许多 miRNA 在DN 中异常表达,这些异常表达的miRNAs 及其靶基因在DN 发病机制中起着重要作用[14],为DN 的靶向治疗提供了新的研究方向。 文献报道miR-122 在DN 患者血清中表达升高,并且患者肾功能密切相关[5],但具体作用机制尚不清楚。 为了研究miR-122 在DN 中可能的作用机制,本研究采用目前国内外常用的STZ 腹腔注射联合高糖高脂饮食的方法建立小鼠DN 模型,我们发现模型组小鼠肾组织中miR-122 表达水平较正常对照组明显升高。 我们通过给予小鼠尾静脉注射antagomir-122,抑制DN 小鼠肾组织中miR-122 的表达,结果显示,随着DN 小鼠肾组织中miR-122 表达的降低,antagomir-122 组小鼠肾小球硬化评分、血清 Cr、BUN 水平、24 h 尿蛋白定量水平明显降低,提示沉默miR-122 表达能够对DN 小鼠肾组织起到明显的保护作用。
氧化应激是病理状态下机体的抗氧化系统被抑制,过量的ROS 聚积而无法及时清除,导致脂质过氧化和蛋白质变性,从而导致炎症反应、肾小球肥大硬化和肾纤维化。 氧化应激是DN 的发病发展的重要机制之一,抗氧化治疗在DN 的防治中有着广泛的前景[15-16]。 MDA 是组织细胞过氧化损伤过程中的中间产物,可以反映出细胞的氧化损伤程度,MDA 水平检测可以有效反应机体的氧化应激水平[17]。 GSH-Px 和SOD 是氧化应激反应中重要抗氧化酶,其水平可以反应出细胞对氧自由基的清除能力[18]。 研究中我们也发现,与正常对照组比较,模型组肾组织MDA 水平明显增高,GSH-Px 和SOD水平明显降低,提示氧化应激在DN 发生进展中发挥重要作用。 进一步我们发现,与antagomir-NC 组比较,antagomir-122 组小鼠肾组织MDA 水平明显降低,肾组织GSH-Px 和SOD 水平明显升高,提示沉默miR-122 表达能够减轻DN 小鼠肾组织的氧化应激从而起到保护作用。 α-SMA、fibronectin 蛋白异常增高是反应肾纤维化程度的标志性蛋白[19],研究中我们发现,与正常对照组比较,模型组小鼠肾组织α-SMA、fibronectin 蛋白表达水平均明显增高,提示DN 小鼠肾组织存在明显纤维化。 进一步我们发现,与antagomir-NC 组比较,antagomir-122 组小鼠肾组织α-SMA、fibronectin 蛋白表达水平均明显降低,提示沉默miR-122 表达能够减轻DN 小鼠肾组织的纤维化。
Sirt1 是一种依赖于烟酰胺腺嘌呤二核苷酸的去乙酰化酶,属于Sirtunis 家族之一,在肾小管上皮细胞中表达较高[20]。 Sirt1 在DN 发生进展中作用的研究较多,Sirt1 能够通过抗氧化应激、抗纤维化、抗炎及调控自噬从而对DN 的产生保护作用已经得到公认[21]。 本研究中我们也发现,与正常对照组比较,模型组小鼠肾组织Sirt1 蛋白表达水平明显降低。 近期研究发现,miR-122 能够靶向调控Sirt1 参与机体多种重要的生理活动[22-23],为了探讨miR-122 对DN 影响是否与Sirt1 有关,我们通过研究发现,与antagomir-NC 组比较,antagomir-122 组小鼠肾组织Sirt1 蛋白表达水平明显升高,提示沉默miR-122 表达对DN 小鼠肾组织的保护作用可能与其对Sirt1 的调控有关。
总之,miR-122 在DN 小鼠肾组织中表达升高。沉默miR-122 能够通过抗氧化应激和纤维化对DN小鼠肾组织起到明显的保护作用,其机制可能与其调控Sirt1 有关,为DN 的治疗提供新的研究方向。
