关于黄褐斑动物模型的复制与思考
2021-11-17刘逍遥范琼尹苏泽琦张晶璇赵保胜朱佩轩
刘逍遥,范琼尹,高 健,苏泽琦,3,张晶璇,赵保胜,朱佩轩,王 停,3*
(1.北京中医药大学中医学院,北京 100029;2.北京中医药大学北京中医药研究院,北京 100029;3.国家中医药管理局名医名方重点研究室,北京 100029)
黄褐斑是一种获得性黑色素沉着性皮肤病,常见于中青年女性,以面部淡褐色至深褐色界限清楚的斑片为主要临床表现[1]。 因其多发于面部,严重影响患者容貌、心理和社交,已经成为女性身心健康的一大杀手[2]。 黄褐斑病因病机复杂,确切发病机制尚不清楚,且其临床研究有一定的局限性,因此通过模拟临床发病过程而建立黄褐斑动物模型是研究黄褐斑疾病的重要方法之一。
目前认为,黄褐斑可能与紫外线辐射、口服避孕药以及女性性激素水平变化等因素有关[3-5],根据“雌激素和黄体酮增多进而刺激黑色素细胞而致色素沉着”的发病假说以及“日光照射是黄褐斑发生发展的重要因素”等[6],常采用紫外线照射、肌内注射黄体酮注射液以及紫外线照射联合肌内注射黄体酮注射液的方法建立黄褐斑动物模型。 但在黄体酮注射剂量、紫外线照射参数以及动物品系的选择等方面尚存在一定的争议,使目前建立的动物模型方法种类较多,尚未建立统一的模型制备方法。 因此,本文通过采用肌内注射不同剂量黄体酮的方法建立SD 大鼠和KM 小鼠黄褐斑模型,以及通过紫外线照射和紫外线照射联合黄体酮的方法建立C57BL/6 小鼠黄褐斑模型,综合探讨造模方法、黄体酮注射剂量以及动物品种等因素对黄褐斑成模的影响,以期为研究黄褐斑的发病机制以及黄褐斑动物模型建立提供数据支持。
1 材料和方法
1.1 实验动物
健康雌性 SD 大鼠 20 只,SPF 级,体重(200±20)g,健康雌性 KM 小鼠 15 只,SPF 级,体重(20±2)g,均由北京维通利华生物技术有限公司提供[SCXK(京)2016-0011][SCXK(京)2016-0006];健康雌性C57BL/6 小鼠9 只,SPF 级,六周龄,体重(16~18)g,由北京斯贝福实验动物有限公司提供[SCXK(京)2019-0010]。 所有动物均饲养于北京中医药大学屏障环境动物饲养室[SYXK(京)2016-0038],室内温度20℃~25℃,相对湿度40%~60%,光照周期明暗各12 h,动物饲养期间可自由摄食和饮水,实验方案经北京中医药大学动物伦理委员会审查(BUCM-2019081901-3056),并按照实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
脱毛膏(广州宏莱生物科技有限公司,国妆特字G20160106);10%福尔马林中性组织固定液(南昌雨露实验器材有限公司,中国);电动宠物剃毛器(宁波神剑电器制造有限公司);黄体酮注射液(浙江仙琚制药有限公司,批号:181210);苏木素-伊红(HE)染色液(北京中杉金桥生物技术有限公司,批号:20200508);Masson-Fontana 黑色素染色液(北京雷根生物技术有限公司,货号:DJ0021-3*50ML);生理盐水(辰欣药业股份有限公司, 批号 1902180724); 多功能电子天平(BSA323S,德国 Satorius 公司);分体式包埋机(EG1150,德国Leica 公司);半自动轮转式切片机(RM2245,德国Leica 公司);病理图像采集系统(BX53-DP26,日本OLYMPUS 公司);光学显微镜(OlyPus BX4,中国上海赖氏电子科技有限公司);窄谱311 紫外线光疗仪(SH1B,上海希格玛高技术有限公司)。
1.3 实验方法
1.3.1 黄体酮注射剂量、动物品种对黄褐斑动物模型的影响
动物适应性饲养7 d 后,将20 只SD 大鼠按照体重随机分为4 组:正常组以及黄体酮高、中、低剂量造模组,每组5 只;15 只KM 小鼠按体重随机分为3 组:正常组以及黄体酮高、低剂量造模组,每组5 只。 于实验前24 h 将所有动物脊柱两侧及靠臀部皮肤用剃毛器脱毛后,用温和型脱毛膏脱毛,脱毛面积2 cm×2 cm。 脱毛后背部皮肤光洁正常、没有刺激性,之后每周脱毛1 次,以免影响观察。
SD 大鼠实验中黄体酮高、中、低剂量造模组分别在SD 大鼠后肢根部肌内注射黄体酮注射液25 mg/kg、15 mg/kg、7.5 mg/kg,每日一次,两后肢交替注射,连续注射30 d,正常组注射与高剂量黄体酮造模组等体积的生理盐水。 KM 小鼠实验中黄体酮高、低剂量造模组分别在KM 小鼠后肢根部肌内注射黄体酮注射液30 mg/kg 、20 mg/kg,每日一次,两后肢交替,连续30 d,正常组注射与黄体酮高剂量造模组等体积的生理盐水。 实验动物分组及造模剂量见表1。

表1 SD 大鼠、KM 小鼠实验动物分组与给药剂量表Table 1 Grouping and dosing scales of SD rats and KM mice
1.3.2 造模方法对黄褐斑动物模型的影响
动物适应性饲养7 d 后,将9 只 C57BL/6 小鼠按照体重随机分为正常组、紫外线造模组以及紫外线联合黄体酮造模组,每组3 只。 紫外线造模组与紫外线照射联合黄体酮造模组于实验第1、3、5、7、9、11、13、15、17、19、21 天下午 15 ∶00-17 ∶00 用紫外线光疗仪照射30 s,紫外线灯管距脱毛后的皮肤表面约为2 cm,紫外灯管辐照面积为11×2 cm2,正常组不做紫外干预。 照射紫外线30 min 前,紫外线联合黄体酮造模组在小鼠后肢根部肌内注射20 mg/kg 的黄体酮注射液,紫外线造模组和正常组注射等体积生理盐水,每天一次,共21 d。 实验分组、黄体酮注射剂量以及紫外线照射剂量见表2,紫外线照射时间安排见图1。
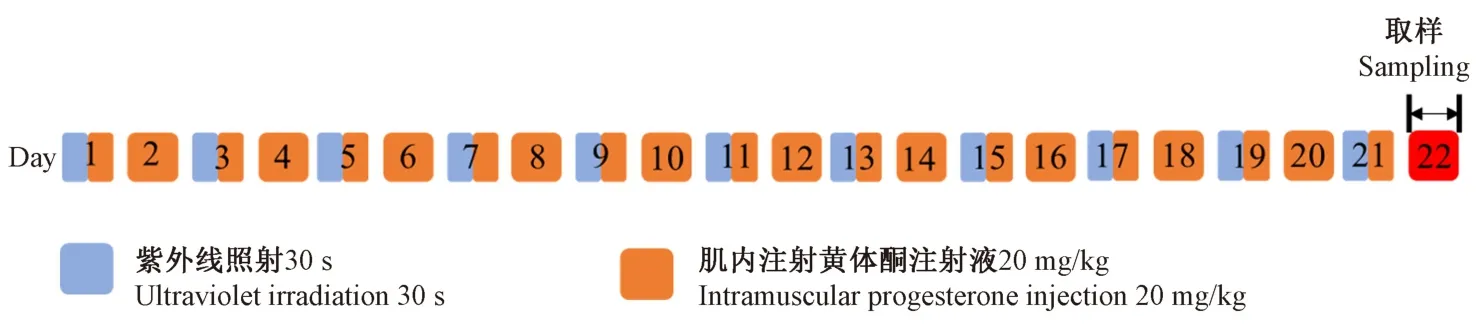
图1 紫外线照射及黄体酮注射时间安排Figure 1 Schedule of UVB exposure and progesterone injection

表2 C57BL/6 小鼠实验动物分组及造模安排表Table 2 Grouping and modeling schedule of C57BL/6 mice
1.3.3 皮肤组织病理学观察
实验第22 天,C57BL/6 小鼠取血后,取耳部、背部新鲜皮肤组织(1.0 cm×1.0 cm),放入10%中性福尔马林固定24 h 后,脱水,常规石蜡包埋,连续3 μm 厚切片两张,一张用于 HE 染色,另一张用于Masson-Fontana 特殊染色,中性树胶封片后,光学显微镜下观察,并以40×的最终放大倍数对切片进行拍照;实验第31 天SD 大鼠用1%戊巴比妥钠麻醉后腹主动脉采血、KM 小鼠取血,处死动物后取背部新鲜皮肤组织(1.0 cm×1.0 cm),用同样的方法进行组织病理学观察。
2 结果
2.1 黄体酮注射剂量、动物品种对黄褐斑动物模型背部皮肤组织HE 染色结果的影响
HE 染色条件下,黑色素细胞多呈棕黄色或棕褐色。 造模后SD 大鼠、KM 小鼠背部皮肤组织HE染色,光学显微镜下观察,正常组和黄体酮各剂量造模组背部皮肤表皮基底层均未观察到明显的黑色素颗粒,见图2。

图2 SD 大鼠、KM 小鼠背部皮肤组织HE 染色结果Note. A-D, Normal group, high, medium and low dose progesterone model group in the SD rats. E-G, Normal group , the high-dose andlow-dose progesterone model group in the KM mice.Figure 2 Results of HE staining of dorsal skin tissues of SD rats and KM mice
2.2 黄体酮注射剂量、动物品种对黄褐斑动物模型背部皮肤组织Masson-Fontana 染色结果的影响
Masson-Fontana 黑色素染色下,黑色素颗粒呈黑色。 造模后SD 大鼠、KM 小鼠背部皮肤组织进行Masson-Fontana 黑色素染色,光学显微镜下观察,正常组和黄体酮高剂量造模组背部皮肤表皮基底层均未观察到明显的黑色素颗粒,结果见图3。
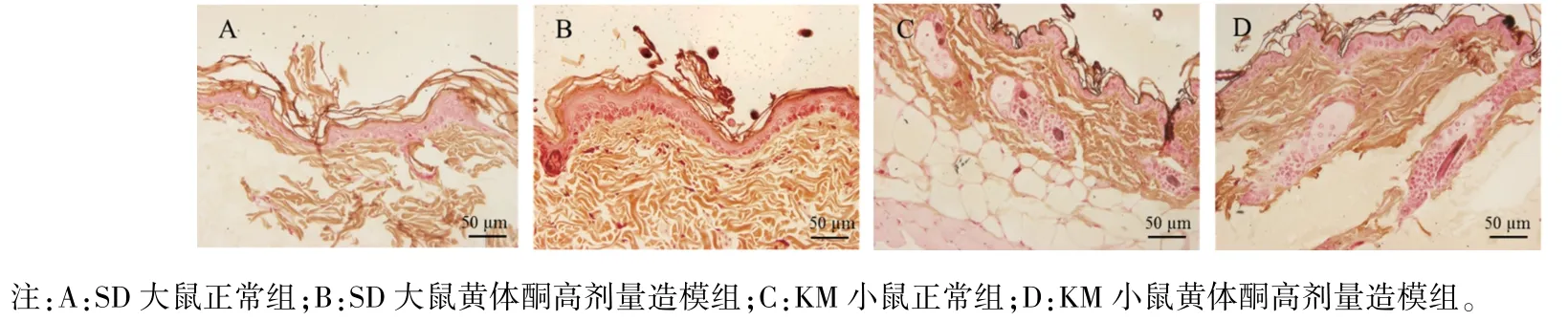
图3 SD 大鼠、KM 小鼠背部皮肤组织Masson-Fontana 染色结果Note. A, Normal group in the SD rats. B, High-dose progesterone modeling group in the SD rats. C, Normal group in the KM mice. D,High-dose progesterone modeling group in the KM mice.Figure 3 Results of Masson-Fontana staining of dorsal skin tissues of SD rats and KM mice
2.3 造模方法对黄褐斑动物模型皮肤组织HE 染色结果的影响
光学显微镜下观察C57BL/6 小鼠耳部、背部皮肤组织HE 染色结果,造模后正常组背部皮肤表皮基底层可观察到散在分布的黑色素颗粒,紫外线联合黄体酮造模组和紫外线组背部皮肤表皮基底层黑色素颗粒较正常组明显增多;造模后正常组耳部皮肤组织表皮基底层可观察到散在分布的黑色素颗粒,紫外线联合黄体酮造模组和紫外线造模组可观察到明显的黑色素颗粒,HE 染色结果见图4。
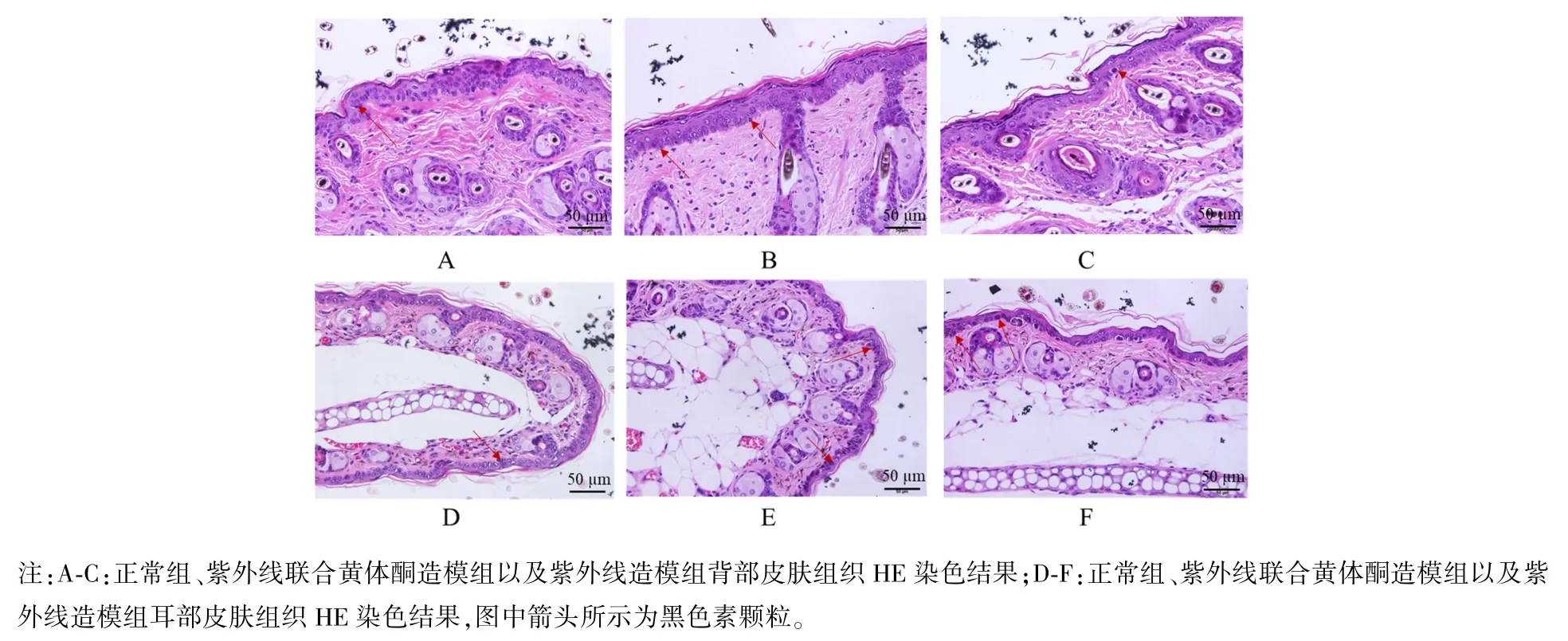
图4 C57BL/6 小鼠背部、耳部皮肤组织HE 染色结果Note. A-C, Results of HE staining of skin tissues on the back of the normal group, UV combined progesterone modeling group and UV modeling group, respectively. D-F,Results of HE staining of skin tissues on the ears of the normal group,UV combined progesterone modeling group and UV modeling group, respectively, with melanin particles shown as arrows in the figure.Figure 4 HE staining results of skin tissue on the back and ear of C57BL/6 mice
2.4 造模方法对黄褐斑动物模型皮肤组织Masson-Fontana 染色结果的影响
光学显微镜下观察C57BL/6 小鼠耳部、背部皮肤组织Masson-Fontana 染色结果,造模后正常组背部皮肤表皮基底层可以观察到极少数量的黑色素颗粒,紫外线联合黄体酮造模组和紫外线组背部皮肤表皮基底层黑色素颗粒较正常组明显增多;造模后正常组耳部皮肤组织表皮基底层可以观察到散在分布的黑色素颗粒,紫外线联合黄体酮造模组和紫外线造模组可以观察到明显的黑色素颗粒,Masson-Fontana 染色结果见图5。

图5 C57BL/6 小鼠背部、耳部皮肤组织Masson-Fontana 染色结果Note. A-C, Results of Masson-Fontana staining of skin tissues on the back of the normal group, UV combined progesterone modeling group and UV modeling group, respectively. D-F, Results of Masson-Fontana staining of skin tissues on the ears of the normal group, UV combined progesterone modeling group and UV modeling group, respectively, with melanin particles shown as arrows in the figure.Figure 5 Masson-Fontana staining results of skin tissue on the back and ear of C57BL/6 mice
3 讨论
黑色素是由皮肤组织表皮基底层黑色素细胞中的酪氨酸在酪氨酸酶以及酪氨酸酶相关蛋白的催化作用下形成的一种生物色素,是决定皮肤颜色的主要因素,在抵御紫外线等有害刺激中起着重要的防御作用,但当黑色素生成过多或黑色素的代谢出现异常时,过多的黑色素由黑色素细胞向上迁移,最终积累在皮肤表面,造成肉眼可见的黑色素,黄褐斑便是一种因皮肤中黑色素异常累积形成的疾病[7]。
目前,国内学者在建立黄褐斑动物模型时多选择KM 小鼠和SD 大鼠等动物品种[8],在造模方法上,多根据其与紫外线辐射、内分泌等因素有关而采用紫外线照射、肌注黄体酮注射液等方法模拟疾病临床发病因素进行造模;而国外学者多采用C57BL/6 小鼠、HRM-2 无毛鼠等动物品系,在造模方法上多使用紫外线照射[9]。 有文献报道,紫外线照射和黄体酮攻击的方法均可以成功建立黄褐斑动物模型[10],日光中的紫外线作为一种外源性刺激,能氧化破坏皮肤中的巯基(-SH)而提高酪氨酸酶的活性,酪氨酸酶在刺激黑色素细胞的分裂,增加单位面积内黑色素细胞数量的同时,也会促使黑色素细胞中黑素小体的分泌和移动扩散,最终引起皮肤色素沉着[11-12];黄体酮可通过增加黑色素细胞数量和黑色素合成过程中关键酶的活性来增加黑色素[13]。 从造模原理上来看,紫外线能从病因和症状两个方面模拟黄褐斑的发病,黄体酮能够从病因角度模拟黄褐斑的发病,而紫外线联合黄体酮的方法在模拟太阳光照射的同时又增加了激素的影响,模拟了黄褐斑临床发病的多因性。 关于黄褐斑动物模型的制备,我国虽出台了相应的草案[6],但因草案中未明确指出动物的品系、紫外线的辐照强度等模型制备中的关键因素,对相关科研工作者带来了困扰,一定程度上影响了模型的复制,所以本研究通过复制国内外常见的几种模型,以期探索一种符合黄褐斑临床疾病特点的模型制备方法。
在黄褐斑动物模型的评价上,目前尚缺少公认的评价标准。 因黄褐斑临床以面部斑块为主要表现,所以从表观指标上观察到局部皮肤的明显斑块是评价黄褐斑动物模型成功与否的重要指标,但因表观指标带有一定的主观性,且会受到灯光、像素以及动物皮肤表面污染等外界因素的干扰,在一定程度上限制了其的应用,相关文献研究表明仅有33.65%的文献涉及表观指标的分析[8]。 病理指标可从微观角度反映组织病理学变化,故局部组织病理学变化常常被用来评价黄褐斑动物模型或在动物水平评价药物治疗黄褐斑的疗效,是评价黄褐斑动物模型的金指标[8,14]。 在评价方法上,HE 染色可以看到局部皮肤组织的结构变化,但在该条件下黑色素通常呈黄棕色或棕褐色,不易与其它色素区分,而Masson-Fontana 染色后可以清楚的看到呈黑色的黑色素,根据黄褐斑获得性色素沉着的疾病特点,目前多使用HE 染色、Masson-Fontana 染色以及免疫组化等方法对局部皮肤中黑色素颗粒、黑色素细胞的数量以及相关蛋白的表达情况进行定性和定量分析[8,15-16]。
3.1 黄体酮注射剂量对复制SD 大鼠、KM 小鼠黄褐斑模型的影响
根据国内模型多选用SD 大鼠和KM 小鼠以及多采用肌注黄体酮注射液建立黄褐斑模型的研究现状,本研究采用肌内注射黄体酮注射液,每天一次,连续30 d 的方法复制SD 大鼠、KM 小鼠黄褐斑动物模型。 因黄体酮的注射剂量是影响模型成功与否的关键因素,而目前所建立的模型中,SD 大鼠的注射剂量存在较多争议,常用剂量有7.5 mg/(kg·d)[17]、10 mg/(kg·d)[10]、20 mg/(kg·d)[18]和 25 mg/(kg·d)[10],所以本研究同时设置了高、中、低(25 mg/(kg·d)、15 mg/(kg·d)、7.5 mg/(kg·d))三个剂量,在同一实验条件下探讨黄体酮剂量对SD大鼠黄褐斑模型的影响。 通过文献调研,KM 小鼠的注射剂量比较一致,多为20 mg/(kg·d)[19-20],所以本研究仅探讨了高、低(30 mg/(kg·d)、20 mg/(kg·d))两个剂量黄体酮对模型的影响,以利于优化模型。
建模完成后,SD 大鼠和KM 小鼠背部皮肤组织HE 染色和Masson-Fontana 染色结果显示,各组均未观察到明显的黑色素颗粒。 我们推测出现这种现象的原因可能与造模方法或者动物品系的选择密切相关。 有文献报道使用肌内注射7.5 mg/(kg·d)的黄体酮注射液,连续30 d 的方法建立了花豚鼠黄褐斑动物模型[21],说明黄体酮造模方法的可行性。同时本研究根据文献中报道的常用剂量对黄体酮设置了多个浓度考察,因此也排除黄体酮注射剂量问题对造模的影响。
黑色素作为维持正常皮肤颜色的一种色素,正常组皮肤的表皮基底层也应该能看到少量黑色素颗粒,但本实验中正常SD 大鼠和KM 小鼠均未观察到黑色素表达。 有研究表明白化鼠没有活跃的黑色素细胞,不能用来研究色素斑、老年痣等色素沉着性疾病[22],而SD 大鼠和KM 小鼠均属于白化鼠,因此种属可能是导致模型复制出现问题的原因。
3.2 不同造模方法对复制C57BL/6 小鼠黄褐斑模型的影响
鉴于国外学者在动物水平研究黑色素时常使用紫外线照射的方法建立C57BL/6 小鼠黄褐斑动物模型[9,23],该品系动物不是白化病鼠,因此,本研究选用了C57BL/6 小鼠,采用紫外线照射以及紫外线照射联合黄体酮的方法探讨造模方法对黄褐斑模型的影响,通过对比C57BL/6 小鼠与SD 大鼠、KM 小鼠的实验结果,也可以进一步说明动物品系对黄褐斑模型的影响。 另外,因目前使用C57BL/6小鼠建立黄褐斑动物模型的观测部位多选择耳部,有研究表明C57BL/6 小鼠的耳部皮肤较躯干皮肤含有更多的黑色素细胞[23],所以本研究同时选取耳部、背部皮肤组织作为观察部位,以验证C57BL/6小鼠黑色素细胞表达的活跃部位。
造模后,正常组背部皮肤组织表皮基底层可以观察到散在分布的黑色素颗粒,正常组的耳部皮肤组织表皮基底层可以观察到明显的黑色素颗粒,利用紫外线照射以及紫外线联合黄体酮的方法建立C57BL/6 小鼠模型后,光学显微镜下观察小鼠背部和耳部皮肤组织HE 染色和Masson-Fontana 染色结果,各组均可以观察到黑色素颗粒的存在,且造模组的黑色素颗粒较正常组明显增多,耳部皮肤较背部皮肤更明显。 此外,背部、耳部皮肤组织的HE 染色和Masson-Fontana 染色的结果提示,两种方法均可成功复制黄褐斑模型。
黄褐斑作为一种损容性疾病,其确切发病机制尚不清楚,临床发病率呈逐年递增趋势,所以深入研究黄褐斑对于明确其发生发展的病理学机制以及降低发病率具有重要的临床意义和社会价值。因病理指标是评价黄褐斑动物模型成功与否的金指标,而临床研究难以从组织病理学角度研究黄褐斑发生和发展,存在一定的局限性,所以基于动物模型研究黄褐斑的组织病理学变化,并在此基础上进行机制研究显得尤为重要。 本研究结果显示,因黄褐斑是一种色素沉着性疾病,在复制疾病模型时,不建议选择 SD 大鼠、KM 小鼠等白化鼠,而C57BL/6 小鼠因其耳部皮肤和背部皮肤均含有一定量的黑色素细胞,是一个较好的复制黄褐斑动物模型的动物品系。 而在模型复制的方法上,利用紫外线联合黄体酮或者单独紫外线照射的方法均可建立黄褐斑模型,但模型的维持时间还有待进一步实验探索。 今后,我们将从模型维持时间、紫外线不同照射剂量的对比研究、单独黄体酮复制C57BL/6 小鼠模型以及各造模方法的原理等方面进一步探索,以期为寻找更合适的造模方法,为黄褐斑的基础研究提供更多的实验数据支撑。
