小陷胸汤对高血脂小鼠血管内皮的保护作用
2021-11-17曾江琴孙勤国徐鸿婕丁晓明牟艳杰蒋跃文
曾江琴,孙勤国,徐鸿婕,丁晓明,牟艳杰,蒋跃文
(1.武汉市第三医院中医科,武汉 430060;2.湖北中医药大学,武汉 430061)
高血脂症(hyperlipdemia,HLP)是一种因体内血脂水平过高引发的全身性脂质代谢紊乱疾病[1],常见于中老年人,隐匿性强,没有明显的临床症状,但长期得不到改善会诱发冠心病、动脉粥样硬化等一系列心脑血管疾病[2-3]。 有研究表明,HLP 极易损伤血管内皮细胞,造成血管内皮功能障碍,进而加重心脑血管疾病[4]。 中医认为,HLP 的核心发病机制为痰瘀阻络[5-6],以化痰祛瘀通络方能向愈[7]。小陷胸汤由黄连、瓜蒌、半夏三味药组成,黄连降火结热,瓜蒌润燥涤垢,半夏散结豁痰,合之以清热化痰、宽胸散结[8-9]。 本研究采用高脂饲料喂养制作小鼠HLP 模型,初步探索小陷胸汤对HLP 小鼠血管内皮的保护作用,以期为HLP 的临床防治提供一定理论基础。
1 材料和方法
1.1 实验动物
36 只 SPF 级 C57BL/6 小鼠,雄性,5 周龄,体重20~22 g,于SPF 级条件下饲养。 小鼠由三峡大学实验动物中心[SCXK(鄂)2017-0012],动物实验在武汉华联科生物技术有限公司动物中心进行[SYXK(鄂)2018-0104],饲养温度 22℃ ~26℃,相对湿度50%~60%,循环光照。 本研究动物实验方案合理,符合实验动物的“3R”原则,经武汉华联科生物技术有限公司伦理审查委员会批准(HLK-20190106-01)。
1.2 主要仪器与试剂
小陷胸汤由黄连3 g,瓜蒌30 g,半夏12 g 三方组成,武汉市第三医院中药房提供。 使用传统方法经浸泡、煎煮、过滤、浓缩等步骤制成煎剂,分别调制成每毫升含生药 0.03 g、0.06 g、0.12 g 汤剂,低温冷藏待用。
洛伐他丁(上海阿拉丁生化科技股份有限公司,中国,批号:Lot#c1925105);高脂饲料(北京华阜康生物科技股份有限公司,中国,批号:D12492);苏木精、伊红、中性树脂、DAB 显色试剂盒(北京索莱宝科技有限公司,中国,批号:G1140、E8090、G8590、DA1010-2);蛋白质 Marker(thermo,美国,批号:26634);RIPA(强)组织细胞快速裂解液、BCA 蛋白浓度测定试剂盒、兔抗血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体、兔抗酪氨酸蛋白激酶Eph 受体B4(EPH receptor B4,EphB4)及其胞膜附着型配体 B2(Ephrin-B2,EphrinB2) 抗体(bioswamp,中国,批号:W1689、W1712、PAB43958、PAB33625、PAB41809);SYBR Green PCR 试剂盒(KAPA Biosystems,美国,批号:KM4101);逆转录试剂盒(TaKaRa,中国,批号:639505)。
正置显微镜、石蜡切片机(Leica,德国,型号:DM1000);生物组织包埋机(湖北泰维科技实业股份有限公司,中国,型号:TB-718D);自动组织脱水机(湖北康强医疗器械有限公司,型号:TKD-TSF);酶标仪(Ladsystems,美国,型号:MK3);电泳仪(BIO-RAD,美国,型号:mini protean 3 cell);PCR 仪(杭州柏恒科技有限公司,中国,型号:GE48527)。
1.3 实验方法
1.3.1 HLP 小鼠模型的建立、分组和给药
适应性喂养7 d 后,对照组6 只采用正常饲料喂养,剩余小鼠采用高脂饲料喂养8 周。 将高脂饲料喂养的小鼠随机分为5 组:模型组(0.5 mL 生理盐水)、低剂量组(0.03 g/mL 小陷胸汤)、中剂量组(0.06 g/mL 小陷胸汤)、高剂量组(0.12 g/mL 小陷胸汤)和阳性对照组(2.5 mg/kg 洛伐他丁),每组6只,给予相应药物灌胃治疗,每日1 次。 每天观察大鼠的毛发状态、摄食量、饮水量、活动量等变化,每周测一次体重。 8 周后,采用1%戊巴比妥钠麻醉后取血,分离血清,处死小鼠,收集脾、肝(称重)、主动脉血管组织,保存待测。
1.3.2 HE 染色观察
将小鼠主动脉组织固定,脱水,包埋成蜡块,切至3 μm,切片脱蜡,复水,水洗;苏木精染色3~6 min,水洗;1%盐酸乙醇1~3 s,水洗;促蓝液返蓝5~10 s,冲洗15~30 min;0.5%伊红染色2~3 min,水洗;80%乙醇15~30 s,95%乙醇15~30 s;无水乙醇1~3 s;二甲苯透明,中性树脂固封;显微镜下拍照观察。
1.3.3 免疫组化染色观察
主动脉血管组织制作切片,脱蜡至水,自来水冲洗10 min;0.01 mol/L 柠檬酸钠高压修复20 min,PBS 冲洗 3 min×3 次;3% H2O2湿盒孵育 10 min,PBS 冲洗3 min×3 次;10%山羊血清湿盒孵育30 min,PBS 冲洗3 min×3 次;滴加兔抗血管假性血友病因子(von Willebrand factor,vWF)抗体,4℃湿盒孵育过夜,PBS 冲洗 3 min×3 次;室温下修复 40 min,PBS 冲洗 5 min×3 次;滴加 maxvision 二抗,湿盒孵育 1 h,PBS 冲洗 3 min×3 次;DAB 染色,自来水冲洗;苏木素复染3 min,1%盐酸乙醇分化,自来水冲洗,乙醇脱水后二甲苯透明3 min×2 次,封片;显微镜下拍照观察,分别测量出血管组织中阳性区面积、阳性区积分光密度,计算阳性区域平均光密度值(average optical density,AOD)= 阳性区积分光密度/阳性区面积。
1.3.4 Western blot 检测
提取主动脉组织蛋白并定量,取20 μg 蛋白置于80 V 下预电泳40 min,再在120 V 下电泳50 min;采用湿转转膜的方式在90 V 下转膜50 min,5%脱脂奶粉封闭 2 h;滴加兔抗 EphB4 抗体(1 ∶1000)、 兔 抗 EphrinB2 抗体 (1 ∶1000)、 兔抗VEGF 抗体(1 ∶500)和膜 4℃孵育过夜;PBST 洗涤 5 min×3 次;加二抗室温孵育1 h;PBST 洗涤5 min×3 次,滴加ECL 发光液显影,读取灰度值。
1.3.5 qRT-PCR 检测
取主动脉组织样本,按照试剂盒说明书步骤提取总RNA 并进行反转录扩增,以cDNA 为模板进行Real-time PCR,反应程序为95℃预变性3 min,95℃变性5 s,56℃退火10 s,72℃延伸25 s,39 个循环。见表1。
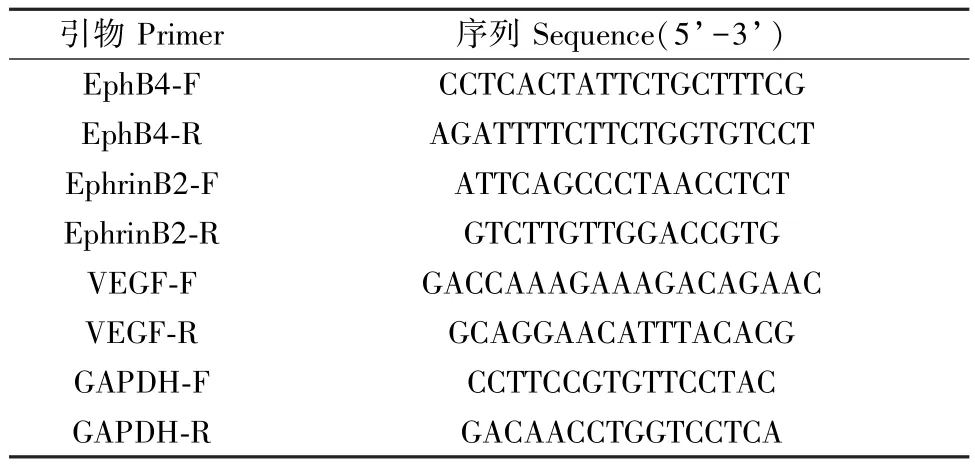
表1 PCR 引物序列Table 1 PCR primer sequences
1.4 统计学方法
采用SPSS 23.0 软件进行数据的统计分析,计量数据以平均数±标准差()表示,单因素方差分析法分析多组间的差异,P<0.05 表示差异显著,有统计学意义;采用Leica Application Suite 图象系统采集主动脉血管组织图片。
2 结果
2.1 小鼠一般状态及体重变化
给药期间,正常组小鼠摄食量、饮水量和活动量均正常,毛发光亮;模型组小鼠摄食量和活动量减少,毛发较差。 低、中、高剂量组和洛伐他丁组小鼠行为状态有所好转。
如表2 所示,与对照组比较,8 周末模型组小鼠体重显著增加(P<0.05);与模型组比较,8 周末小陷胸汤各剂量组、洛伐他丁组均有显著性降低(P<0.05)。

表2 小鼠体重的变化(g)Table 2 Changes of body weight in mice
2.2 小鼠主动脉血管组织病理形态学观察
如图1 所示,对照组小鼠主动脉组织外、中、内三层结构清晰完整,排列紧密有序;模型组主动脉内膜增厚,中层平滑肌细胞排列紊乱,弹力纤维出现明显断裂;低、中、高剂量组和洛伐他丁组内皮组织结构及状态均有不同程度改善。
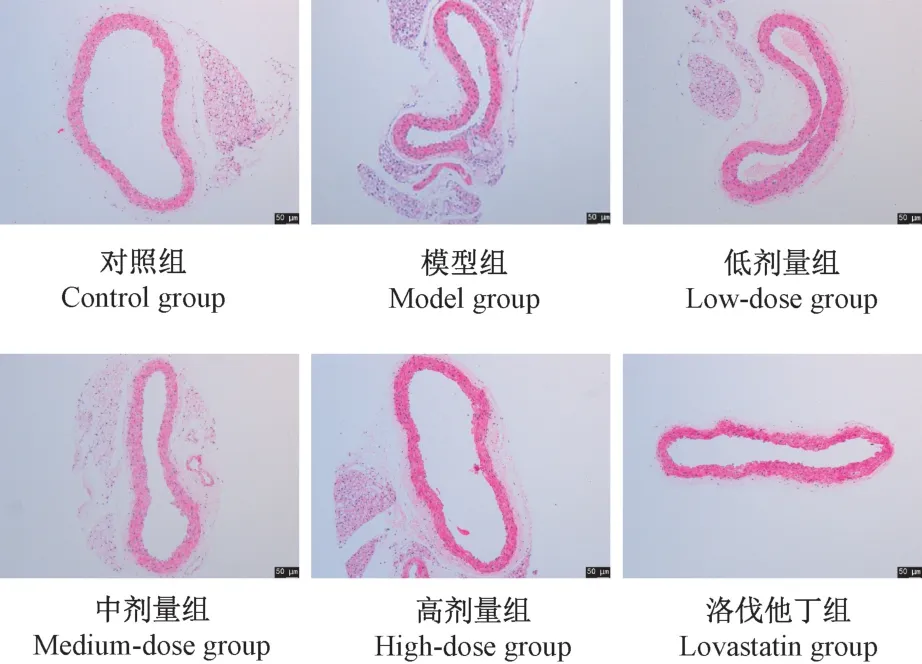
图1 小鼠主动脉HE 染色Figure 1 HE staining of aorta in mice
2.3 小陷胸汤对HLP 小鼠主动脉组织vWF 含量的影响
如图2 所示,与对照组比较,模型组小鼠主动脉vWF 表达显著增加(P<0.05);与模型组比较,小陷胸汤中、高剂量组和洛伐他丁组vWF 表达显著减少(P<0.05)。
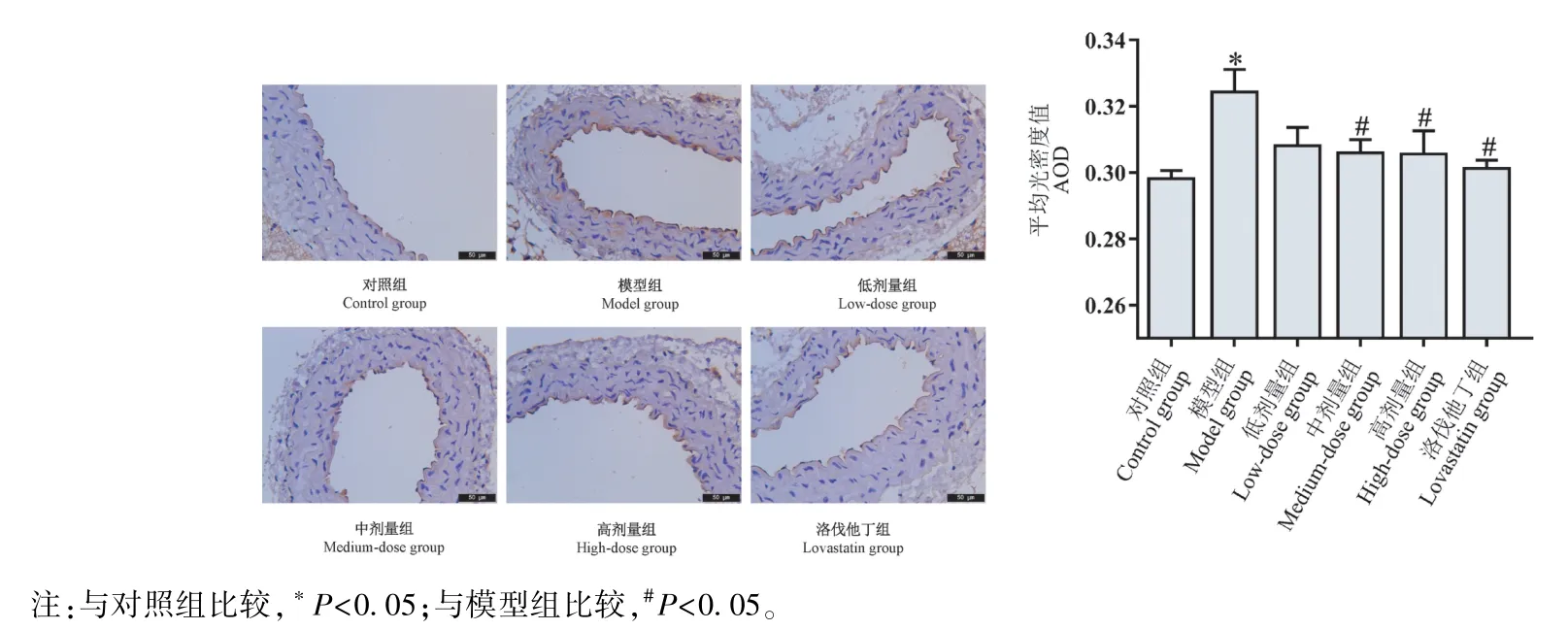
图2 小鼠主动脉组织中vWF 的表达Note. Compared with the control group, *P<0.05. Compared with the model group, #P<0.05.Figure 2 Expression of vWF in aorta of mice
2.4 小陷胸汤对HLP 小鼠主动脉组织中EphB4、EphrinB2 和VEGF mRNA 和蛋白表达的影响
如图3 和图4 所示,与对照组比较,模型组小鼠EphB4、EphrinB2、VEGF 的 mRNA 和蛋白表达水平显著升高(P<0.05);与模型组比较,低、中、高剂量组和洛伐他丁组小鼠 EphB4、 EphrinB2、 VEGF mRNA 和蛋白表达水平显著降低(P<0.05);与低剂量组比较,中剂量和高剂量组小鼠主动脉组织中EphB4、EphrinB2、VEGF mRNA 和蛋白表达水平均显著降低(P<0.05)。

图3 小鼠主动脉组织中EphB4、EphrinB2 和VEGF 的mRNA 水平Note. Compared with the control group, *P< 0.05. Compared with the model group, #P< 0.05.Compared with the low-dose group, &P<0.05.Figure 3 Levels of EphB4, EphrinB2 and VEGF mRNA in aorta of mice

图4 小鼠主动脉组织中EphB4、EphrinB2 和VEGF 蛋白的表达Note. 1, Control group. 2, Model group; 3, Low-dose group. 4, Medium-dose group. 5, High-dose group. 6, Lovastatin group. Compared with the control group, *P<0.05. Compared with the model group, #P<0.05. Compared with the lowdose group, &P<0.05.Figure 4 Expression of EphB4, EphrinB2 and VEGF protein in aorta of mice
3 讨论
HLP 是导致动脉粥样硬化的重要病理基础,也是造成心脑血管病变的主要因素,严重危害着人类的身体健康。 血管内皮功能障碍与众多心血管疾病关系密切[10]。 血管内皮细胞是血液和管壁组织之间的第一通透性屏障,在抗凝、抗血小板聚集和维持血液通道等方面发挥作用。 长期高血脂会促进内皮细胞产生自由基,氧化生物膜内的不饱和脂肪酸,导致内皮细胞损伤,引起内皮细胞功能障碍[11]。 因此,治疗HLP 应重视对血管内皮细胞功能的改善。 小陷胸汤最早出自张仲景的《伤寒论》,取黄连、半夏、瓜蒌入药,此方辛开苦降[12],具有清热化痰、宽胸散结之功。 本研究以HLP 小鼠模型为研究对象,证明了各剂量的小陷胸汤可不同程度改善HLP 小鼠的饮食量和活动量,也显著改善了小鼠主动脉内皮结构损伤、平滑肌细胞排列紊乱程度,提示小陷胸汤对HLP 小鼠血管内皮具有保护作用。
vWF 是一种由内皮细胞和单核细胞产生的多聚糖蛋白,正常生理状态下储存在胞质内的Weibelpalade 小体中,内皮细胞受到损伤时会释放过度的vWF,激活血小板,引发血栓的形成[13],因此vWF被认为是内皮受损的特异性标志物[14]。 在本研究中,HLP 小鼠vWF 表达明显增加,提示高血脂症造成内皮细胞损伤,而经小陷胸汤治疗可以下调vWF的表达,提示小陷胸汤能缓解内皮细胞的损伤。
EphB4/EphrinB2 双向信号通路在血管新生中的意义重大,EphB4 在静脉内皮细胞上特异性地表达,而 EphrinB2 特异性地表达在动脉内皮细胞上[15]。 蔡金等[16]通过清脑益髓调督法电针治疗急性脑梗死发现,该法通过上调EphrinB2 表达,促进血管新生进而对脑梗死起到治疗的作用。 Noren等[17]研究表明,在MOPC315 肿瘤模型中,新生血管内皮细胞表达的磷酸化EphrinB2 表达量较高,其与肿瘤细胞表达的EphB4 相互作用并促进血管的新生。 VEGF 是血管新生的主要调控因子,能够促进血管内皮细胞的有丝分裂。 张振强等[18]研究表明HLP 病理条件会刺激大鼠脑组织VEGF 的表达以促进新生血管的形成。 研究表明,高血脂症诱发机体内源性保护的机制之一是促进血管的生成[19],因此可通过促进血管生成因子的变化判断高血脂症导致的血管内皮损伤的程度。 在本研究结果中,HLP 小鼠 EphB4、EphrinB2 和 VEGF mRNA 水平增加,提示高血脂症诱发了机体内源性保护,促进血管的生成,小陷胸汤治疗后的HLP 小鼠中EphB4、EphrinB2 和VEGF mRNA 及蛋白表达水平下降,且中、高剂量组 EphB4、EphrinB2 和 VEGF mRNA 及蛋白表达水平显著低于低剂量组,存在一定的剂量依赖性,提示新生血管减少,进一步提示小陷胸汤能改善高血脂症引起的病理反应,抑制高血脂症的发展。
综上所述,通过高血脂症导致的小鼠行为变化、主动脉血管组织病变程度及各因子表达水平可判断小陷胸汤具有缓解高血脂症诱导病理反应,改善血管内皮损伤的功效,后续可进一步分析其具体的机制。
