CircHIPK3 低表达调控miR-124/STAT3 轴抑制Aβ诱导的海马神经元凋亡的机制研究
2021-11-17邓炎尧
陈 莹,邓炎尧
(1.长沙市第一医院神经内科,长沙 410005;2.长沙市第一医院 神经医学中心,长沙 410005)
阿尔茨海默病(Alzheimer’s disease,AD)是一种缺乏有效治疗手段的老年痴呆病,其发病率随着老龄化的加剧有明显升高的趋势[1]。 β-淀粉样蛋白(Amyloid β-protein,Aβ)是一种多肽,其在特定脑区内聚集引起海马神经元凋亡导致的神经元数量减少被认为是AD 发病的重要因素[2-3]。 微小RNA(microRNA,miRNA)是一类研究较为广泛的非编码RNA,其异常表达可通过特异性调控相关靶基因影响细胞生物学行为,在包括AD 在内的多种疾病中起着 重 要 作 用[4]。 环 状 RNA ( circular RNA,circRNA)是广泛存在于生物体内的另一类非编码RNA,也是调控miRNA 的重要分子,可通过富含miRNA 结合位点而发挥竞争性内源 RNA 的作用[5]。 同源结构域相互作用蛋白激酶 3(homeodomain-interactingproteinkinases 3,HIPK3)是众多circRNA 中的一员,被证实可通过调控细胞凋亡参与肺癌、白内障和脓毒症等多种疾病的发生发展,然而其在AD 中的作用并不清楚[6-8]。 本研究通过生物信息学软件预测发现,HIPK3 与miR-124 之间存在互补结合位点,同时miR-124 和信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)之间存在互补结合位点;miR-124 被报道在 AD 中低表达,而 STAT3 在 AD 中高表达,且两者均与Aβ 诱导的神经细胞凋亡有关[9-10]。因此,猜测HIPK3 可通过调控miR-124/STAT3 轴介导Aβ 诱导的神经细胞凋亡进而影响AD 的发生发展。 为验证上述猜想,本研究开展体外细胞实验,靶向干扰HIPK3 表达观察HIPK3 低表达是否通过调控miR-124/STAT3 轴影响Aβ 诱导的神经细胞凋亡过程,以期为AD 的发生机制及治疗提供新线索。
1 材料和方法
1.1 实验动物
16 只 SPF 级新生 SD 雄性大鼠(出生 24 h 以内),体重(7.027±0.055)g,购于上海杰思捷实验动物有限公司[SCXK(沪)2018-0004],饲养于中南大学湘雅医学院实验动物学部[SYXK(湘)2020-0019]。 本实验经长沙市第一医院伦理委员会批准(IACUC-26-2019),在实验过程中按照动物使用的“3R”原则给予人道主义关怀。
1.2 主要试剂与仪器
含胎牛血清的 DEME/F12 培养基(货号:PM150312C,武汉普诺赛生命科技有限公司);胰蛋白酶、TRIzol 试剂、LipoHigh 脂质体高效转染试剂、噻 唑 蓝 [3-( 4, 5-Dimethylthiazol-2-yl )-2, 5-diphenyltetrazolium bromide,MTT]细胞增殖检测试剂盒(货号:A003702、B610409、E607403、E606334,上海生工生物工程有限公司);Aβ1 ~ 42(货号:L2B010,上海领潮生物科技有限公司);实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)试剂盒(货号:QPG-020~QPG-023,上海吉玛制药技术有限公司);含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3, Caspase-3)活性测定试剂盒和膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒(货号:BC3830、CA1020,北京索莱宝科技有限公司);STAT3 抗体和甘油醛-3-磷酸脱氢酶 ( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(货号:4904、5174,美国 CST);靶向抑制HIPK3 基因的siRNA(siHIPK)及相应阴性对照(siHIPK-NC)(货号:CS1004、CN1001)、靶向抑制STAT3 基因的 siRNA(siSTAT3)及相应阴性对照(siSTAT3-NC)(货号:CS1010、CN2001)和 miR-124 mimics 和 miR-124 inhibitor 及相应阴性对照 miRNC、inhibitor-NC(货号:CM1005、CM2005、CS7005、CS8005)由南通市百奥迈科生物技术有限公司合成。
1.3 实验方法
1.3.1 大鼠海马神经元原代培养
将大鼠处死后,在无菌环境下取脑并分离海马组织;将其剪碎后,加入质量浓度为0.125%胰蛋白酶消化30 min;再加入等体积 DEME/F12 培养基(含20%胎牛血清)终止消化。 以新鲜培养基吹打后,将细胞悬液过200 目筛网进行过滤;调整细胞浓度后,接种至经L-多聚赖氨酸处理后的6 孔板上,置于37℃、5%二氧化碳培养箱内常规培养;48 h后,加入浓度为5 mg/mL 阿糖胞苷以抑制非神经细胞的活性。 每3 d 更换1/2 原培养基,在培养5 d后,采用神经元特异性树突标志物微管相关蛋白2(microtubule associated protein-2, MAP2)免疫组化染色进行鉴定,采用纯度在95%以上的神经元进行实验。
1.3.2 实验分组与转染
实验分为对照组:正常培养;Aβ 组:以 25 μmol/L Aβ1~42 处理 48 h;Aβ+siHIPK-NC 组:转染siHIPK-NC 后以 25 μmol/L Aβ1~42 处理 48 h;Aβ+siHIPK3 组:转染 siHIPK3 后以 25 μmol/L Aβ1~42处理 48 h;另外,设 Aβ+siHIPK3+antimiR-NC 组:共转染 siHIPK3 和 inhibitor-NC 后给予 25 μmol/L Aβ1~42 处理 48 h;Aβ+siHIPK3+antimiR-124 组:共转染 siHIPK3 和 miR-124 inhibitor 后给予 25 μmol/L Aβ1~ 42 处理 48 h;Aβ+siHIPK3+antimiR-124+siSTAT3-NC 组:共转染 siHIPK3、miR-124 inhibitor和 siSTAT3-NC 后给予 25 μmol/L Aβ1~42 处理 48 h;Aβ+siHIPK3+antimiR-124+siSTAT3 组:共转染siHIPK3、miR-124 inhibitor 和 siSTAT3 后给予 25 μmol/L Aβ1~42 处理 48 h。 其中每组设 3 个平行。将对数生长期的海马神经元接种至6 孔板上,常规培养至75%~80%融合度时,根据实验分组并参照LipoHigh 脂质体高效转染试剂说明书进行瞬时转染;转染5 h 后换新鲜培养基继续培养48 h。
1.3.3 双荧光素酶报告基因实验检测miR-124 与HIPK3 和 STAT3 的靶向关系
starBase 和TargetScan 生物信息学软件预测发现miR-124 与HIPK3 和STAT3 之间存在互补的结合位点;将含miR-124 与CircHIPK3/STAT3 结合位点及突变结合位点的序列片段克隆重组至pGL3-basic 荧光素酶报告载体上构建HIPK3/STAT3 野生型(WT)及突变型(MUT)荧光素酶报告载体,命名为 HIPK3/STAT3-WT、HIPK3/STAT3-MUT。 将miR-124 mimics、阴性对照 miR-NC 与 HIPK3/STAT3-WT、HIPK3/STAT3-MUT 载体质粒共转染至海马神经元中,其中每个处理设3 个平行;待转染48 h 后参照试剂盒说明书检测神经元荧光素酶活性。 实验重复3 次。 另外,将转染 miR-124 mimics 的海马神经元作为miR-124 组,转染miR-NC 的海马神经元作为miR-NC 组,采用免疫印迹法(Western blot)检测 miR-NC 组和 miR-124 组中 STAT3 蛋白表达情况。
1.3.4 qRT-PCR 检测海马神经元中 HIPK3 和miR-124 表达水平
参照TRIzol 试剂说明书提取待测海马神经元总RNA 后,行逆转录合成单链cDNA,以cDNA 为模板上荧光定量PCR 仪进行扩增。 上海生工生物工程合成的PCR 引物序列如下:HIPK3 上游引物:5’-ATGGCCTCACAAGTCTTGGTC-3’, 下 游 引 物:5’-GCACTACCTTTCGTGGAAGGAT-3’; miR-124 上 游引物:5’-CGTGTTCACAGCGGACCTTG-3’,下游引物:5’-GAACATGTCTGCGTATCTC-3’;GAPDH 上游引物:5’-CATCACTGCCACCCAGAAGACTG-3’,下游引物:5’-ATGCCAGTGAGCTTCCCGTTCAG-3’,U6上游引物:5’-GCTTCGGCAGCACATATACT-3’,下游引物:5’-ATCCTTGCGCAGGGGCCA-3’。 配置 20 μL 反应体系:10 μL 2×SYBR ® Premix Ex TagⅡ、10 μmol/L 上下游引物各 0.8 μL、模板 DNA 2 μL 和6.4 μL ddH2O。 PCR 扩增参数:94℃ 3 min(×1),94℃ 20 s(×35)、58℃ 30 s(×35)、72℃ 30 s(×35),72℃ 5 min(×1)。 其中,GAPDH 和 U6 为内参,海马神经元中CircHIPK3 和 miR-124 表达水平以2-△△Ct法计算。 实验重复3 次。
1.3.5 Western blot 检测海马神经元中STAT3 蛋白表达
参照试剂盒说明书提取神经元总蛋白后,二奎啉甲酸法检测总蛋白浓度与纯度。 将蛋白样品与上样缓冲液按照 1 ∶1 比例混合后,沸水浴煮沸 5 min。 将蛋白样品上样至电泳凝胶中行电泳分离后,半干法转至聚偏氟乙烯膜上。 经脱脂奶粉封闭处理后,加入稀释 2000 倍的 STAT3 和 GAPDH 抗体4℃孵育过夜;经稀释5000 倍的二抗室温孵育2 h后,暗室内显影液显影曝光。 GAPDH 作检测内参,凝胶成像分析系统扫描分析神经元中STAT3 蛋白的表达水平。 实验重复3 次。
1.3.6 MTT 法检测海马神经元存活率
将对数生长期海马神经元接种至96 孔板上后,在培养箱内常规培养至贴壁后,根据实验要求进行处理,并将只含有培养基的孔作为调零组;待处理结束后,加入20 μL 浓度5 g/L MTT 试剂;作用4 h后,再加入150 μL 二甲基亚砜;震荡反应至蓝紫色结晶溶解后,酶标仪在490 nm 波长处检测海马神经元吸光度值(A),并计算海马神经元存活率。 实验重复3 次。 其中,存活率(%)= (实验组 A-调零组A)/(对照组A-调零组A)×100%。
1.3.7 流式细胞仪检测海马神经元凋亡率
胰蛋白酶消化收集处理结束后的各组海马神经元后,加入磷酸缓冲液重悬并使用上样缓冲液调整细胞浓度至每毫升105个;取200 μL 细胞悬液于反应管中,先后加入5 μL FITC 标记的Annexin-V 和5 μL PI;充分混匀后,置于避光环境下反应15 min;补加上样缓冲液后,上流式细胞仪检测海马神经元凋亡率。 实验重复3 次。
1.3.8 Caspase-3 活性测定试剂盒检测海马神经元Caspase-3 活性
根据实验要求对海马神经元进行相应处理后,根据试剂盒说明书检测海马神经元Caspase-3 活性。实验重复3 次。
1.4 统计学方法
使用SPSS 22.0 软件对数据进行统计学分析,以平均数±标准差()形式表示实验数据。 两组比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05 代表差异有统计学意义。
2 结果
2.1 miR-124 与 HIPK3 和 STAT3 的靶向关系
图1A 结果显示,miR-124 与 HIPK3 和 STAT3之间存在互补的结合位点。 表1 结果显示,与相应对照 miR-NC 相比, miR-124 mimics 可使转染HIPK3-WT 和STAT3-WT 细胞的荧光素酶活性明显降低(P<0.05),但对转染 HIPK3-MUT 和 STAT3-MUT 细胞的荧光素酶活性无明显影响(P>0.05);另外,图1B 和表1 结果显示,与 miR-NC 组比较,miR-214 mimics 组STAT3 蛋白表达水平明显降低(P<0.05)。
表1 各组荧光素酶活性和STAT3 蛋白表达水平的比较(,n=9)Table 1 Comparison of luciferase activity and STAT3 protein expression in each group
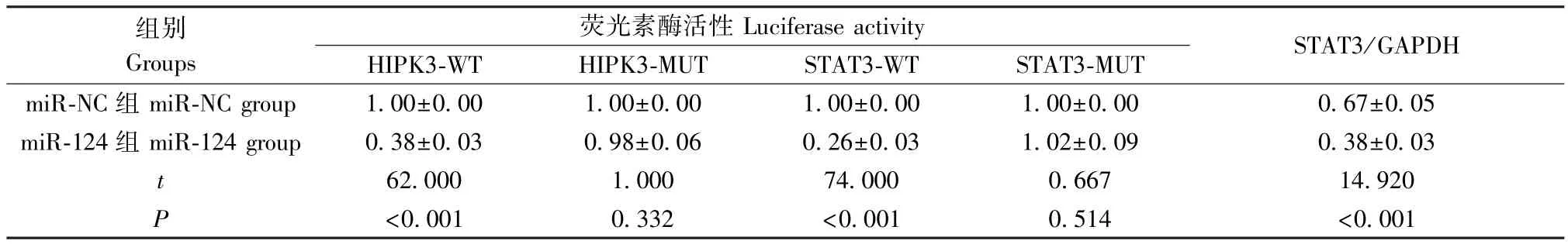
表1 各组荧光素酶活性和STAT3 蛋白表达水平的比较(,n=9)Table 1 Comparison of luciferase activity and STAT3 protein expression in each group
组别Groups荧光素酶活性Luciferase activity HIPK3-WT HIPK3-MUT STAT3-WT STAT3-MUT STAT3/GAPDH miR-NC 组 miR-NC group 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 0.67±0.05 miR-124 组 miR-124 group 0.38±0.03 0.98±0.06 0.26±0.03 1.02±0.09 0.38±0.03 t 62.000 1.000 74.000 0.667 14.920 P<0.001 0.332 <0.001 0.514 <0.001
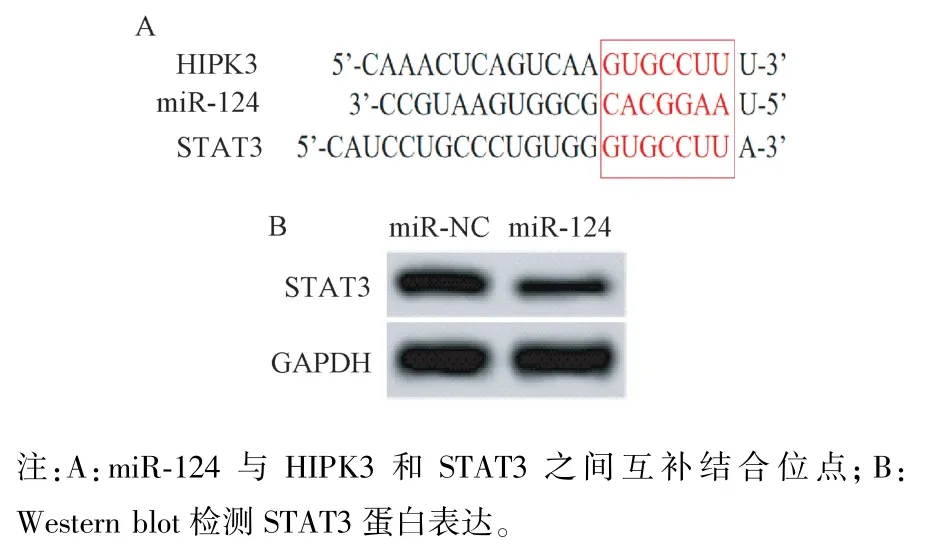
图1 miR-124 与HIPK3 和STAT3 的靶向关系Note. A, Complementary binding sites between miR-124 and HIPK3 and STAT3. B, Expression of STAT3 protein was detected by Western blot.Figure 1 Targeting relationship of miR-124 with HIPK3 and STAT3
2.2 转染后海马神经元中 HIPK3、miR-124 和STAT3 蛋白的表达水平
图2 和表2 结果显示,与对照组比较,Aβ 组海马神经元中HIPK3 和STAT3 蛋白表达水平明显升高,而miR-124 表达水平明显降低(P<0.05);与Aβ组比较,Aβ+siHIPK-NC 组中 HIPK3、miR-124 和STAT3 蛋白表达水平差异均无统计学意义(P>0.05);与 Aβ+siHIPK-NC 组比较,Aβ+siHIPK3 组中HIPK3 和 STAT3 蛋白表达水平明显降低,而miR-124 表达水平明显升高(P<0.05)。
表2 各组中HIPK3、miR-124 和STAT3 蛋白表达水平的比较(,n=9)Table 2 Comparison of protein expression levels of HIPK3, miR-124 and STAT3 in each group
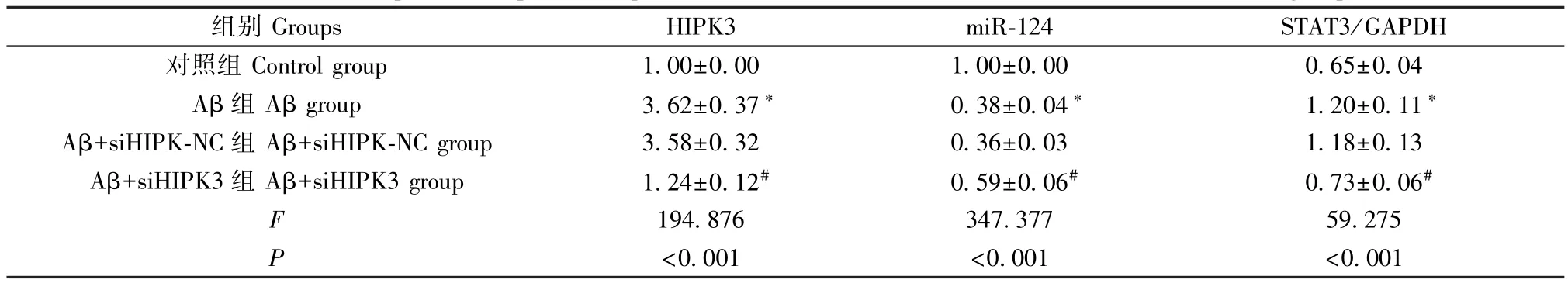
表2 各组中HIPK3、miR-124 和STAT3 蛋白表达水平的比较(,n=9)Table 2 Comparison of protein expression levels of HIPK3, miR-124 and STAT3 in each group
注:与对照组比较,*P<0.05;与Aβ+siHIPK-NC 组比较,#P<0.05。Note. Compared with the control group, *P<0.05. Compared with Aβ+siHIPK-NC group, #P<0.05.
组别Groups HIPK3 miR-124 STAT3/GAPDH对照组 Control group 1.00±0.00 1.00±0.00 0.65±0.04 Aβ 组 Aβ group 3.62±0.37* 0.38±0.04* 1.20±0.11*Aβ+siHIPK-NC 组 Aβ+siHIPK-NC group 3.58±0.32 0.36±0.03 1.18±0.13 Aβ+siHIPK3 组 Aβ+siHIPK3 group 1.24±0.12# 0.59±0.06# 0.73±0.06#F 194.876 347.377 59.275 P<0.001 <0.001 <0.001
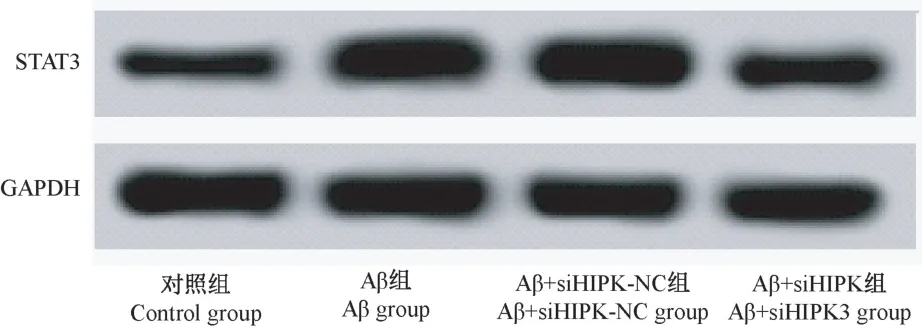
图2 Western blot 检测各组STAT3 蛋白表达Figure 2 The expression of STAT3 protein was detected by Western blot
2.3 下调HIPK3 表达对Aβ 诱导的海马神经元凋亡影响
图3 和表3 结果显示,与对照组比较,Aβ 组海马神经元存活率明显降低,而凋亡率和Caspase-3 活性明显升高(P<0.05);与Aβ 组比较,Aβ+siHIPKNC 组海马神经元存活率、凋亡率和Caspase-3 活性差异均无统计学意义(P>0.05);而Aβ+siHIPK3 组海马神经元存活率较Aβ+siHIPK-NC 组明显升高,而凋亡率和Caspase-3 活性较 Aβ+siHIPK-NC 组明显降低(P<0.05)。
表3 各组海马神经元存活率、凋亡率和Caspase-3 活性的比较(,n=9)Table 3 Comparison of survival rate, apoptosis rate and Caspase-3 activity of hippocampal neurons in each group
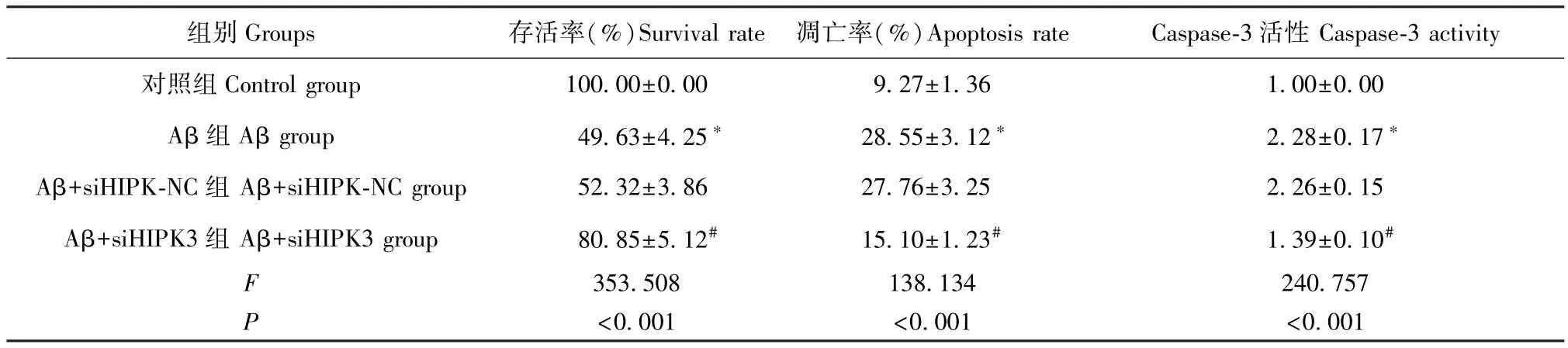
表3 各组海马神经元存活率、凋亡率和Caspase-3 活性的比较(,n=9)Table 3 Comparison of survival rate, apoptosis rate and Caspase-3 activity of hippocampal neurons in each group
注:与对照组比较,*P<0.05;与Aβ+siHIPK-NC 组比较,#P<0.05。Note. Compared with the control group, *P<0.05. Compared with Aβ+siHIPK-NC group, #P<0.05.
组别Groups 存活率(%)Survival rate 凋亡率(%)Apoptosis rate Caspase-3 活性Caspase-3 activity对照组 Control group 100.00±0.00 9.27±1.36 1.00±0.00 Aβ 组 Aβ group 49.63±4.25* 28.55±3.12* 2.28±0.17*Aβ+siHIPK-NC 组 Aβ+siHIPK-NC group 52.32±3.86 27.76±3.25 2.26±0.15 Aβ+siHIPK3 组 Aβ+siHIPK3 group 80.85±5.12# 15.10±1.23# 1.39±0.10#F 353.508 138.134 240.757 P<0.001 <0.001 <0.001
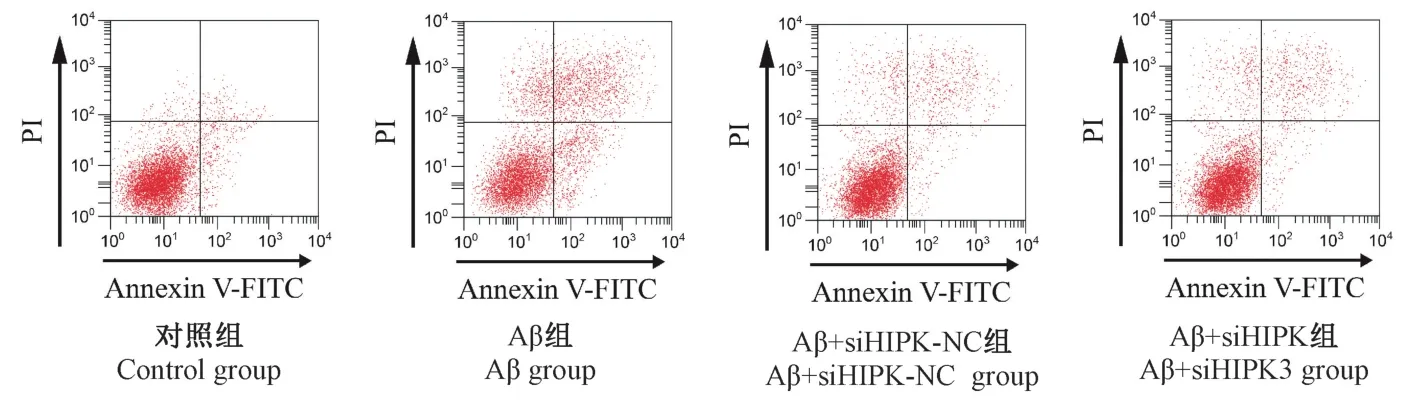
图3 流式细胞仪检测各组海马神经元凋亡结果Figure 3 Apoptosis of hippocampal neurons was detected by flow cytometry
2.4 miR-124 低表达调控STAT3 对Aβ 诱导的海马神经元凋亡影响
表4 和图4 结果显示,与 Aβ+siHIPK3 组比较,Aβ+siHIPK3+antimiR-NC 组海马神经元中miR-124、STAT3 蛋白、存活率、凋亡率和Caspase-3 活性差异均无统计学意义(P>0.05);与Aβ+siHIPK3+antimiRNC 组比较,Aβ+siHIPK3+antimiR-124 组中 miR-124表达水平和海马神经元存活率明显降低,而STAT3蛋白表达水平和海马神经元凋亡率、Caspase-3 活性明显升高(P<0.05);与 Aβ+siHIPK3+antimiR-124 组比较,Aβ+siHIPK3+antimiR-124+siSTAT3-NC 组中miR-124、STAT3 蛋白、存活率、凋亡率和 Caspase-3 活性差异均无统计学意义(P>0.05);与Aβ+siHIPK3+antimiR-124+siSTAT3-NC 组比 较,Aβ +siHIPK3 +antimiR-124+siSTAT3 组中STAT3 蛋白表达水平和海马神经元凋亡率、Caspase-3 活性明显降低,而海马神经元存活率明显升高(P<0.05)。
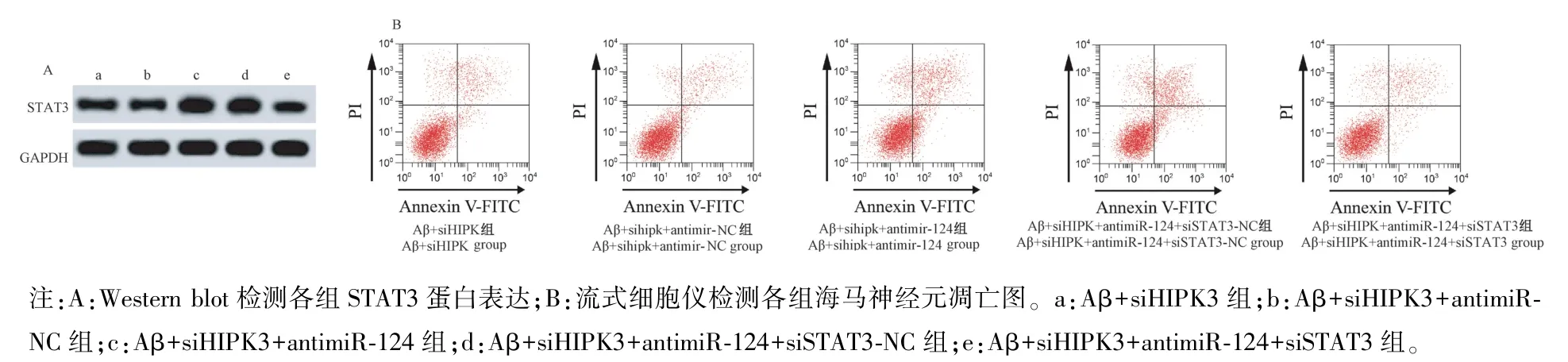
图4 miR-124 对Aβ 诱导的海马神经元凋亡影响Note. A, Expression of STAT3 protein was detected by Western blot. B, Apoptosis of hippocampal neurons in each group was detected by flow cytometry. a, Aβ+siHIPK3 group. b, Aβ+siHIPK3+antimiR-NC group. c, Aβ+siHIPK3+antimiR-124 group. d, Aβ+siHIPK3+antimiR-124+siSTAT3-NC group. e, Aβ+siHIPK3+antimiR-124+siSTAT3 group.Figure 4 Effect of miR-124 on apoptosis of hippocampal neurons induced by Aβ
表4 各组miR-124、STAT3 蛋白表达水平和存活率、凋亡率和Caspase-3 活性的比较(,n=9)Table 4 Comparison of miR-124, STAT3 protein expression level, survival rate, apoptosis rate and Caspase-3 activity in each group
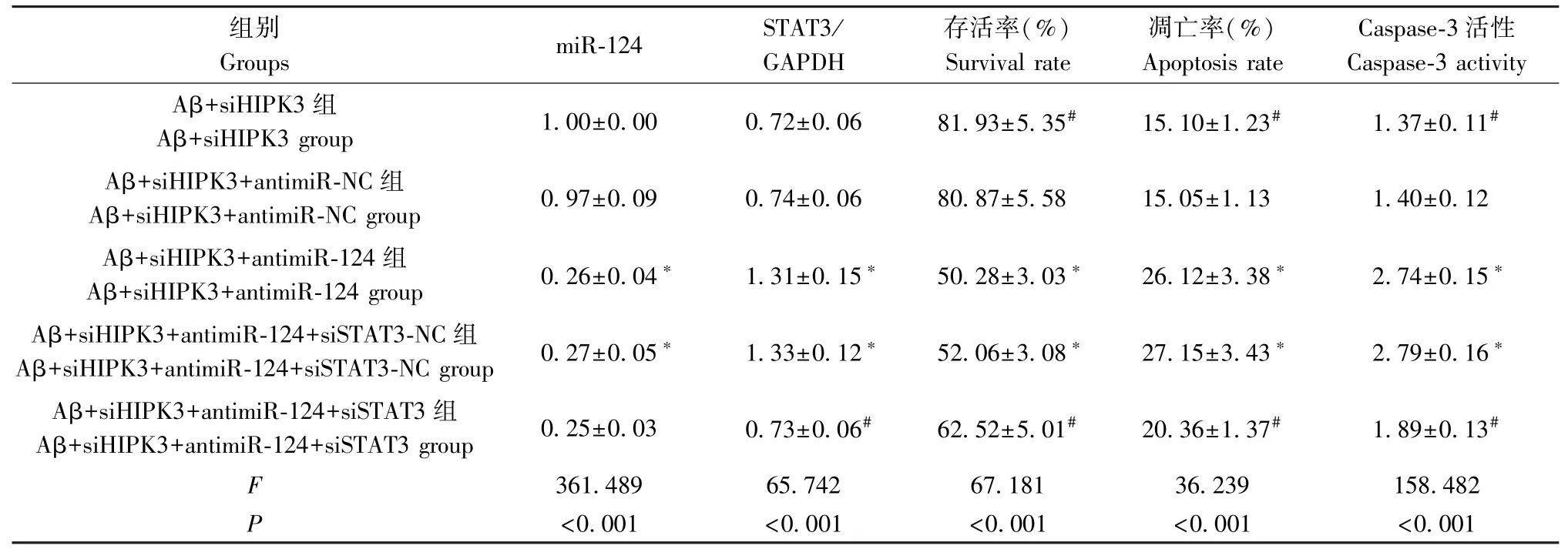
表4 各组miR-124、STAT3 蛋白表达水平和存活率、凋亡率和Caspase-3 活性的比较(,n=9)Table 4 Comparison of miR-124, STAT3 protein expression level, survival rate, apoptosis rate and Caspase-3 activity in each group
注:与 Aβ+siHIPK3+antimiR-NC 组比较,*P<0.05;与 Aβ+siHIPK3+antimiR-124+siSTAT3-NC 组比较,#P<0.05。Note. Compared with Aβ+siHIPK3+antimiR-NC group, *P<0.05. Compared with Aβ+siHIPK3+antimiR-124+siSTAT3-NC group, #P<0.05.
组别Groups miR-124 STAT3/GAPDH存活率(%)Survival rate凋亡率(%)Apoptosis rate Caspase-3 活性Caspase-3 activity Aβ+siHIPK3 组Aβ+siHIPK3 group 1.00±0.00 0.72±0.06 81.93±5.35# 15.10±1.23# 1.37±0.11#Aβ+siHIPK3+antimiR-NC 组Aβ+siHIPK3+antimiR-NC group 0.97±0.09 0.74±0.06 80.87±5.58 15.05±1.13 1.40±0.12 Aβ+siHIPK3+antimiR-124 组Aβ+siHIPK3+antimiR-124 group 0.26±0.04* 1.31±0.15* 50.28±3.03* 26.12±3.38* 2.74±0.15*Aβ+siHIPK3+antimiR-124+siSTAT3-NC 组Aβ+siHIPK3+antimiR-124+siSTAT3-NC group 0.27±0.05* 1.33±0.12* 52.06±3.08* 27.15±3.43* 2.79±0.16*Aβ+siHIPK3+antimiR-124+siSTAT3 组Aβ+siHIPK3+antimiR-124+siSTAT3 group 0.25±0.03 0.73±0.06# 62.52±5.01# 20.36±1.37# 1.89±0.13#F 361.489 65.742 67.181 36.239 158.482 P<0.001 <0.001 <0.001 <0.001 <0.001
3 讨论
miRNAs 是一类可通过降解靶基因或阻断其转录后翻译进而发挥负向调控靶基因作用的小分子RNA,与 AD 的发生发展密切相关[11]。 circRNA 是一个环形内源性RNA 分子,由前体mRNA 反向剪接产生,因作为 miRNA“海绵体”在AD 中引起关注[5]。 Qian 等[12]报道指出,microRNA-338-5p 的下调有助于AD 的病理特征缓解。 Lu 等[13]研究发现,circHDAC9 可通过调控miR-138/Sirt1 通路降低Aβ生成,被认为可能是 AD 治疗的潜在靶点。 Yang等[14]研究指出,circ-0000950 通过直接海绵化miR-103 可促进神经元凋亡、提高炎性细胞因子水平和抑制轴突生长,进而发挥着促进AD 发生发展的作用。 HIPK3 是一个与多种疾病发生关系密切的circRNA。 Teng 等[15]在卵巢癌中研究发现,沉默circHIPK3 可促进肿瘤细胞增殖、迁移和侵袭并抑制细胞凋亡。 Si 等[16]在心肌梗死研究中发现,circHipk3 过表达通过海绵吸附miR-133a 促进冠状动脉血管内皮细胞的增殖、迁移和血管生成,减轻了心肌梗死后的心功能不全和纤维化面积。 Fu等[17]在神经退行性疾病亨廷顿病中发现,HIPK3 是细胞自噬的负调节因子和突变的HTT/Hdh 蛋白水平的正调节因子,而敲低其表达可通过增强自噬减少突变的HTT/Hdh 蛋白水平,减轻细胞毒性。 然而,HIPK3 在AD 中的作用如何并不清楚。
miR-124 是 miRNAs 家族成员,在神经系统发育、损伤和修复等过程中发挥着重要作用[18];STAT3 是一个机体内广泛表达的信号传导和转录激活因子,被激活后可通过调控细胞增殖、分化和凋亡等参与多种疾病的发生发展[19-20]。 在 AD 中miR-124 呈低表达状态,而miR-124 过表达可通过靶向调控BACE1 抑制Aβ 诱导的神经细胞凋亡[9];而STAT3 在AD 中呈高表达状态,且在 Aβ 诱导的神经细胞凋亡过程中发挥着重要的促进作用[10]。Chen 等[21]研究显示,HIPK3 可通过 miR124-3p-STAT3 信号途径调节肺癌细胞自噬。 本研究采用生物信息学软件预测发现,miR-124 与 HIPK3 和STAT3 之间存在互补的结合位点;另外,双荧光素酶报告基因实验及Western blot 实验证实了HIPK3 可与miR-124 靶向结合,miR-124 可靶向调控STAT3蛋白表达。 这提示,HIPK3 可能通过调控miR-124/STAT3 轴介导Aβ 诱导的神经细胞凋亡过程,HIPK3可能在AD 发生发展过程中扮演着重要角色。
本研究成功干扰抑制HIPK3 表达后发现,Aβ刺激所致的海马神经元存活率降低及凋亡率、凋亡执行因子Caspase-3 活性升高均明显受到抑制,并上调海马神经元中miR-124 表达且下调STAT3 蛋白表达。 结果表明,CircHIPK3 低表达可抑制Aβ 诱导的海马神经元凋亡并调控miR-124/STAT3 表达。另外,本研究进一步抑制miR-124 表达后发现,Aβ作用下的海马神经元中STAT3 蛋白表达水平、凋亡率和Caspase-3 活性明显升高,而海马神经元存活率降低;同时,靶向抑制STAT3 表达后发现,miR-124低表达对海马神经元的上述作用明显逆转。 结果表明,miR-124 低表达可通过靶向调控STAT3 促进Aβ 诱导的海马神经细胞凋亡。 提示,HIPK3 低表达抑制Aβ 诱导的海马神经细胞凋亡可能是通过调控miR-124/STAT3 轴来实现的。
综上所述,CircHIPK3 低表达可抑制Aβ 诱导的海马神经元凋亡,其作用机制与调控 miR-124/STAT3 轴有关。 本研究初次在细胞层面上证实了CircHIPK3 在海马神经元凋亡过程中的作用,后续将在体内动物模型中进一步探索CircHIPK3 在AD大鼠模型海马神经元凋亡中的作用,以期为AD 发病机制和治疗提供新的参考依据。
