转谷氨酰胺酶为交联剂固定化漆酶及其在苹果汁澄清中的应用
2021-11-17魏胜华汤中勋张威郭良昊
魏胜华,汤中勋,张威,郭良昊
(安徽工程大学 生物与食品工程学院,安徽 芜湖,241000)
多酚类物质是植物生长过程中合成的次级代谢产物,许多水果中富含多酚类成分,但在果汁的贮存期间,由于多酚类物质的存在,往往会导致果汁混浊和风味变化[1]。因此,在果汁的加工过程中往往需要降低其中多酚的含量以保持其在贮藏期间的澄清。目前,常采用明胶、膨润土和硅藻土等作为吸附剂降低果汁中多酚的含量[2-4]。但是物理吸附处理时间长,吸附效果差,多酚残量较高,导致果汁后期易变混浊[5]。
漆酶(laccase, E.C.1.10.3.2)是一种以铜离子为活性中心的多酚氧化酶,该酶能够利用氧气为最终电子受体,高效转化偶氮类、酚类、甾体类和芳胺类等化合物形成醌类化合物、羰基化合物和水[6]。因此,利用漆酶的这一催化性能,可以有效地降低果汁中多酚的含量,使其贮藏期间依然保持澄清[7]。然而漆酶作为一种外源添加剂是不适宜留在果汁中的。将漆酶固定在载体上,不仅可以实现漆酶与果汁的有效分离,同时也能够提高漆酶的稳定性,实现重复使用。大孔吸附树脂是一种具有多孔立体结构、人工合成的高聚物,其稳定性好,常用于天然产物中活性成分的分离提取[8]。由于其具有较大的比表面积,该树脂也经常被用作固定化酶的载体,通过范德华力、静电吸引和氢键等分子间作用力对酶进行吸附,实现酶的固定化。但是单纯的吸附容易使酶在反应过程中脱落,一般再辅以戊二醛作为交联剂对酶蛋白进行交联,以提高固定化酶的稳定性[9]。然而戊二醛有一定的毒性,因此将其应用在食品行业上具有潜在的危害性。转谷氨酰胺酶(transglutaminase,TGase)可以催化蛋白质的谷氨酰胺残基发生转酰基的反应,能够使蛋白质分子间形成共价交联聚合。与戊二醛相比,TGase具有安全高效和生物相容性好的优点,已经运用在α-淀粉酶[10]、β-葡萄糖苷酶[11]和碱性磷脂酶[12]等酶的固定化中。本研究以大孔吸附树脂AB-8为固定化的载体材料,利用TGase作为交联剂,采用吸附-交联法固定化漆酶,探究了影响酶固定化的因素和固定化酶的酶学性质,并且以苹果汁为研究对象,考察了固定化漆酶在苹果汁澄清中的作用,为拓宽漆酶在食品工业中的应用提供了新方法。
1 材料与方法
1.1 试剂与设备
苹果,当地农贸市场;漆酶(酶活力25.5 U/mL),本实验室采用固态发酵法制得[13];AB-8大孔吸附树脂、果胶酶、淀粉酶,麦克林试剂有限公司;转谷氨酰胺酶,江苏一鸣生物有限公司;其他试剂,国药集团上海试剂公司,均为分析纯。
JYL-C022E榨汁机,山东九阳电器有限公司;754-PC紫外可见分光光度计,上海奥谱勒仪器有限公司;85-2恒温磁力搅拌器,金坛市杰瑞尔电器有限公司;BHS-2恒温水浴锅,宁波市鄞州群安实验仪器科技有限公司;ZQZY-78BN双层恒温振荡培养箱,上海知楚仪器有限公司。
1.2 实验方法
1.2.1 苹果汁的制备
将苹果洗干净,放入-4 ℃冰箱中冷藏30 min,取出切成小块用榨汁机搅碎匀浆,随后将匀浆液加热到100 ℃保持5 min,然后冷却至约50 ℃,加入0.1%(体积分数)的果胶酶和淀粉酶酶解30 min,用纱布进行粗过滤,滤液在4 ℃、8 000 r/min下离心10 min,即得到苹果汁原液,4 ℃冰箱中储存待用。
1.2.2 漆酶的固定化
称取1 g预处理后的树脂加入到10 mL的漆酶溶液中,并在30 ℃,150 r/min恒温振荡水浴中吸附一定时间后,加入一定量的TGase溶液,并在30 ℃,150 r/min恒温振荡水浴中反应120 min,过滤并用缓冲液洗涤3次,用滤纸吸干水分后得到固定化酶,储存在4 ℃的冰箱中待用。
1.2.3 酶活力和蛋白含量的测定
游离酶:取200 μL酶液,加入pH 4.0的醋酸盐缓冲液800 μL,置于40 ℃水浴锅中温浴2 min,加入等体积0.8 mmol/L愈创木酚溶液继续反应10 min,冰浴终止反应,立即在465 nm处测吸光度值的变化,酶活力定义为:在40 ℃下,1 mL酶液中1 min氧化1 μmol愈创木酚所需酶量为1个酶活力单位(U)。
固定化酶:取0.05 g固定化酶加入1 mL pH 4.0醋酸盐缓冲液,置于40 ℃水浴锅中温浴2 min,加入等体积0.8 mmol/L愈创木酚溶液继续反应10 min,冰浴终止反应,立即在465 nm处测吸光度值变化。酶活力定义为:在40 ℃下,1 g固定化漆酶1 min氧化1 μmol愈创木酚所需酶量即为1个酶活力单位(U)。
蛋白含量的测定以牛血清白蛋白为标准蛋白,采用Bradford法[14]。
1.2.4 固定化漆酶的酶学性质研究
1.2.4.1 最适pH值和最适温度
最适pH值:固定化酶和游离酶分别在pH 3.0~8.0缓冲液中测定酶活力,考察其相对催化活力。
最适温度:固定化酶和游离酶分别在30~70 ℃测定酶活力,考察其相对催化活力。
1.2.4.2 固定化酶pH和温度耐受性
pH耐受性:固定化酶和游离酶分别放置在50 mmol/L、pH 3.0的柠檬酸-柠檬酸钠和50 mmol/L、pH 8.0的磷酸二氢钠-磷酸氢二钠的缓冲液中,定时取样测定酶活力,计算其剩余酶活力。
温度耐受性:固定化酶和游离酶分别放置在80 ℃的条件下,定时取样测定酶活力,计算其剩余酶活力。
1.2.5 苹果汁的澄清
在250 mL三角瓶中装入100 mL苹果汁和1.0 g固定化酶,在35 ℃水浴锅中以150 r/min振荡反应180 min,中间过程定时取样测定果汁中各项指标的变化。处理后的苹果汁经过巴氏杀菌后,在25 ℃下放置14 d,考察苹果汁总酚和浊度的变化。
总酚的测定采用Folin-酚显色法[15];浊度的测定采用分光光度法[16],测定果汁640 nm处吸光值的变化。
1.2.6 数据处理
每个实验重复3次,采用Origin 2018对实验数据进行统计分析并作图。
2 结果与分析
2.1 固定化过程的研究
2.1.1 吸附过程条件的选择
大孔树脂吸附对固定化影响的实验结果如图1所示。由图1-a可以看出,pH 4.0时酶活力回收率最高,可能是在此pH条件下,蛋白的带电状态使其与树脂上活性基团之间的吸附力最强;图1-b显示,最佳吸附温度为30 ℃,酶活力回收率可以达到80.1%;图1-c表明吸附的最佳时间是4 h,时间太短,吸附不够彻底,但是时间过长,由于振荡作用反而会使已经吸附上的酶脱落;由图1-d可以看出,在树脂含量一定的情况下,相对酶活力随着加酶量的增加而增加,当加酶量为10 mL时达到平衡。
2.1.2 交联条件的选择
TGase对固定化影响的实验结果如图2所示。由图2-a可以看出,随着TGase用量的增加,酶活力回收率也随之增加,但当用量超过200 U时,由于漆酶被过度交联,使酶活性中心被覆盖,致使酶活力回收率下降;图2-b显示,酶活力回收率在pH 4.0时达到最大。TGase可以在酶蛋白的谷氨酰胺残基的γ-羧基与赖氨酸的ε-氨基之间形成肽键,文献报道其最适pH一般是6.0~8.0[17-19],但是在这个条件下,可能会对漆酶的活性产生不利的影响,因此pH 4.0是同时满足TGase活性和漆酶活性保持最佳的平衡点;图2-c显示温度对于固定化的影响,在20~30 ℃,酶活力回收率随温度而提高,当温度高于30 ℃,酶活力回收率逐渐降低,这是因为温度影响TGase的催化能力,进而影响漆酶的交联度,导致酶活力回收率呈现先升高后降低的趋势;图2-d显示了不同交联时间对于固定化的影响,最适的交联时间为2 h,时间过短会使吸附的酶分子未充分交联而脱落使得固定化酶活力低,而时间过长可能使酶的结构刚性较强或者过度交联使酶的活性中心被反应导致酶活力降低。
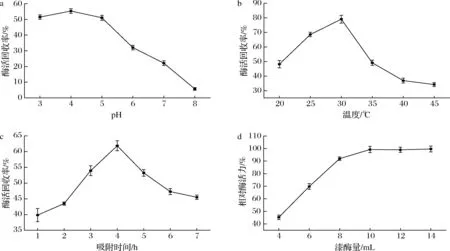
a-pH;b-温度;c-吸附时间;d-漆酶量图1 吸附过程对固定化的影响Fig.1 Effect of adsorption process on immobilization

a-TGase量;b-pH;c-温度;d-交联时间图2 交联过程对固定化的影响Fig.2 Effect of crosslinking process on immobilization
综合以上实验结果确定吸附的最佳条件是:pH 4.0、吸附温度30 ℃、吸附时间4 h、漆酶的用量为10 mL/g树脂;交联的最佳条件是:pH 4.0、交联温度30 ℃、交联时间2 h、TGase的用量为200 U/g树脂。在此条件下制备的固定化酶的酶活力为210 U/g,酶活力回收率为82.5%。
2.2 固定化酶性质的研究
2.2.1 最适pH和最适温度
分别测定不同pH值缓冲液体系中游离酶和固定化酶的酶活力,结果如图3所示,游离酶最适pH值为4,固定化酶最适pH值为5,固定化酶最适pH值较游离酶偏大了1个单位。在很多情况下固定化载体材料的性质会改变固定化酶的微环境,从而促使酶的最适pH发生改变[20]。在30~70 ℃内考察酶的最适催化温度,结果如图4所示,游离酶最适温度为50 ℃,固定化酶最适温度为60 ℃,这可能是因为部分酶分子被固定在大孔树脂的内部孔径中,需要较高温度增加底物扩散效应才能更好的与酶发生反应。
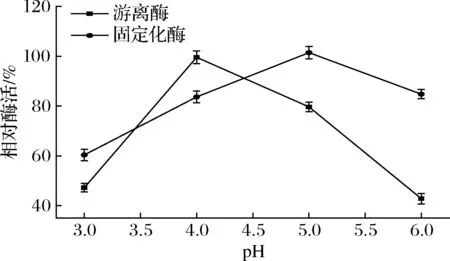
图3 固定化酶的最适pH值Fig.3 Optimum pH value for immobilized enzyme

图4 固定化酶的最适温度Fig.4 Optimum temperature for immobilized enzyme
2.2.2 固定化酶的pH和热稳定性
图5显示了游离酶和固定化酶在2种较为极端pH条件下酶活力的保留情况,可以看出,漆酶在酸性的条件下稳定性较好,在120 min时游离酶的剩余酶活力依然有60%,固定化酶的剩余酶活力为66.8%,而在pH 8.0的碱性条件下,游离酶的酶活力在短时间内降低很快,到了120 min基本消失,而固定化酶的酶活力降低较为缓慢,在最后仍然有13.6%的剩余酶活力。
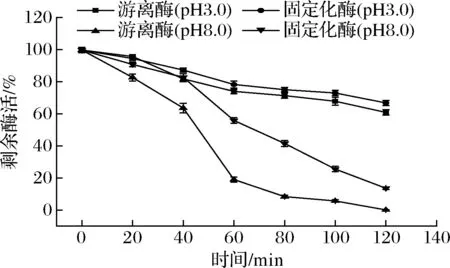
图5 固定化酶的pH稳定性Fig.5 pH stability of immobilized enzyme
将游离酶和固定化酶分别在80 ℃条件下放置,间隔一定时间取样测定酶活力,考察游离酶和固定化酶的热稳定性,结果如图6所示,在120 min后游离酶剩余酶活力仅为5.3%,固定化酶剩余酶活力为36.6%,这表明固定后漆酶的热稳定性得到了显著改善。

图6 固定化酶的温度稳定性Fig.6 Temperature stability of immobilized enzyme
2.3 固定化酶澄清苹果汁
图7显示了采用固定化漆酶处理苹果汁的过程,考虑到大孔吸附树脂本身也具有吸附多酚的能力,在实验中将同等质量的树脂作为对照。酶处理时间为180 min时,总酚去除率为78.1%,反应基本达到平衡。树脂本身也可以吸附酚类物质,在一定程度上起到降低总酚含量的作用,但是起主要作用的还是固定化酶。该结果优于采用聚甲基丙烯酸甲酯为载体固定化漆酶45%的去除率[21],主要原因是聚甲基丙烯酸甲酯对酚类物质没有吸附作用,AB-8大孔树脂通过吸附作用把多酚富集在漆酶的周围,有利于酶的降解反应。重复实验的结果如图8所示,可以看出经过8个批次的反应,总酚的去除率依然保持在40%以上,降低的主要原因可能是降解总酚所产生的不溶性聚合物堵塞了树脂孔径或者覆盖在酶的表面,影响了催化反应的进行。
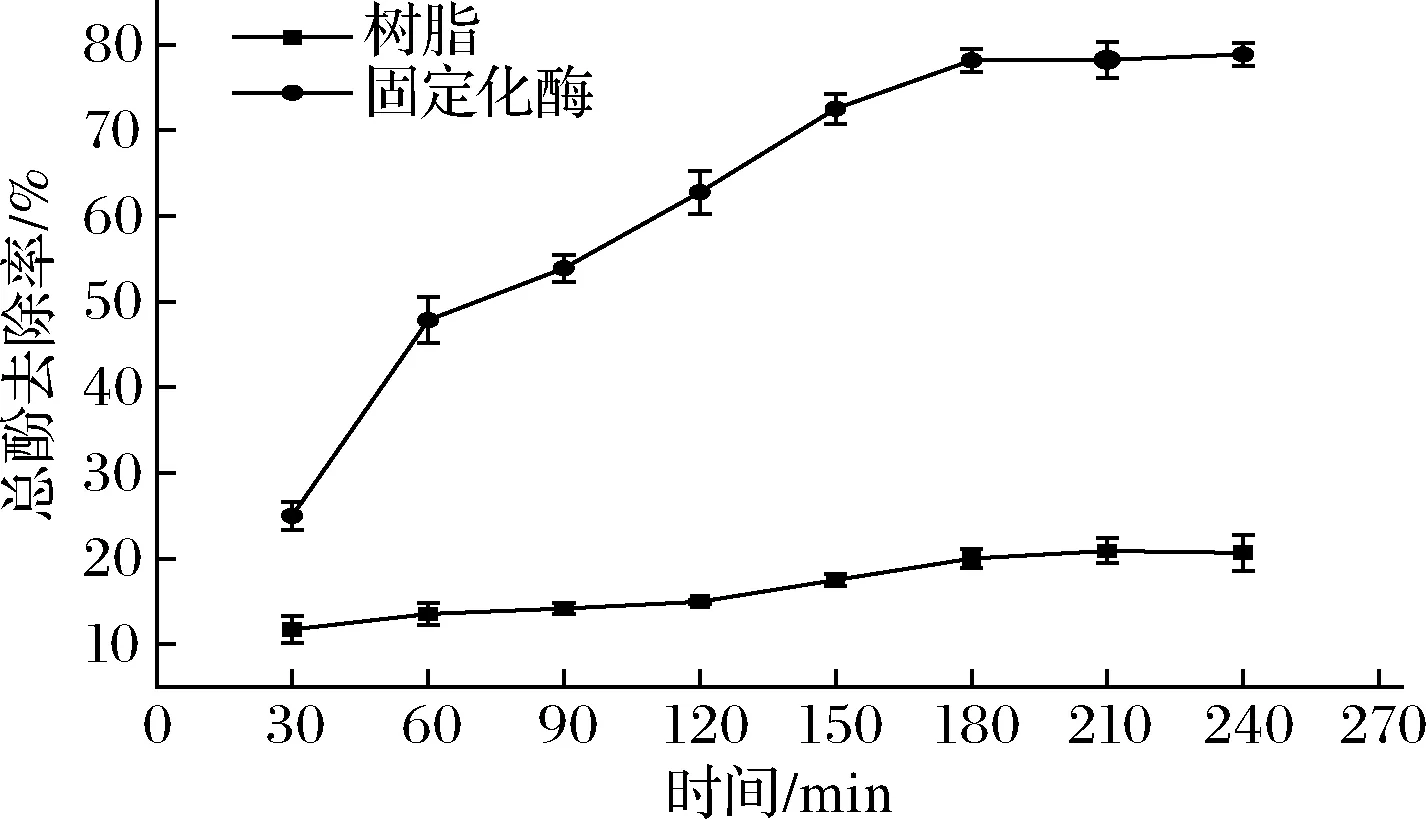
图7 固定化酶去除总酚的过程曲线Fig.7 Process curve of total phenol removal by immobilized enzyme
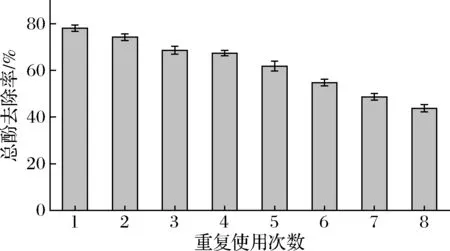
图8 固定化酶重复使用性能Fig.8 Reusability of immobilized enzyme
将经固定化酶处理后的苹果汁巴氏杀菌后放置在25 ℃考察其稳定性,并将没有经过酶处理的苹果汁作为对照,实验结果如图9所示。随着贮存时间延长,未处理的果汁中总酚含量逐渐降低,到第14天果汁中总酚含量降低了50%左右,这是由于总酚与果汁中的蛋白相结合形成了沉淀。沉淀的产生使果汁变浑浊,其浊度上升了20多倍,固定化酶处理后的果汁总酚含量较少,只有微量的沉淀产生,浊度仅比开始上升1倍多,肉眼基本不可见。可见,经过固定化漆酶处理后苹果汁的稳定性有了极大地提高。
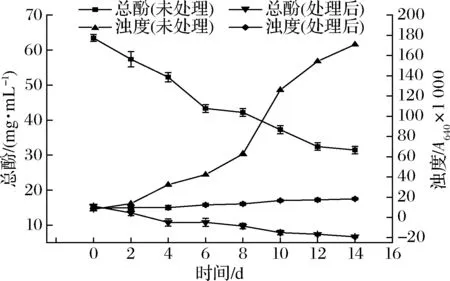
图9 酶处理后苹果汁的稳定性Fig.9 Stability of apple juice after enzymatic treatment
3 结论
首次将TGase作为交联剂应用在漆酶的固定化中,在pH 4.0、吸附温度30 ℃、吸附时间4 h、漆酶的用量为10 mL/g树脂以及TGase用量为200 U/g树脂、pH 4.0、交联温度30 ℃、交联时间2 h条件下,吸附-交联法制备的固定化酶的酶活力可达到210 U/g。
固定化漆酶对苹果汁中的多酚类化合物具有良好的去除作用,总酚去除率为78.1%,连续使用8个批次后,去除率依然保持在40%以上。
通过对苹果汁稳定性研究表明,在14 d的时间内,未处理的果汁浊度上升20多倍,而经过固定化酶处理后的果汁浊度仅上升1倍多,果汁基本保持澄清。本研究为果汁加工行业提供了一个保持果汁澄清的新方法。
