应用UPLC分析荔枝果皮、假种皮可溶性糖和有机酸组分的变化
2021-11-16蔡灿军郭志雄潘腾飞尤有利郭雅倩潘东明佘文琴陈桂信潘鹤立福建农林大学园艺学院福州5000福建农林大学园艺产品贮藏保鲜研究所福州5000福建省永春县农业技术推广站福建永春6600
蔡灿军,郭志雄,,潘腾飞,,尤有利,郭雅倩,李 瑞,潘东明,,佘文琴,,陈桂信,,潘鹤立,(福建农林大学园艺学院,福州 5000;福建农林大学园艺产品贮藏保鲜研究所,福州 5000;福建省永春县农业技术推广站,福建 永春 6600)
0 引言
可溶性糖和有机酸是构成水果风味的基本成分。作为基础物质,糖、酸组分广泛参与糖酵解、三羧酸循环等一系列基础代谢活动,为机体提供能量,同时也为机体重要有机物的合成提供原料。荔枝果实中可溶性糖组分主要包括果糖、葡萄糖和蔗糖[1-3]。根据果实中还原糖和蔗糖的比例可将荔枝品种分为以蔗糖积累为主的蔗糖积累型(还原糖/蔗糖<1),以还原糖积累为主的还原糖积累型(还原糖/蔗糖>2)以及还原糖与蔗糖比例相当的中间积累型(1<还原糖/蔗糖<2)[4]。目前可溶性糖的测定方法主要包括比色法(蒽酮、二硝基水杨酸)和液相色谱法。传统的比色法测糖方法特异性差,无法区分不同类型的糖[5]。液相色谱法过柱后通常使用示差检测器(RID)或者蒸发光散射检测器(ELSD)分析可溶性糖组分。与后者相比,前者对温度和流速较敏感,易受溶剂峰干扰、基线不稳定。超高液相色谱-蒸发光散射检测器法(UPLC-ELSD)集合了UPLC灵敏度高、分离效果好、分析速度快、操作简单和ELSD对温度和流速不敏感、无溶剂峰干扰、基线稳定等优势,能更好地应用于可溶性糖组分的分离和定量分析[5]。
荔枝果实假种皮有机酸主要含苹果酸、酒石酸等组分[6],而果皮中的有机酸则未见报导,其组分组成不明。目前常用的有机酸测定方法主要有分光光度法、气相色谱法、液相色谱法以及液相色谱-串联质谱法等。分光光度计法检出限高(>1 mg/L),无法检测出微量有机酸[7];气相色谱法在有机酸检测时需要通过酯化的方法对有机酸进行衍生化,步骤繁琐[8];液相色谱法往往易受杂质干扰而影响有机酸组分的定性定量分析;通过色谱分离联合质谱分析,能同时利用保留时间和离子分析对有机酸组分进行定性和定量,从而确保测定结果的准确性。而超高液相色谱-质谱法(UPLCMS)具有样品消耗少、灵敏度高、选择性强、分离效果好、检出限低等优点。目前已被广泛应用到许多领域,例如天然产物分析、食品分析、生化分析等[4]。
荔枝(Litchi chinensis)是中国南亚热带名优果树,其产量和面积均居世界首位。前人对荔枝果肉的糖、酸组分已有相关的研究分析[7,9-11]。荔枝果实构造特殊,其果肉源于假种皮,果皮源于子房壁,两者联系并不紧密,相对独立。而果皮与果实的成熟着色、采后衰老(褐变)直接相关[12-15]。目前关于荔枝果皮糖、酸组分的资料缺乏,本研究期望利用UPLC建立适合荔枝果皮和假种皮(果肉)可溶性糖、有机酸组分的测定方法,对糖酸组分进行初步的分析比较,以期为后续的果实生长发育和采后劣变等研究工作奠定基础。
1 材料与方法
1.1 材料与试剂
植物材料‘乌叶’和‘兰竹’荔枝采自福建省漳州市,分别于盛花后60天和90天采摘发育期果实和商品成熟果。果实样本于当天早晨采摘,置于薄膜袋,放入保温箱,衬碎冰运回实验室。挑选无病虫害,无碰撞,发育一致的果实。小心剥取果皮,用大量去离子水冲洗,滤纸吸干,剪取果皮2.0 g,装于锡箔纸放入液氮中速冻;用洁净的手术刀片切取假种皮2.0 g,装于锡箔纸放入液氮中速冻。样品置于-80℃冰箱保存备用。试验在福建农林大学园艺产品贮藏保鲜研究所,于2019年5—6月进行。
有机酸标样丙酮酸(≥88.0%)、草酸(≥99.0%)、乳酸(≥88.0%)、富马酸(≥99.0%)、琥珀酸(≥99.0%)、草酰乙酸(≥99.0%)、苹果酸(≥99.0%)、酒石酸(≥99.0%)、莽草酸(≥99.0%)、奎尼酸(≥99.0%)、柠檬酸(≥99.0%),可溶性糖标样果糖(≥99.0%)、葡萄糖(≥99.0%)、蔗糖(≥99.0%)均购于上海生工生物工程公司。甲酸、氨水、无水乙醇购自国药化工公司。甲醇、乙腈购自美国默克公司。
1.2 方法
1.2.1 荔枝可溶性糖和有机酸提取 可溶性糖和有机酸的提取参照张弦[16]、王海波等[17]和王西成等[18]的方法但略有改动。取2 g冻样,加入80%乙醇20 mL进行匀浆,80℃水浴30 min,15000×g离心15 min。转移上清液,沉淀继续加80%乙醇10 mL,涡旋悬浮,15000×g离心15 min,重复两次,合并上清。提取液于55℃恒温水浴蒸干,加入2 mL超纯水溶解残渣,离心得上清,-40℃保存备用。
1.2.2 UPLC-ELSD测定可溶性糖 可溶性糖UPLCELSD的建立参考龚江美[19]的方法但略有改动。超高效液相色谱仪Waters ACQUITY,蒸发光散射检测器Altech ELSD 3300,色谱柱ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm),柱温 35℃,流速0.2 mL/min,进样量2 μL。采用梯度洗脱,流动相A为0.2%氨水,流动相B为乙腈,梯度程序:0~14 min,16%溶剂A;14~14.5 min,16%~5%溶剂A;14.5~20 min,5%溶剂 A;20~20.5 min,5%~16%溶剂 A;20.5~30 min,16%溶剂A。ELSD条件:漂移管温度50℃,气体流量1.5 L/min。
1.2.3 UPLC-MS测定有机酸 超高效液相色谱仪Waters ACQUITY,检测器Waters TUV-QDA;色谱柱ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm),柱温35℃,流速0.2 mL/min,进样量2 μL。采用梯度洗脱,流动相A为0.1%甲酸水,流动相B为甲醇,梯度程序:0~6 min,100%溶剂A;6~8 min,100%~0%溶剂A;8~10 min,0%溶剂 A;10~11 min,0%~100%溶剂 A;11~15 min,100%溶剂A。MS采用负离子模式检测,Mass采集范围0~300m/z。
1.2.4 标准溶液配制 精密称量可溶性糖标准品,配制成浓度为2~0.25 mg/mL的混标。精密称量有机酸标准品,将丙酮酸、草酸、乳酸、草酰乙酸、苹果酸、酒石酸、莽草酸、奎尼酸、柠檬酸配制成浓度为1 mg/mL的混标,将富马酸、琥珀酸配制成500 μg/mL和100 μg/mL的混标。标样经0.22 μm微孔滤膜过滤后,色谱瓶中保存备用。
2 结果与分析
2.1 UPLC-ELSD条件优化及线性相关分析
试验对比了不同比例的流动相(乙腈:0.2%氨水),包括75:25、84:16以及90:10。结果表明,当水相占比为25%时,可溶性糖的3个组分在8 min内全部出峰,但果糖和葡萄糖分离不完全;而当水相占比为10%时,呈现不利效应,组分延迟至22 min才全部出峰,洗脱峰也明显变宽;84:16的流动相比例显示结果理想。在此基础上,尝试将氨水浓度调整为0.1%,结果显示其对组分洗脱出峰不利,出现平顶峰和峰型分叉现象。
试验同时也对比了0.1、0.2、0.3 mL/min等不同流速对组分峰分离的影响。结果表明,随着流速的增加,目标组分的出峰时间更短;但当流速大于0.2 mL/min时,柱压显著上升,接近仪器设定的柱压峰值。对比了25℃及35℃柱温对3种可溶性糖组分的影响,结果表明,柱温升高会缩短目标组分保留时间,样品峰形变窄,基线更为平稳,无目标组分出现拖尾现象,因此最终确定柱温为35℃。经过上述比较,将UPLC-ELSD条件确定为:流动相水相的氨水浓度0.2%,乙腈与氨水的比例84:16,流速0.2 mL/min。柱温35℃。
将浓度范围为0.25~2 mg/mL的可溶性糖混标进行UPLC-ELSD分析,结果显示,果糖保留时间(RT)为4.3 min,葡萄糖RT为5.4 min,蔗糖RT为9.1 min。根据峰面积(y)与质量浓度(x)得到可溶性糖组分的标准曲线方程(表1)。相关性分析结果显示,3个可溶性糖组分测定的相关系数介于0.992和0.997之间,表明所测组分在该范围内保持良好的线性。将样品可溶性糖提物液进行UPLC-ELSD分析,结果显示,样品中各组分分离行为与标样一致。

表1 可溶性糖标样的回归方程
2.2 UPLC-MS条件建立及有机酸组分分析
将有机酸混标进行UPLC-MS分析,结果表明,负离子模式下,丙酮酸m/z为87,RT为1.26 min;草酸m/z为89,RT为0.94 min;乳酸m/z为89,RT为1.73 min;富马酸m/z为115,RT为1.37 min;琥珀酸m/z为117,RT为3.07 min;草酰乙酸m/z为131,RT为1.17 min;苹果酸m/z为133,RT为1.36 min;酒石酸m/z为149,RT为1.06 min;莽草酸m/z为173,RT为1.47 min;奎尼酸m/z为191,RT为1.14 min;柠檬酸m/z为191,RT为2.37 min。各有机酸组分离子峰型都较好,在4 min内全部出峰。将不同的荔枝有机酸粗提物样品进行UPLC-MS分析,结果显示,共检出草酸、富马酸、琥珀酸、苹果酸、酒石酸、莽草酸、奎尼酸和柠檬酸等8种有机酸,而丙酮酸、乳酸和草酰乙酸等3个组分不能检出;样品有机酸各组分的分离行为与标样一致。
2.3 荔枝果实中的可溶性糖组分
测定结果(表2)显示,‘乌叶’和‘兰竹’发育期果实果皮可溶性糖组分中蔗糖含量为最高,葡萄糖、果糖含量次之,果皮还原糖总量与蔗糖相当。成熟果果皮可溶性总糖含量上升,果糖积累显著,含量超过蔗糖;葡萄糖有所增加,而蔗糖含量则略有下降。2个品种表现基本一致。进一步分析还原糖与蔗糖的比值,结果显示,两者还原糖:蔗糖的比例显著上升,‘乌叶’总体上升接近2倍,‘兰竹’则上升接近3倍,表明还原糖在成熟荔枝果皮中显著积累。

表2 ‘乌叶’‘、兰竹’果实中可溶性糖含量 mg/(g·FW)
对假种皮的分析结果显示,发育期果实果糖、葡萄糖和蔗糖3个可溶性糖组分的含量非常接近。但至果实成熟,品种间差异显著。‘乌叶’假种皮3个可溶性糖组分均显著积累;而‘兰竹’假种皮仅蔗糖含量大幅上升,果糖和葡萄糖则增加很少。进一步分析还原糖与蔗糖的比值发现,两者比值均明显低于1,表明‘乌叶’和‘兰竹’均为蔗糖积累型果实(表2)。
2.4 荔枝果实中的有机酸组分
果皮有机酸组分的UPLC-MS定量结果显示,‘乌叶’和‘兰竹’荔枝发育期果实果皮有机酸组分均以莽草酸和奎尼酸为主,两者合计接近有机酸总量的90%,其次是苹果酸、富马酸、柠檬酸和酒石酸。成熟果果皮莽草酸和奎尼酸含量均下降,其中莽草酸下降显著,总体降幅超过50%,但两者合计仍占有机酸总量的75%。成熟果实果皮中苹果酸、富马酸、柠檬酸和酒石酸含量均有所上升。琥珀酸含量一直很低且基本保持不变,草酸则仅在‘兰竹’荔枝发育期果实果皮中有少量检出。总体上,至果实成熟,荔枝果皮有机酸总量明显下降(表3)。

表3 ‘乌叶’‘、兰竹’荔枝果皮有机酸含量 mg/(g·FW)
对假种皮的分析结果显示,‘乌叶’和‘兰竹’荔枝均以积累苹果酸为主,其次是富马酸,约为苹果含量的1/2,两者合计占有机酸总量的90%。至果实成熟,两者均显著下降,但仍占有机酸总量的83%。莽草酸和奎尼酸含量在果实发育初期仅次于苹果酸和富马酸,但至果实成熟,均下降到不能检出。草酸和柠檬酸含量在发育期果实中紧随其后,至果实成熟草酸呈明显上升趋势,而柠檬酸含量则下降。此外,琥珀酸仅发现于发育期果实假种皮,且含量低。与发育期果实相比,成熟果实假种皮的有机酸总量显著下降(表4)。
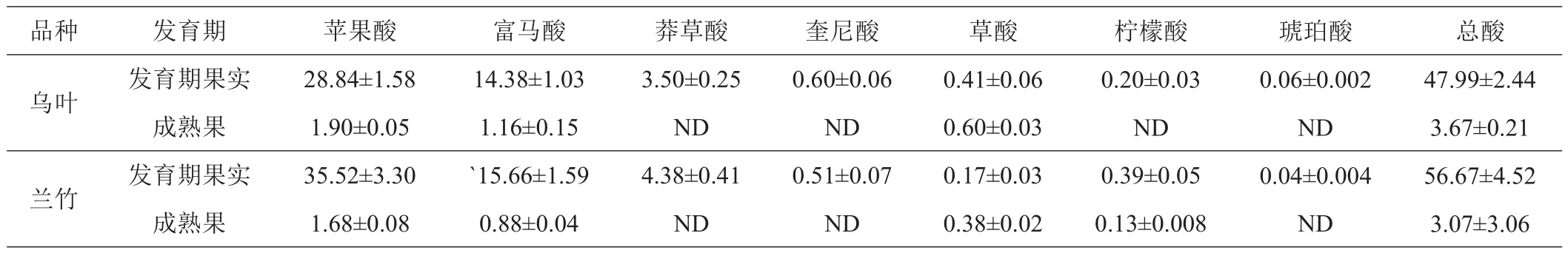
表4 ‘乌叶’‘、兰竹’荔枝假种皮有机酸含量 mg/(g·FW)
3 讨论
3.1 可溶性糖及有机酸UPLC方法的建立
前人研究已指出,与传统果实糖酸测定方法相比,液相色谱法能更好地应用于果实中糖酸组分的分离和定量分析。已有的研究报道显示,荔枝果实可溶性糖组分的高效液相色谱(HPLC)柱后大多采用RID进行定量[11,20];相比较而言,采用ELSD检测具更高的灵敏度和更好的稳定性[5,21-22]。应用HPLC法测定荔枝果实中的有机酸[11,20,23],容易因组分分离不完全,杂质干扰等因素而影响定量;而通过色谱分离结合MS技术,可综合运用保留时间和物质组分的离子分析,能更好地保证其定性及定量结果的准确性[7,24-25]。与HPLC相比,UPLC具消耗少、灵敏度高、分离效果好等优点。本研究利用UPLC-ELSD建立了适合荔枝果皮和假种皮可溶性糖的定量检测方法,利用UPLC-MS建立了适合荔枝果皮和假种皮有机酸的定量检测方法,结果显示,各组分分离行为好,可溶性糖组分在10 min内全部出峰,有机酸组分在4 min内全部出峰。
3.2 不同发育阶段果实可溶性糖的变化
本研究首次分析了荔枝果皮的可溶性糖组分,发现在荔枝发育期果实的果皮中,可溶性糖以蔗糖含量最高,还原糖与蔗糖之比约为1。而至果实成熟,果糖含量显著上升,还原糖与蔗糖的比例均远大于1。表明荔枝在成熟过程中果皮蔗糖的降解或转运趋于活跃。而在‘乌叶’和‘兰竹’荔枝发育期果实的假种皮中,可溶性糖各组分的含量非常接近,这与前人研究结果相似[10,26];但至果实成熟,则是蔗糖含量最高,还原糖与蔗糖的比值均明显低于1,表明两者均为蔗糖积累型品种。
3.3 不同发育阶段果实有机酸的变化
本研究首次对荔枝果皮的有机酸组分进行了分析,发现果皮富含莽草酸和奎尼酸,且占比很高。发育期果实果皮中莽草酸和奎尼酸约占总有机酸的90%,至果实成熟时含量有所下降,但仍占有机酸总量约75%。莽草酸和奎尼酸可经代谢转入苯丙烷次生代谢途径[27-29]。前人的研究已显示,荔枝果皮含有丰富的黄烷醇及其寡聚物、花色苷、黄酮类等丰富的多酚类次生代谢物[30-32]。该现象可能暗示莽草酸及其变化与荔枝果皮的多酚类生物合成有关,而这有待进一步的研究揭示。另外,与发育期果实相比,成熟果果皮的苹果酸、富马酸、柠檬酸等组分均显著增加。花色苷是荔枝果实成熟着色最主要的色素物质,其作为一类水溶性色素,主要存在于细胞的液泡[33]。这些有机酸组分的积累是否与花色苷的生物合成及果皮着色有关,亦待进一步的研究。
Paull等[34]曾报道,成熟荔枝假种皮主要有机酸为琥珀酸。但本研究结果表明,2个供试品种均以苹果酸积累为主,琥珀酸仅在发育期果实假种皮中有少量积累,在成熟果中并未检出,这与前人[35-36]研究结果一致。胡志群等[11]利用高效液相色谱发现荔枝果肉中主要有机酸是苹果酸和酒石酸,此外还有少量的抗坏血酸和草酸。Somboonkaew等[23]利用高效液相色谱也发现荔枝果肉中的主要有机酸是苹果酸,还记录了低浓度草酸、酒石酸、抗坏血酸和柠檬酸。这些结果都指向了荔枝果肉主要有机酸为苹果酸,且有机酸种类和含量依品种和产地的不同而不同。此外,王思威等[7]通过高效液相色谱-三重四级杆串联质谱技术对5个荔枝品种的有机酸进行检测,均检测到了高浓度的乳酸,且含量仅次于苹果酸。笔者对发育期果实和成熟果的分析均未检出乳酸,只是在采后低氧贮藏的果实中发现了乳酸的显著积累(未发表数据),显示其可能与采后发酵代谢有关。
4 结论
本研究建立了荔枝果实可溶性糖、有机酸组分的UPLC定量方法,应用该方法首次分析了不同发育阶段果皮糖、酸组分的变化,并与假种皮进行比较后发现,果皮有机酸组分显著异于假种皮。且两者在生长发育过程中可溶性糖和有机酸组分存在不同的消长变化。
