USP9X在乳腺癌中的表达与EGFR相关性的研究 ①
2021-11-16张赫男
金 堃,周 昱,张赫男
(佳木斯大学,黑龙江 佳木斯 154007)
乳腺癌是乳腺外科常见的恶性肿瘤,其发病率呈逐渐上升趋势,据统计2015年乳腺癌的发病率位居女性恶性肿瘤首位。其作为一种复杂的异质性肿瘤,临床上仍然需要根据它的病理学分级、临床分期以及分子分型制定因人而异的系统的治疗方案[1]。探索乳腺癌的发生及发展过程仍显得尤为重要,将为乳腺癌患者提供精准的临床诊断和治疗[2]。USP9X是最大的泛素特异性蛋白酶家族的一员,文献报道USP9X在一些恶性肿瘤中高表达[3,4],且表达程度与预后呈负相关,因其去泛素化作用,可能对EGFR激活后的正常降解起一定作用,促使EGFR激活后持续异常表达。EGFR除了在肺癌、肠癌中表达外,在部分乳腺癌中也呈现阳性表达甚至高表达,在三阴性乳腺癌中的阳性表达尤为突出,循证医学Meta分析表明,EGFR影响三阴性乳腺癌的预后。本实验检测USP9X和EGFR在乳腺癌中的表达,分析其在乳腺癌发生发展过程中的意义,为乳腺癌的发生机制和治疗提供一定的借鉴意义。
1 资料与方法
1.1 一般资料
从佳木斯大学附属第一医院病理科调取2018-12~2019-07经病理学确诊的乳腺浸润性导管癌和癌旁正常组织蜡块各50例,性别为女性,排除经过术前治疗的病理资料,患者住院病历资料均在本院病案室及病理科存档,并且确认临床病历资料完整(住院病历完整,病理标本及其免疫组化结果完整)。
1.2 方法
兔抗人USP9X多克隆抗体购于affinity,兔抗人EGFR即用型抗体购于北京中杉金桥;与一抗相匹配的二抗、山羊血清、Tween 20、DAB显色剂 、抗原修复液、苏木素染液等;实验器材及图文系统等均由本院病理科提供。
标本按理想实验要求切片;60℃烤箱烘烤1h;二甲苯分梯度脱蜡;再用梯度酒精脱去二甲苯;PBS和蒸馏水冲洗;置于EDTA抗原修复液pH 9.0高温高压抗原修复;切片至Tween 20,浸泡震荡冲洗去污;切片至于3%的H2O2中灭活内源性酶及封闭内源性生物素,山羊血清抗原封闭;滴加1:25浓度的USP9X一抗、滴加即用型EGFR一抗,常规孵育;滴加与一抗相匹配的二抗,再次孵育;每一步之间用PBS冲洗3次,每次3min;滴加显色剂,显微镜下控制显色时间,用蒸馏水充分冲洗;苏木精复染细胞核;封片,光学显微镜下观察结果。阳性结果判定由本院两位病理科资深医师在高倍镜视野下,进行阳性结果判定;最终结果分为:阳性表达、高表达和低表达。
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析,采用χ2检验;相关性采用Spearman相关分析,r值正数为正相关,P<0.05为有统计学意义。
2 结果
2.1 USP9X在乳腺癌和癌旁组织中的表达
USP9X与EGFR染色定位于细胞质及细胞膜,在癌组织中高表达(见图1A、B),在正常组织中低表达或者不表达(见图1C、D)。在乳腺癌中USP9X和EGFR蛋白阳性表达率与正常组织相比较,差异具有统计学意义(P<0.05 )。见表1。

表1 乳腺癌癌组织及正常组织中USP9X和EGFR蛋白阳性表达率比较[n=50,n(%)]

图1 USP9X和EGFR蛋白的表达(×400)
2.2 USP9X和EGFR表达与乳腺癌临床病理因素的关系
在乳腺癌中,USP9X、EGFR蛋白的表达与患者的年龄及肿瘤大小差异无统计学意义(P>0.05),与临床分期、组织学分级,淋巴结转移差异有统计学意义(P<0.05);EGFR蛋白的表达与是否为三阴性乳腺癌差异有统计学意义。见表2。

表2 USP9X和EGFR表达与乳腺癌临床病理因素的关系
2.3 USP9X与EGFR 蛋白表达的相关性
相关性分析表明,在乳腺癌组织中USP9X与EGFR蛋白的表达水平呈正相关性(r=0.311,P<0.05)。见表3。
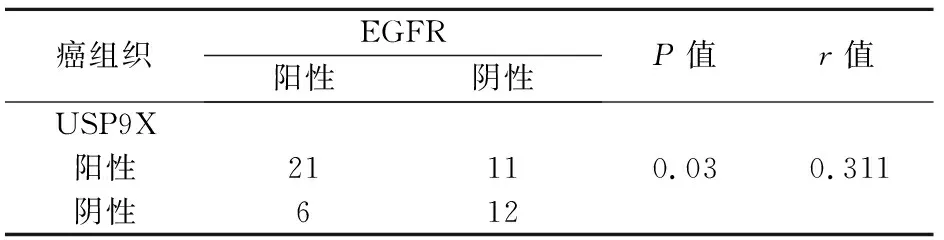
表3 乳腺癌组织中USP9X和EGFR表达的相关性分析结果
3 讨论
众所周知,肿瘤的发生和发展,是多基因、多机制、多步骤、多阶段的,连续过程。其中周期性作用蛋白及信号传导蛋白完成作用后未能正常降解,使得废弃的蛋白以及应该被降解的信号传导通路蛋白未被降解,导致细胞持续生长以及分裂,因而导致肿瘤的形成。这其中去泛素化的高表达,作用其底物蛋白,使底物蛋白本身,或者中间途径的相关蛋白受到其调节,最终未能进入泛素—蛋白酶体途径或者溶酶体途径被降解,最终导致疾病的发生。
人类基因组大约编码有95个DUB家族,最大的去泛素化酶家族是泛素特异性蛋白酶家族(USP)。USP9X由N端的核定位序列和蛋白样结构域组成,C末端具有催化USP特异性半胱氨酸和组氨酸催化残基。它属于USP家族,调节参与细胞内各种蛋白质的胞吞胞吐作用、稳定性 、细胞粘附、细胞的生长和迁移、自噬、以及细胞凋亡等。泛素化酶USP9X能通过活性硫醇位点将泛素与靶蛋白拆分开来[5]。解除和分离底物蛋白上的多聚泛素键,防止泛素在底物蛋白聚集,起到去泛素化作用[6]。USP9X表达的遗传突变和异常调节涉及多种人类疾病,包括神经障碍和癌症 ,例如肝癌和肺癌[7,8]。有研究报道,USP9X通过抑制MCL-1泛素化和蛋白酶体降解与MCL-1蛋白相互作用并稳定MCL-1蛋白,而USP9X的敲低和化学抑制均已显示出有效促进癌细胞凋亡。肿瘤细胞的增殖,凋亡,耐药和转都与USP9X紧密相关[9~11]。到目前为止,已有大约40种蛋白质被鉴定为USP9X相互作用蛋白质,其中超过20种蛋白质被鉴定为USP9X去泛素化底物。
EGFR是一种存在于人体多种细胞膜上的糖蛋白,属于表皮生长因子家族,又名HER-1。目前在非小细胞肺癌、头颈部和宫颈鳞癌、结直肠癌等多种恶性肿瘤中都发现了EGFR的表达。在通常情况下,EGFR以单体的形式存在,当其与配体发生结合后,将优先与HER-2结合形成异源二聚体,同时也可以与另一HER-1结合形成同源二聚体,但是与HER-2结合形成的异源二聚体功能远强于其与HER-1结合形成的同源二聚体,最关键的是异源二聚体相比较同源二聚体在细胞膜上停留的时间较长,而且不容易被泛素化正常降解,并且发生再循环,因而延长了生长信号。当配体与受体结合后即可触发内吞作用,泛素化连接酶Cbl在触发受体介导的内吞作用中起重要作用,有研究报道最终归于溶酶体降解途径[12]。但是,也有研究报道EGFR与配体相结合后可以同时发生内化和泛素化,即也可以同时通过泛素-蛋白酶体途径降解。USP9X能够通过去泛素化多个内吞E3连接酶来调控蛋白质转运。E3连接酶Itch通过促进细胞内吞蛋白和Cbl(E3连接酶)的蛋白酶体降解来拮抗活化的EGFR向溶酶体的内化和运输[13~15]。
结合本实验结果,USP9X和EGFR的表达水平与乳腺癌的临床分期、组织学分级、淋巴结转移密切相关,并且两者在统计学上呈正相关性;两者不仅各自在一定程度上参与了乳腺癌的发生和发展及预后,同时USP9X通过去泛素化多个内吞E3连接酶促进在触发受体介导的内吞作用的Cbl在蛋白酶体的降解,最终使EGFR不能通过溶酶体途径降解;同时也推断USP9X具有直接去泛素化EGFR的作用,使其不被泛素—蛋白酶体途径降解;最终增强信号传导,延长信号传导时间。结合研究报道并且推断,两者的高表达及相关性有可能是三阴性乳腺癌化疗耐药的潜在机制。最终得出结论:USP9X和EGFR与乳腺癌的发生、进展、治疗及预后相关,为乳腺癌的研究提供新的方向。
