小檗碱靶向HDAC/H3K9ac/KLF4抑制棕榈酸诱导的HepG2脂肪变性体外实验研究*
2021-11-16李经纬王子璇王梦雨黄瑞贤信丰智范建高汪保灿
李经纬,王子璇,王梦雨,黄瑞贤,信丰智,范建高,汪保灿
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)可以导致2型糖尿病、肝硬化和肝癌及其肥胖相关癌症等的发生[1-4]。小檗碱(berberine, BBR)是一种天然的异喹啉类生物碱,存在于小檗、黄连、黄柏等多种药用植物中。近年来有研究发现,BBR可以缓解NAFLD[5,6],减轻NAFLD患者肝组织脂肪变,同时也可以改善胰岛素抵抗(IR)、治疗代谢综合征、降低胆固醇等。组蛋白去乙酰化酶(histone deacetylase,HDACs)是一类蛋白酶,在染色体的结构修饰和基因表达调控过程中发挥着重要的作用[7]。在高脂饮食诱导的NAFLD模型小鼠,可以通过抑制肝组织HDAC活性,使组蛋白H3第9位赖氨酸乙酰化(histone H3 lysine residue 9 acetylation,H3K9ac)显著增加,从而有利于DNA与组蛋白八聚体的解离,使各种转录因子和协同转录因子能与DNA结合位点特异性结合,激活基因转录[8]。H3K9ac水平升高可以通过促进过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α, PPARα)的活化,从而激活脂肪酸β氧化,缓解NAFLD病变[9]。BBR可以显著抑制葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)诱导的小鼠脾细胞HDAC活性,起到近似于HDAC抑制剂曲古菌素A(trichostatin A,TSA)的作用[10]。BBR也可以显著抑制人类肺癌细胞系A549细胞HDAC的表达[11]。Krüppel样因子4 (Krüppel-like factor4,KLF4)是一种锌指结构的转录因子,在NAFLD患者肝组织KLF4表达水平较正常人显著下降[12]。KLF4可以通过阻断Apelin信号通路抑制急性肝损伤时的肝细胞脂肪变性13]。KLF4表达增加抑制了游离脂肪酸(free fatty acids,FFAs)诱导的脂肪细胞炎症反应[14]。在白血病细胞K562和人食管癌细胞系KYSE150等细胞系H3K9ac水平增加可使KLF4表达水平显著增加[15]。本研究应用棕榈酸(palmitic acid,PA)诱导HepG2细胞构建NAFLD细胞模型,观察了BBR对细胞HDAC1、H3K9ac、KLF4、SREBP-1c和PPARγ表达的影响,现报道如下。
1 材料与方法
1.1 细胞与试剂 人肝癌细胞株HepG2来自于美国模式菌收集中心(American type culture collection,ATCC);BBR(Sigma公司);PA(Sigma公司);Lipofectmin 2000(Invitrogen公司);抗-HDAC1 (武汉谷歌生物);抗-H3K9ac(Abcam公司);抗-KLF4(Proteintech公司);抗- SREBP-1c(Proteintech公司);抗- PPARγ(武汉谷歌生物);pEX-3-HDAC1过表达质粒(Ov-HDAC1)和SiRNA-KLF4-1/2(上海吉玛基因);油红O(Sigma公司);检测TNF-α、IL-1β和IL-6 的ELISA 试剂盒(Solarbio公司);EZ-ChIP试剂盒(Millipore公司)。
1.2 细胞培养 取HepG2细胞,随机分为对照组、模型组和药物干预组。以2×105接种于6孔板(2 ml/孔),培养24 h,用200 μM PA刺激培养24 h。在BBR处理组,用完全培养基将20 mM BBR储存液配置成为20 μM BBR工作液。取HepG2细胞,以2×105接种于6孔板(2 ml/孔)培养24 h,弃去原培养基,加入20 μM BBR工作液2 ml,继续培养24 h。质粒和small interfering RNA转染:取HepG2细胞,以2×105接种于6孔板,培养24 h。随机分为HDAC1过表达质粒转染组(Ov-HDAC1)、空质粒转染组(Ov-NC)、SiRNA-KLF4-1转染组(SiRNA-KLF4-1)、SiRNA-KLF4-2转染组(SiRNA-KLF4-2)和SiRNA-NC转染组(SiRNA-NC)。在转染前,弃去6孔板中含有血清的培养基,用PBS冲洗1~2次,加入Opti-MEM 培养基(1500 μl/孔)。取Lipofectamine 2000转染试剂5 μl和质粒DNA 3 μg分别与opti-MEM培养基250 μl混合(使用同样的方法转染SiRNA),混匀后静置10 min,将两者再混匀后静置20 min,在每个孔中加入混合液500 μl,培养6 h,更换完全培养基继续培养。
1.3 细胞蛋白表达检测 采用Western blot法,收集细胞,提取总蛋白,采用BCA法定量检测蛋白浓度。按照Western blot步骤对蛋白样品电泳和电转移,用5%牛奶封闭1 h,加入一抗,4℃孵育过夜。次日,加二抗,室温下孵育1 h,使用ECL发光试剂盒显色,进行显色、扫描、拍照,分析蛋白条带灰度。
1.4 HepG2细胞脂质沉积检测 使用油红O染色,在显微镜下观察细胞形态和细胞内脂滴。
1.5 细胞培养上清细胞因子检测 采用ELISA法检测TNF-α、IL-1β和IL-6水平。
1.6 细胞KLF4启动子区H3K9ac水平检测 采用CHIP-qPCR法,使用EZ-ChIP试剂盒裂解HepG2细胞,超声处理,将染色质切至200~700 bp长度,离心后取上清液10 μl作为Input,其余上清液用于之后的实验。将交联的DNA与抗H3K9ac抗体和阴性对照抗IgG抗体在4℃孵育过夜。加入NaCL使DNA去交联,使用蛋白酶K消化去除蛋白质,用纯化后的DNA用于PCR试验。所用的引物由上海生工生物有限公司合成:KLF4启动子上游引物序列为5′-GAACAGGCGGAAAGAGGC-3′,下游引物序列为5′-CAGGAGAATCGCTTGGACG-3′,GAPDH上游引物序列为5′-CTCCTGCACCACCAACTGCT-3′,下游引物序列为5′-GGGCCATCCACAGTCTTCTG-3′。

2 结果
2.1 各组细胞HDACs和H3K9ac蛋白表达水平比较 PA处理显著提高了HepG2细胞HDAC1蛋白表达水平(P<0.001),而降低了H3K9ac蛋白表达水平(P<0.001);在PA诱导的HepG2细胞,BBR抑制了HDAC1蛋白的过量表达(P<0.01),而显著提高了H3K9ac蛋白的表达水平(P<0.01,图1)。

图1 各组细胞HDAC1和H3K9ac蛋白表达比较与对照组比,***P<0.001;与模型组比,##P<0.01
2.2 转染HDAC1过表达重组质粒对HepG2细胞H3K9ac水平的影响 转染HDAC1过表达重组质粒显著增加了HepG2细胞HDAC1蛋白水平(P<0.001),证实HDAC1过表达质粒转染成功。在PA诱导的HepG2细胞,加入Ov-HDAC1质粒显著降低了HepG2细胞H3K9ac水平(P<0.001,图2)。

图2 HDAC1过表达细胞H3K9ac水平变化A:转染HDAC1过表达质粒HepG2细胞HDAC1蛋白表达变化;B:转染HDAC1过表达质粒HepG2细胞H3K9ac水平变化;与Ov-NC组比,***P<0.001
2.3 BBR在PA诱导的HepG2细胞通过调节H3K9ac水平激活KLF4的表达 与对照组比,PA诱导的HepG2细胞KLF4蛋白表达显著降低(P<0.001),而BBR或丁酸钠(一种HDAC抑制剂)处理后,HepG2细胞KLF4蛋白表达显著增加(P<0.01,图3A)。此外,CHIP-qPCR检测结果显示,BBR处理后KLF4启动子区H3K9ac水平显著增加(P<0.001,图3B),提示BBR通过提高HepG2细胞H3K9ac水平激活KLF4的表达。

图3 各组细胞KLF4蛋白表达水平A:KLF4蛋白表达水平;B:两组细胞经抗H3K9ac抗体处理后KLF4启动子表达水平;与对照组比,***P<0.001;与模型组比,##P<0.01,###P<0.001
2.4 BBR在PA诱导的HepG2细胞通过激活KLF4减轻细胞脂质积聚 与SiRNA-NC处理组比,转染SiRNA-KLF4-1/2的HepG2细胞KLF4蛋白表达水平显著下降(P<0.01,图4A);与对照组比,PA诱导加剧了HepG2细胞脂质沉积;与模型组比,BBR处理缓解了PA诱导引起的脂质沉积,而KLF4的沉默逆转了BBR对HepG2细胞脂质积累的影响(图4B)。

图4 沉默KLF4基因抑制了BBR对PA 诱导的HepG2细胞脂质沉积的保护作用A:转染SiRNA的HepG2细胞KLF4蛋白表达变化;B:各组HepG2细胞脂质沉积情况(油红O,100×);与SiRNA-NC组比,**P<0.01,***P<0.001
2.5 BBR在PA诱导的HepG2细胞通过激活KLF4改善炎症反应 与对照组比,PA诱导促进了HepG2细胞炎症因子TNF-α、IL-1β和IL-6的分泌(P<0.001),而BBR处理可以显著改善PA诱导引起的炎症因子分泌(P<0.001)。同样地,沉默KLF4逆转了BBR的这种改善作用(图5)。

图5 各组细胞培养上清细胞因子水平比较与对照组比,***P<0.001;与模型组比,###P<0.001;与药物干预组比,$$P<0.01,$$$P<0.001
2.6 BBR在PA诱导的HepG2细胞通过激活KLF4调控脂质代谢相关基因表达 与对照组比,PA诱导可以显著促进HepG2细胞脂质合成相关基因SREBP-1c表达(P<0.001),同时降低脂质分解相关基因PPARγ表达水平(P<0.001);与模型组比,BBR处理显著抑制SREBP-1c表达(P<0.001),同时促进了PPARγ表达(P<0.001),而沉默KLF4削弱了BBR对脂质代谢相关基因表达的调节作用(P<0.001,图6)。
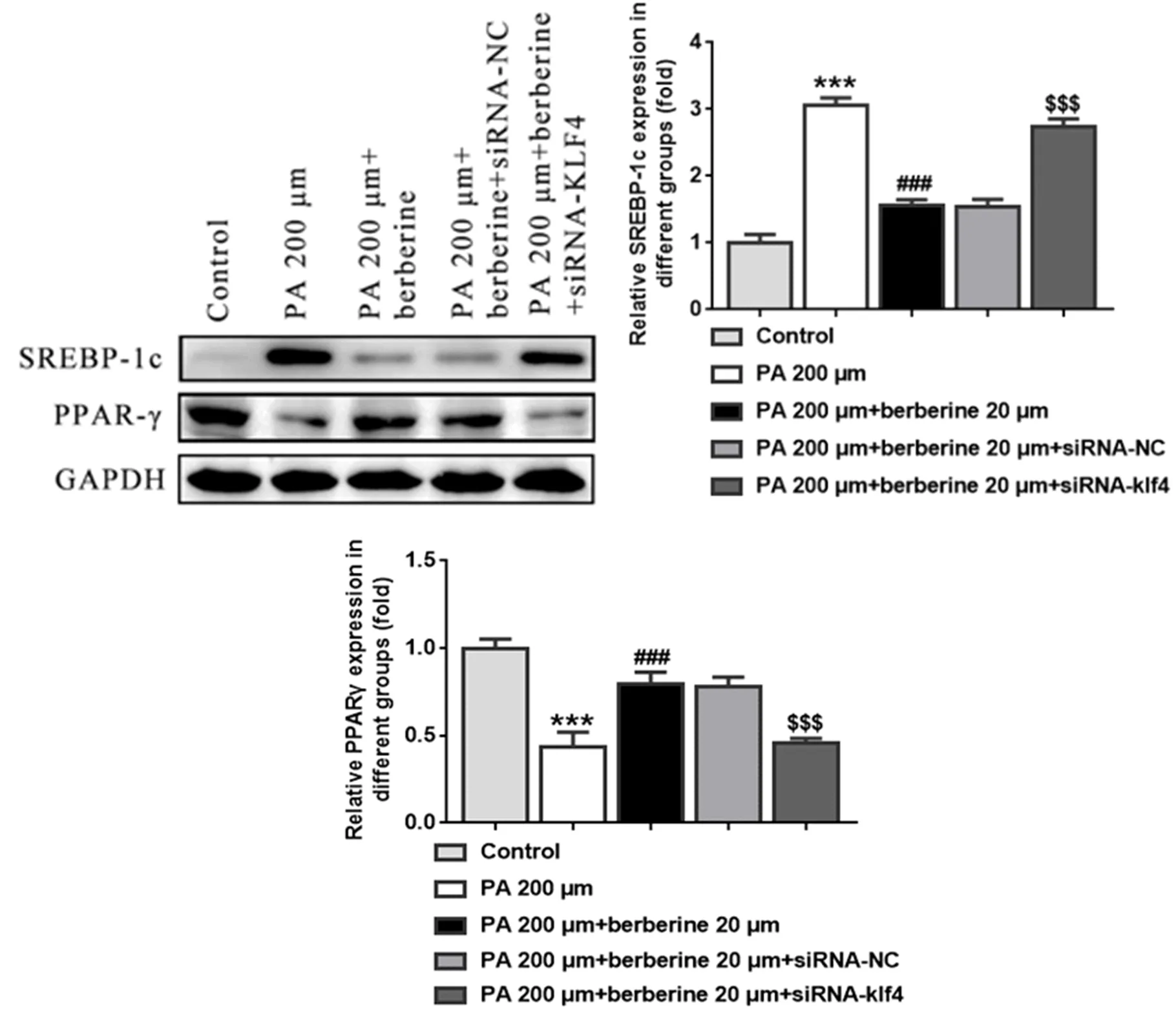
图6 各组细胞脂质代谢相关蛋白表达水平比较与对照组比,***P<0.001;与模型组比, ###P<0.001;与药物干预组比, $$$P<0.001
3 讨论
PA是FFAs的一种,可刺激细胞炎症因子的产生,促进肝细胞的脂质积累。在本研究中,我们建立了经典的PA诱导的HepG2细胞脂肪变细胞模型,发现PA诱导的HepG2细胞脂质沉积显著增加,细胞培养上清TNF-α、IL-1β和IL-6水平也显著增加,证实NAFLD细胞模型构建成功。
越来越多的证据表明,BBR能保护肝脏功能。研究发现BBR可以通过激活Nrf2/HO-1和PPARγ信号通路减轻甲氨蝶呤诱导的肝损伤大鼠氧化应激和细胞凋亡。BBR也可通过抑制炎症反应和线粒体依赖性的细胞凋亡,保护急性肝衰竭(acute liver failure,ALF) 小鼠。在本研究,我们在体外应用BBR刺激PA诱导的HepG2细胞,结果发现BBR可以显著改善PA诱导的肝细胞脂质沉积,降低细胞促炎细胞因子水平,提示BBR可以在体外缓解PA诱导的HepG2细胞脂肪变。
HDACs是一类通过组蛋白和非组蛋白去乙酰化来调控转录过程的酶家族。HDAC1可以通过调控组蛋白H3K9ac水平在同型半胱氨酸介导的脂质代谢紊乱过程中发挥关键的作用。此外,预防心血管疾病的药物洛伐他汀通过降低HDAC1表达,使H3K9ac水平增加,从而抑制巨噬细胞的炎症反应。丁酸钠(一种HDAC抑制剂)可以通过降低HDAC 1蛋白表达使H3K9ac水平上升,进而促进PPARα的活化,减轻肝脂肪变。HDAC抑制剂还能诱导肠上皮细胞、心肌细胞和血管平滑肌细胞KLF4表达,而甲基硒酸(methylseleninic acid,MSA)可以通过提高KLF4启动子区H3K9ac水平进而激活KLF4的表达。KLF4的激活可能在缓解肝脂肪变方面发挥一定的作用。在本研究,我们发现PA诱导的HepG2细胞经BBR处理后,HDAC1表达下降,H3K9ac水平升高,而HDAC1的过表达抑制了H3K9ac水平,表明HDAC1对H3K9ac的表达有调节作用。本研究还发现,BBR通过调节H3K9ac水平来提高KLF4的表达,而沉默KLF4则逆转了BBR对PA诱导的HepG2细胞脂质沉积和炎症反应的保护作用,提示KLF4的激活参与了BBR对肝脂肪变的干预作用。
