性别-年龄-肺功能分期与复合生理指数对特发性肺纤维化患者死亡风险的预测价值比较研究
2021-11-15蔡博陈娴秋杨文兰杨光红黄劲全华冯永红
蔡博,陈娴秋,杨文兰,杨光红,黄劲,全华,冯永红,5,6*
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明、进行性发展的致命性肺部疾病[1]。IPF影响着全世界近300万人,其发病率随年龄的增加而急剧升高[2]。尽管吡非尼酮和尼达尼布等新药的运用给IPF的治疗带来了希望,但IPF的疾病进展瞬息万变,IPF患者中位生存时间一般为2~3年[3],急性加重后,其生存时间会缩短至3个月内[4],死亡率依旧很高。因此,有效地构建和使用IPF死亡风险预测模型,对临床医生评估患者病情、预后及今后的临床防治工作有着重要的意义。目前已有研究表明,性别-年龄-肺功能(gender,age,and physiologic variables,GAP)评分以及GAP分期对IPF患者的死亡风险均有着较强的预测能力[5]。复合生理指数(composite physiologic index,CPI)可排除肺气肿、肺动脉高压的干扰,对IPF疾病严重程度提供更为准确的整体评估[6]。国内外研究一般仅应用其中一种模型来进行预测,而哪一种模型更具有优势或临床应用价值,目前少见报道。本研究使用同一病例数据库比较GAP分期与CPI对IPF的临床预测价值,旨在为临床医生评估IPF患者病情、预后及今后的临床防治工作提供参考。
1 对象与方法
1.1 研究对象 选取2012—2019年在同济大学附属上海市肺科医院确诊的200例IPF患者为研究对象,收集患者初次住院的病例资料,其中男181例(90.5%),女19例(9.5%);年龄41~85岁,平均年龄(66.0±7.6)岁;临床症状:咳嗽182例(91.0%)、气促107例(53.5%)、咳痰101例(50.5%)、胸痛10例(5.0%);临床体征:Velcro啰音159例(79.5%)、杵状指29例(14.5%);合并/并发症:低氧血症68例(34.0%)、心脏疾病39例(19.5%)、肺气肿33例(16.5%)、肺动脉高压25例(12.5%)、呼吸衰竭12例(6.0%)、胃食管反流症6例(3.0%)、慢性阻塞性肺疾病4例(2.0%)。入选标准:(1)符合2018年美国胸科学会(ATS)/欧洲呼吸学会(ERS)/日本呼吸学会(JRS)/拉丁美洲胸科协会(ALAT)制订的IPF诊断标准[1];(2)有完整的初次住院临床记录:基本临床资料、肺功能检查结果、肺部高分辨率CT(HRCT)检查结果、实验室检查结果;(4)同意并签署知情同意书。排除标准:(1)初次诊断与末次诊断不符;(2)临床数据不全,尤其是肺功能检查时因呛咳或气急等原因配合欠佳,未进行弥散功能检测者;(3)本研究CPI评分时需要完整的一氧化碳弥散量(DLCO)数据,因弥散功能严重减退而无法完成者;(4)进行门诊或电话随访的失访者。IPF患者的筛选流程见图1。本研究经同济大学附属上海市肺科医院伦理委员会审批(K17-006)。
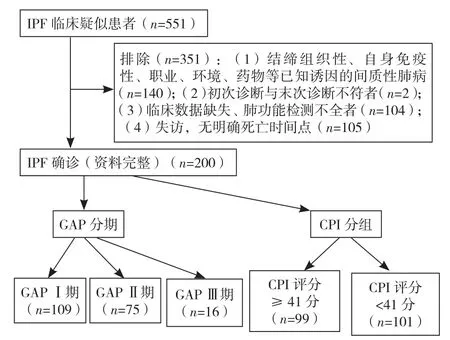
图1 IPF患者筛选流程图Figure 1 IPF patients screening flow chart
1.2 方法
1.2.1 GAP模型 GAP评分及分期参照2012年LEY等[7]制订的标准:(1)性别0~1分:男性1分,女性0分;(2)年龄0~2分:≤60岁0分,61~65岁为1分,>65岁2分;(3)用力肺活量占预计值百分比(FVC%pred)0~2分:>75%为0分,>50%~75%为1分,≤50%为2分;(4)DLCO占预计值百分比(DLCO%pred)0~3分:>55%为0分,>36%~55%为1分,≤36% 为2分,无法完成3分。GAP分期按0~3分为GAP Ⅰ期,4~5分为GAP Ⅱ期,6~8分为GAP Ⅲ期。不同GAP分期患者年龄、氧分压(PaO2)、二氧化碳分压(PaCO2)、氧饱和度(SaO2)、FVC%pred、第1秒用力呼吸末容积占预计值百分比(FEV1%pred)、肺总量所占预计值(TLC%pred)、DLCO%pred、CPI评 分、CPI分组、死亡情况比较,差异均有统计学意义(P<0.05);不同GAP分期患者性别、磨玻璃影比例、蜂窝状影比例比较,差异均无统计学意义(P>0.05),见表1。
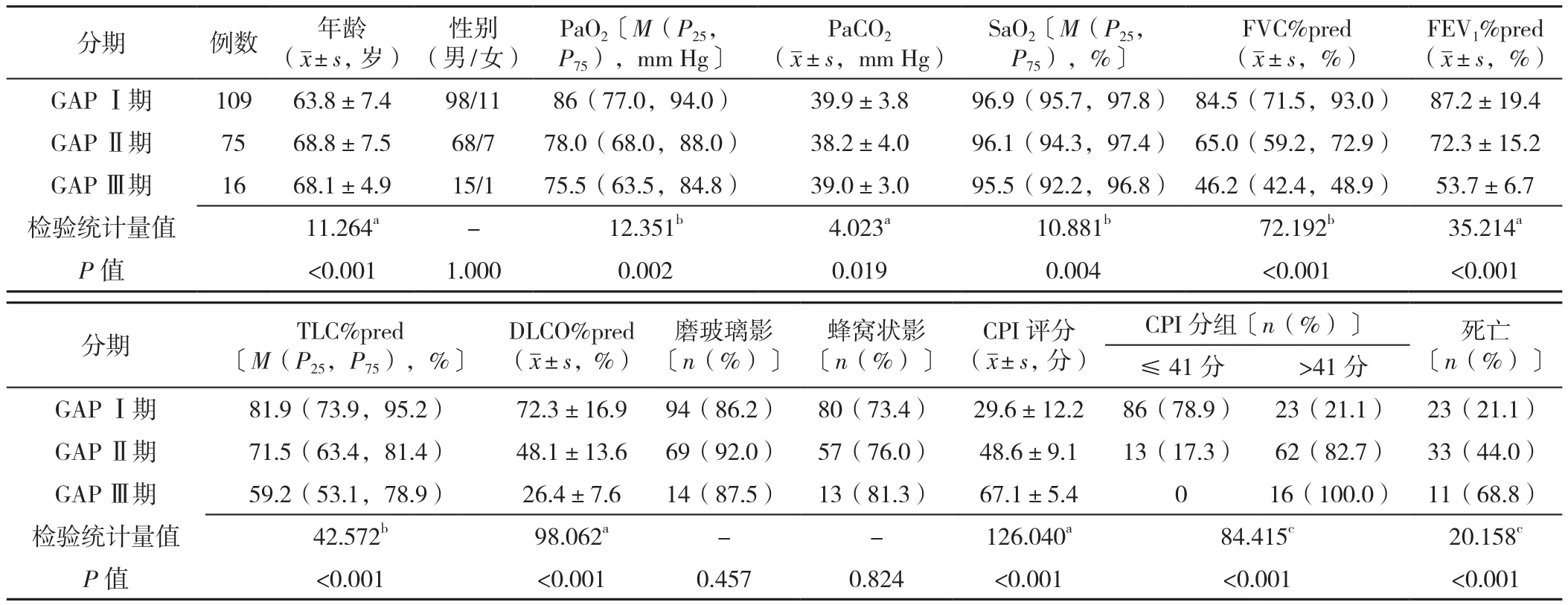
表1 不同GAP分期患者的临床、影像学、生理学特征比较Table 1 Comparison of clinical,imaging and physiological characteristics of patients by GAP staging
1.2.2 CPI模型 CPI依照WELLS等[8]的预测模型,包括3个参数:DLCO%pred、FVC%pred、FEV1%pred。计算公式:CPI=91.0-(0.65×DLCO%pred)-(0.53×FVC%pred)+(0.34×FEV1%pred)。MURA等[9]发现CPI评分>41分对IPF患者3年内死亡率的预测具有高度特异性,本研究依此结果将患者分为两组:CPI评分≤41分,CPI评分>41分。不同CPI评分患者 PaO2、SaO2、FVC%pred、FEV1%pred、TLC%pred、DLCO%pred、磨玻璃影比例、蜂窝状影比例、GAP分期、死亡率比较,差异均有统计学意义(P<0.05);不同CPI评分患者年龄、性别、PaCO2比较,差异均无统计学意义(P>0.05),见表2。
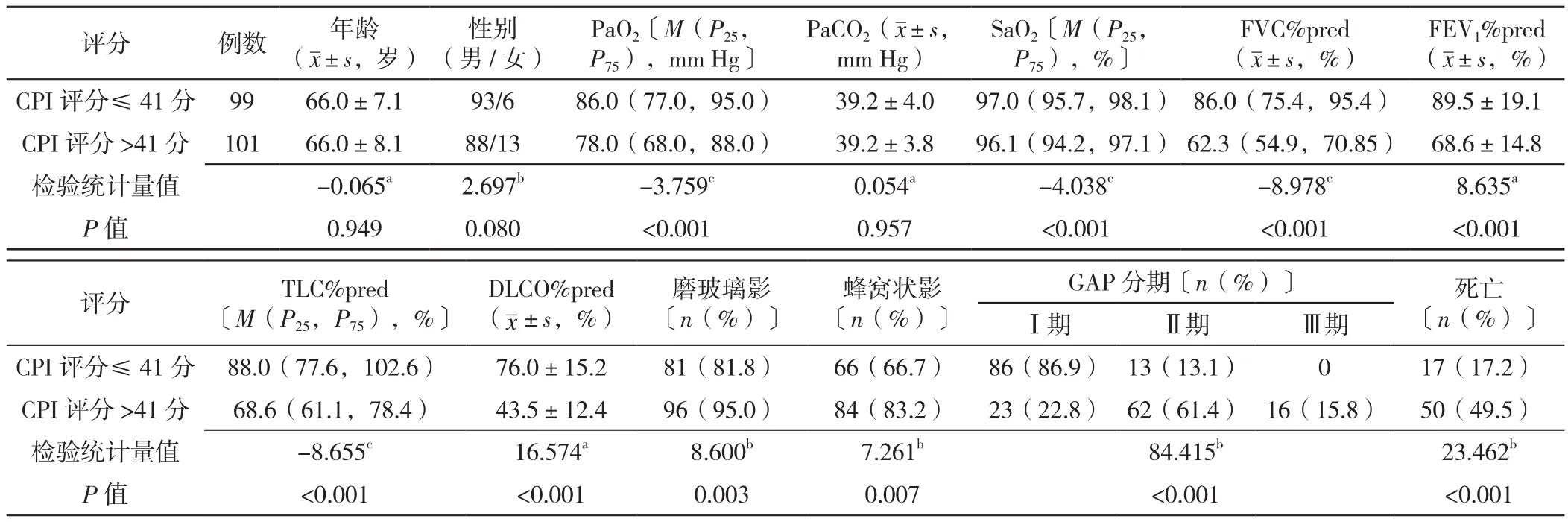
表2 不同CPI评分患者的临床、影像学、生理学特征比较Table 2 Comparison of clinical,imaging and physiological characteristics of patients by CPI score
1.2.3 观察指标 动脉血气分析指标(PaCO2、PaO2、SaO2);Master Screen Diffusion肺功能检查仪(德国Erich Jaeger公司)检测肺功能指标,包括FVC%pred、TLC%pred、DLCO%pred、FEV1%pred;HRCT观察指标(毛玻璃影、蜂窝状影);GAP评分及分期;CPI评分及分组;通过电话、门诊随访以及本院电子信息数据库获取IPF患者的生存情况,记录患者生存时间。本部分研究结局为死亡,生存时间为患者首次确诊到死亡时间。患者首次出院后3个月、6个月、1年、之后依次维持在1年/次进行随访,随访截止至2020-12-08,平均随访时间(42.9±1.8)个月。其中死亡67例(33.5%),生存133例(66.5%)。
1.3 统计学方法 采用SPSS 25.0统计学软件进行数据分析。计量资料符合正态分布以(±s)表示,采用成组t检验或方差分析进行组间比较;计量资料不符合正态分布以M(P25,P75)表示,组间比较采用秩和检验;计数资料以相对数表示,组间比较采用χ2检验或Fisher's确切概率法;采用单因素Cox比例风险回归模型对IPF预后影响因素进行分析;绘制两模型预测IPF患者死亡率的受试者工作特征曲线(ROC曲线),比较CPI和GAP分期在1年死亡率、2年死亡率、3年死亡率(有29例患者随访时间<3年,计算时以缺失数据处理)以及总体死亡率上的ROC曲线下面积(AUC),并使用Medcalc软件分析两者的预测效能。以P<0.05为差异有统计学意义。
2 结果
2.1 IPF患者预后影响因素的单因素Cox比例风险回归模型分析 以IPF患者生存情况为因变量(赋值:生存=0,死亡=1),以GAP评分(赋值:实测值)、CPI评分(赋值:实测值)、GAP分期(赋值:GAP Ⅰ期=0,GAP Ⅱ期=1,GAP Ⅲ期=2)为自变量,使用单因素Cox比例风险回归模型进行分析,结果显示,GAP评分〔HR=1.038,95%CI(1.023,1.054)〕,CPI评分〔HR=1.509,95%CI(1.286,1.771)〕是IPF患者预后的独立影响因素(P<0.05),且IPF患者的死亡风险随着GAP及CPI评分增加而增加;GAP Ⅱ期〔HR=2.622,95%CI(1.536,4.475)〕和Ⅲ期〔HR=4.002,95%CI(1.947,8.226)〕IPF患者的死亡风险分别是GAP Ⅰ期IPF患者的2.622倍和4.002倍,见表3。
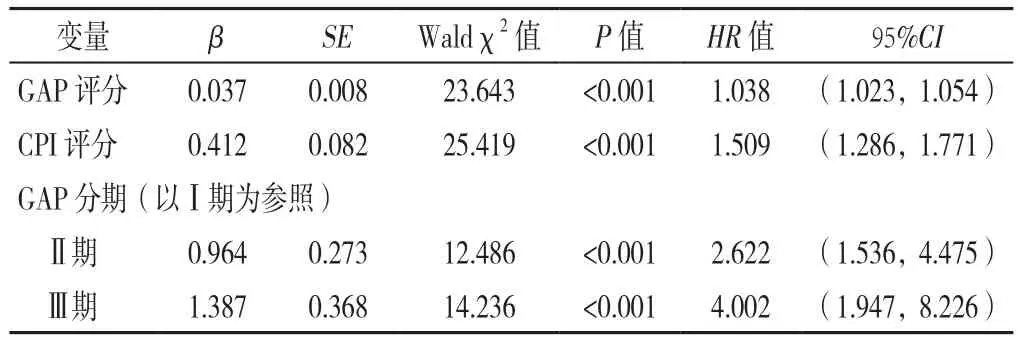
表3 IPF患者预后影响因素的Cox比例风险回归模型分析Table 3 Cox proportional-hazards regression analysis of factors potentially affecting the prognosis of IPF patients
2.2 GAP分期和CPI在总体以及不同时间点死亡率的AUC比较 GAP分期预测IPF患者1年内死亡率、2年内死亡率、3年内死亡率、总体死亡率的AUC分别为0.685〔95%CI(0.616,0.749)〕、0.675〔95%CI(0.606,0.740)〕、0.642〔95%CI(0.571,0.708)〕、0.668〔95%CI(0.598,0.733)〕;CPI预测IPF患者1年内死亡率、2年内死亡率、3年内死亡率、总体死亡率的AUC分别为 0.750〔95%CI(0.684,0.809)〕、0.745〔95%CI(0.679,0.804)〕、0.735〔95%CI(0.669,0.795)〕、0.745〔95%CI(0.679,0.804)〕。GAP分期与CPI预测IPF患者2年内死亡率、3年内死亡率、总体死亡率的AUC比较,差异均有统计学意义(Z=2.193,P=0.028 3;Z=2.918,P=0.003 5;Z=2.529,P=0.011 4);GAP分期与CPI预测IPF患者1年内死亡率的AUC比较,差异无统计学意义(Z=1.799,P=0.072 1),见图2。
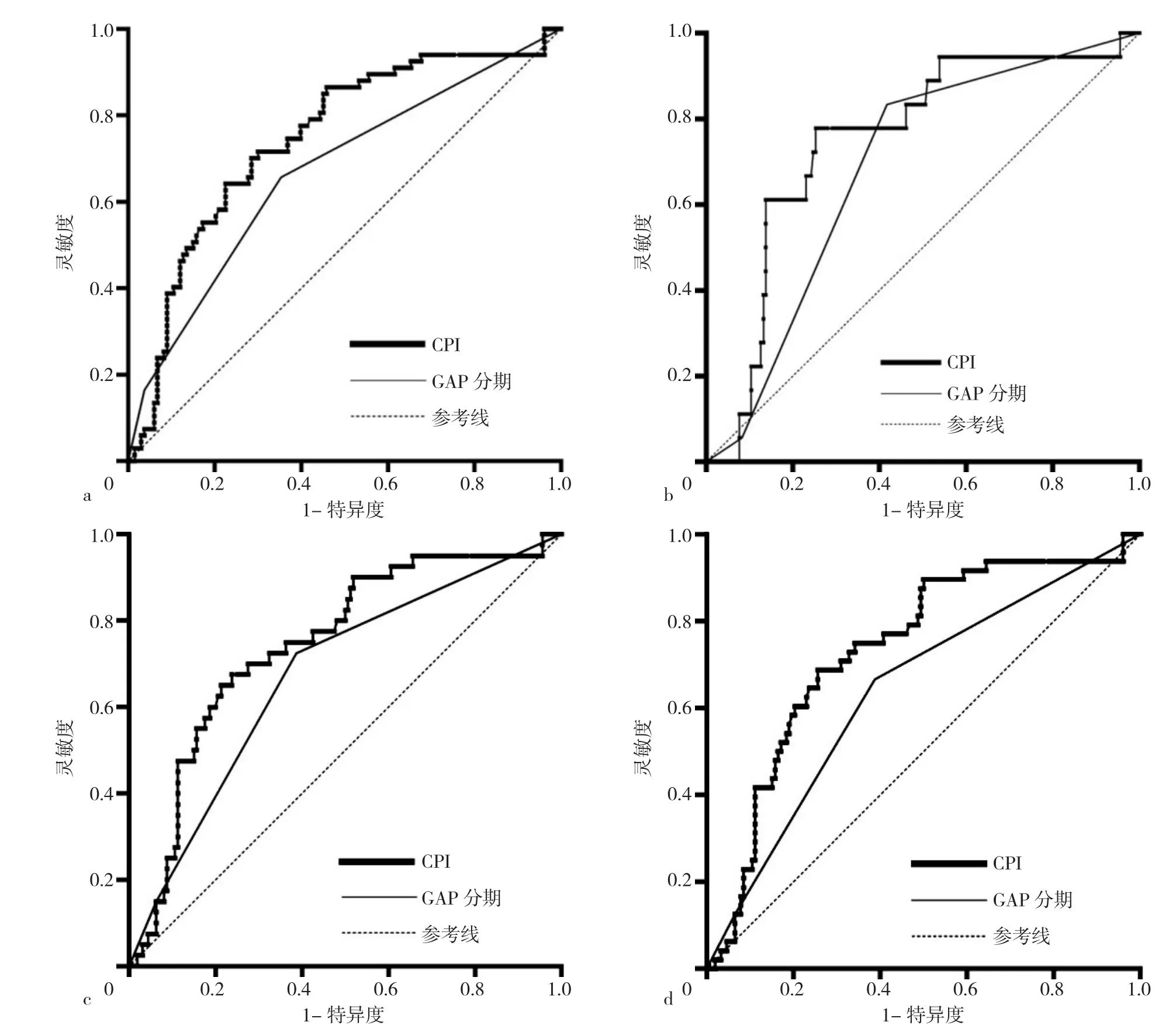
图2 GAP分期和CPI在总体以及不同时间点死亡率预测能力的受试者工作特征曲线Figure 2 ROC curve of GAP staging and CPI score in predicting the overall mortality and one-,two- and three-year mortality of IPF patients
3 讨论
IPF患者肺纤维化过程尚不完全清楚,自然病程变化大,如何更好地识别、预测疾病的进展,提高患者生命质量,给予临床医生更优的治疗决策是大家关注的话题。近年来,国内外陆续进行了一系列关于IPF患者疾病严重程度及死亡风险预测指标的探索研究,如HRCT得分、分子生物学标志物(金属蛋白酶7,表面活性剂蛋白A,CC趋化因子配体18)、长期肺功能指标变化等[10-11]。但这些预测模型涉及的因素复杂,需要耗费大量人力及物力,且有些预测指标尚未得到大规模病例研究的验证。2012年LEY等[7]基于多中心、回顾性队列研究结果建立的GAP模型(GAP,多维分析系统,GAP计算器)与2003年WELLS等[8]通过CT观察IPF疾病严重程度发现的CPI模型是两种简单易测的IPF患者临床预测模型。
在GAP模型中主要关注4个变量:性别、年龄、FVC %pred和DLCO%pred,其是一个二次风险评估系统,包括GAP计算器和GAP分期,通过GAP计算器确立GAP分值,使每个IPF患者的评估个体化,根据其分值的大小可迅速对患者病情严重程度做出分期。文献报道GAP分期一方面用于评估患者疾病风险,预测1~3年的死亡率;另一方面评估诊治手段的利弊,特别是患者肺移植前的死亡风险,有利于肺移植受体及时机的选择,合理利用供体,避免资源的浪费[7,12]。CPI模型整合了肺功能(FVC %pred、FEV1%pred、DLCO%pred)和HRCT影像特征,在制定过程中校正了肺气肿这一混杂因素[13],能更好地反映患者肺纤维化程度,临床实用性更强。这两种模型分别建立在不同的数据库基础上,哪一种模型更具有优势?其预测效能如何?目前尚无结论。所以本文在同一IPF患者数据库中对两种模型进行了比较。
由于IPF患者疾病严重程度主要体现在肺功能下降、缺氧加重及肺纤维化进展,即蜂窝肺形成[1],在比较时选取了GAP模型和CPI模型关联的临床参数,即有代表性的动脉血气指标、肺功能指标和HRCT肺纤维化(蜂窝肺、磨玻璃影)。本研究结果显示,不同GAP分期及CPI评分的患者FVC%pred、FEV1%pred、TLC%pred、DLCO%pred比较均有统计学差异;不同GAP分期患者PaO2、PaCO2、SaO2比较有统计学差异;不同CPI评分患者PaO2、SaO2比较也存在统计学差异,而对于PaCO2,可能由于校正了肺气肿的干扰没有显示出统计学差异。
本研究中GAP模型与CPI模型一致性较强,GAP分期越高者CPI评分越高。不同CPI评分分组的患者,在GAP分期中也存在统计学差异。GAP与CPI两模型均能很好地预测IPF患者的死亡率。GAP Ⅰ期、GAPⅡ期、GAPⅢ期患者死亡率分别为21.1%、44.0%、68.8%,不同CPI分期患者死亡率比较有统计学差异,此结果与相关循证医学证据一致[14],可作为IPF患者特定阶段下病情评估框架;CPI评分高低也显示出死亡风险的高低,评分越高者死亡风险越高,CPI评分≤41分与CPI评分>41分患者死亡率比较有统计学差异。单因素Cox比例风险回归模型结果显示,GAP评分和CPI评分均是影响IPF患者预后的独立因素。
本研究结果显示,CPI在总体以及不同时间点上的AUC均大于GAP分期,与LEE等[15]在韩国进行的一项大型队列研究结果一致。同时,本研究使用Medcalc软件比较两种模型预测效能,发现CPI在2年内死亡率、3年内死亡率以及总体死亡率的预测能力上明显优于GAP分期。这可能是因为GAP模型存在更多局限性:(1)GAP模型对DLCO%pred指标的依赖性更强,有研究显示DLCO采集时需要患者的高度配合且患者的肺容量需>1.2 L,易造成患者的选择偏倚[16];(2)GAP Ⅲ期患者易被低估,IPF患者病情进展快,很多患者在IPF诊断后可能会出现心力衰竭等严重合并症但在疾病评估时仅被归于GAP Ⅰ期或Ⅱ期,可能会降低预测的准确性[17]。另外,一项日本的回顾性研究也显示,GAP Ⅰ期或Ⅱ期的死亡率易被低估而影响模型的预测能力[18]。(3)GAP模型并未校正肺气肿的影响;同时,与CPI模型争议多基于肺气肿的校正上,有研究表明在过度校正肺气肿后,IPF患者的肺功能情况可能会被过高估计,从而影响IPF死亡率的真实性[19-20],也有研究认为合并肺气肿对IPF患者的生存没有显著影响[21]。而本研究结果提示,今后临床医生在实际工作中对IPF死亡风险进行预判时,可优先选择CPI模型。
综上所述,GAP分期和CPI均显示出较强地预测IPF患者死亡风险的能力,但CPI在总体死亡率、2年内死亡率、3年内死亡率的预测上明显优于GAP分期。然而本研究也存在一些局限性:本研究中初筛确诊的IPF患者409例,GAP分期与CPI均排除了未测和无法测量DLCO%pred的患者104例,在有完整临床指标的305例确诊的IPF患者中,105例(34.4%)失访和死亡时间缺失患者也一并被排除,可能会导致选择偏移,从而限制这两种模型的预测能力;同时本研究中两种预测模型的AUC仅为0.64~0.75,对于结果预测的准确性还有待考证。未来仍需开展大规模的前瞻性研究,探索并建立更为实用可行的IPF患者的死亡风险预测模型。
志谢:本文作者感谢李惠萍教授对论文的批评指导。
作者贡献:蔡博进行文章的构思与设计,统计学处理,结果的分析与解释,撰写论文;蔡博、陈娴秋、杨文兰、杨光红、黄劲、冯永红进行研究的实施与可行性分析;蔡博、陈娴秋、杨文兰、杨光红、黄劲、全华进行数据收集;蔡博、陈娴秋、杨文兰、全华进行数据整理;蔡博、陈娴秋、冯永红进行论文的修订;冯永红负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
