鲁西黑头羊肌肉细胞体外培养及诱导分化研究
2021-11-15刘昭华王可崔绪奎靳青朱荣生王建英孟宪锋张冬梅谭秀文
刘昭华,王可*,崔绪奎,靳青,朱荣生,王建英,孟宪锋,张冬梅,谭秀文
(1.山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;
2.山东省邹城市畜牧业发展中心,山东 邹城 273500)
我国肉羊存栏量和羊肉产量均居世界首位,是名副其实的养羊大国。但是羊肉生产仍存在两大问题:一是随着我国国民经济和人民生活水平的不断提高,羊肉需求量日益扩大,羊肉产量很难满足市场需求;二是我国肉羊饲养水平较低,市场供应的羊肉品质普遍不高,优质高档肉甚少。众所周知,肌肉组织的生长发育直接决定产肉量和肉质。因此,对肉羊肌肉生长发育影响因素进行研究,有利于提高肌肉沉积速度和肉质等级,促进我国肉羊产业的发展。
细胞体外培养是研究肌肉生长发育最有利的工具。这是因为与动物体内试验相比,体外培养的肌肉细胞遗传背景、培养条件和活性状态等都一致,所获得的试验结果更稳定、组内数据差异较小,更具有说服力和参考价值[1-3]。然而目前关于肉羊肌肉细胞体外培养的研究甚少,其生长规律并不清楚。不同于其他组织来源的体细胞,肌肉细胞只有分化后才能发挥生理功能,但目前关于肉羊肌肉细胞诱导分化的研究仅局限于验证其是否具有肌源性,而对支撑生理功能的超微结构研究报道较少。因此,本研究建立鲁西黑头羊肌肉细胞体外培养体系,并对其生长规律、诱导分化以及超微结构等进行探讨,旨在为肌肉细胞研究提供生长和分化特性等方面的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂 0.25%胰酶、DMEM/F12培养液,购自美国Gibco公司;马血清(HS)、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、三抗混合液(青霉素、链霉素和两性霉素),购自以色列BI公司;生肌决定因子(MyoD1)抗体、成肌调节因子(Myf5)抗体,购自北京Bioss公司;山羊抗兔IgG/FITC抗体,购自美国Jackson ImmunoResearch公司。
1.1.2 主要仪器 CO2细胞培养箱(美国Thermo公司),倒置相差显微镜及全自动显微摄像装置(日本Nikon公司),Moxi Z微型自动细胞计数仪(美国ORFLO公司),流氏细胞仪(美国BD公司),扫描电子显微镜、透射电子显微镜(日本HITACHI公司)。
1.2 试验方法
1.2.1 肌肉细胞培养 将刚出生的鲁西黑头羊羔羊从养殖场立即送到无菌室的准备间,窒息处死羔羊后剪开后腿内侧皮肤,剪下3~4块1~2 cm3的肌肉组织,置于装有PBS液(含2%三抗)的50 mL离心管中并放至超净工作台内。用眼科镊子将肌肉组织放在无菌塑料平皿上,PBS液(含2%三抗)清洗3~5次,将外围组织去除,剩余组织继续用PBS液清洗2~3遍后放在干燥的平皿上,剪碎约至1 mm3大小,加入0.25%胰酶(含0.05%EDTA)放置4℃冰箱过夜。第2 d放置37℃培养箱内消化1 h,加入含10%FBS的DMEM/F12培养液终止消化,用移液器轻轻吹打至组织块基本消失,先过400目细胞筛,收集滤液再过200目细胞筛,之后收集滤液300×g离心5 min,收集细胞沉淀后再用细胞培养液离心洗涤1次,加入细胞培养液(DMEM/F12+10%FBS+1%三抗)重悬接种到培养瓶内,于37℃、5%CO2、饱和湿度的培养箱内培养。
1.2.2 肌源性鉴定 待细胞贴壁至80%~90%时弃掉培养液,加入0.25%胰酶(含0.05%EDTA),置于37℃培养箱消化处理3~5 min,待细胞彻底消化下来后加入培养液中和,300×g、5 min离心收集细胞,加入固定液室温处理30 min,离心后弃上清液。加入含0.1%Trinton X-100的PBS液处理10 min,离心弃上清液,加入含3%BSA的PBS液处理2 h,之后加入一抗(MyoD1或Myf5)或对照IgG,4℃孵育过夜。离心去除一抗,加入FITC连接的山羊抗兔IgG二抗,室温避光孵育1 h。离心去上清液,将细胞重悬于200μL PBS液中,利用流式细胞仪进行MyoD1或Myf5表达检测。
1.2.3 生长曲线绘制 将细胞按1×104个/mL接种到6孔培养板中,接种当日记为0 d,接种第2日记为1 d。每天盲选1个培养板,弃掉培养液,每孔加入1 mL 0.25%胰酶(含0.05%EDTA),放置于37℃培养箱消化处理3~5 min,待细胞彻底消化下来后加入2 mL培养液中和,用移液器充分混匀后吸取75μL,加入到芯片进液口处,Moxi Z微型自动细胞计数仪立即读数。剩余未处理的细胞隔天换液,直到试验结束。
1.2.4 成肌诱导 将细胞按1×104个/mL接种到T25培养瓶中,待细胞贴满培养瓶底壁时弃掉培养液,加入5 mL成肌诱导培养液(DMEM/F12+2%HS+1%三抗),放置于37℃、5%CO2、饱和湿度的培养箱内培养,隔天换液。
1.2.5 样品处理及电镜观察 将细胞按1×104个/mL接种到T75培养瓶中,待细胞贴壁90%~100%时,用塑料细胞刮将细胞轻轻刮下来,300×g、5 min离心收集细胞,加入电镜固定液放置4℃冰箱保存。诱导分化肌肉细胞样品的制备按成肌诱导处理,待形成肌管时收集细胞、固定保存。
透射电镜样品处理主要包括:(1)琼脂预包埋:将固定处理的细胞离心,弃上清加入PBS,混匀漂洗3 min后再离心,重复洗涤3次。提前加热溶解制备1%琼脂糖溶液,稍冷却后加入1.5 mL离心管内,在琼脂糖凝固之前将沉淀用镊子挑起悬浮包裹于琼脂糖内。(2)后固定:PBS配制的1%锇酸避光室温固定2 h,PBS漂洗3次,每次15 min。(3)室温脱水:样品依次入30%、50%、70%、80%、95%、100%、100%酒精上行脱水,每次20 min,100%丙酮两次,每次15 min。(4)渗透包埋:丙酮∶812包埋剂=1∶1于37℃处理2~4 h,丙酮∶812包埋剂=1∶2于37℃渗透过夜,纯812包埋剂于37℃处理5~8 h。将纯812包埋剂倒入包埋板,将样品插入包埋板后37℃烤箱过夜。(5)聚合:包埋板放于60℃烤箱聚合48 h,取出树脂块备用。(6)超薄切片:树脂块于超薄切片机60~80 nm超薄切片,150目方华膜铜网捞片。(7)染色:铜网于2%醋酸铀饱和酒精溶液避光染色8 min;70%酒精清洗3次;超纯水清洗3次;2.6%枸橼酸铅溶液避二氧化碳染色8 min;超纯水清洗3次,滤纸稍吸干。铜网切片放入铜网盒内室温干燥过夜。(8)透射电子显微镜下观察,采集图像分析。
扫描电镜样品处理主要包括:(1)后固定:固定好的样品经PBS漂洗3次,每次15 min。PBS配制1%锇酸室温避光固定1~2 h。PBS漂洗3次,每次15 min。(2)脱水:样品依次入30%、50%、70%、80%、90%、95%、100%、100%酒精各15 min,乙酸异戊酯15 min。(3)干燥:将样品放入临界点干燥仪内进行干燥。(4)样品导电处理:将样品紧贴于导电碳膜双面胶上放入离子溅射仪样品台上进行喷金30 s左右。(5)扫描电子显微镜下观察,采集图像分析。
1.3 数据分析
采用SPSS 19.0统计软件进行分析,数据以平均值±标准差表示。
2 结果与分析
2.1 肌肉细胞生长情况
肌肉细胞接种培养后,经过短暂的悬浮状态然后贴壁扩增,其形态随着培养时间的延长而发生改变(图1)。第1 d(接种当日记为0 d),细胞散在贴壁生长,呈不规则多角形;随着细胞不断分裂扩增,生长空间逐渐减少,第3 d细胞呈长条形;第6 d开始零星出现分化的肌管,随培养时间的延长,肌管越来越多;直到20 d左右,肌肉细胞全部分化为肌管;之后肌管开始聚集、隆起,最后形成团状类似肉糜的颗粒。

图1 不同培养天数肌肉细胞生长形态(100×)
肌肉细胞在最初的1~2 d内处于缓慢生长的潜伏期;从第3 d开始直到第6 d,细胞进入快速生长的指数增长期;从第7 d开始直到第20 d左右,细胞生长达到饱和密度进入平台期;从第21 d开始,细胞数量逐渐降低,进入衰退期(图2)。

图2 肌肉细胞生长曲线
2.2 肌源性鉴定
利用流式细胞仪检测肌肉细胞表达MyoD1和Myf5阳性率,结果(图3)发现,MyoD1和Myf5表达阳性率均在95%以上,说明培养的肌肉细胞纯度较高。

图3 肌肉细胞MyoD1和Myf5阳性率
2.3 诱导分化
细胞接种培养后,于第3 d完全贴满培养瓶底壁,这时更换诱导分化液或正常换液(即为分化处理的第1 d),结果(表1、图4)发现,正常换液组出现肌管时间为分化处理的第4 d,肌管聚集时间为第19 d;诱导分化组出现肌管时间为分化处理的第2 d,肌管聚集时间为第5 d。说明自然状态下肌肉细胞也能分化成肌管,但分化进程较诱导分化慢。
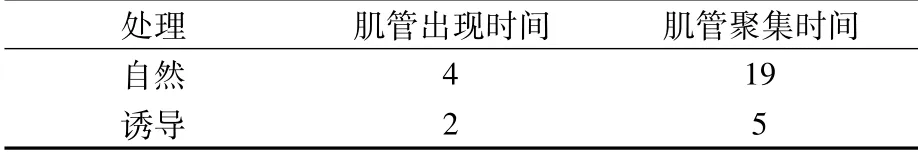
表1 肌肉细胞在自然或诱导下的分化进程 (d)
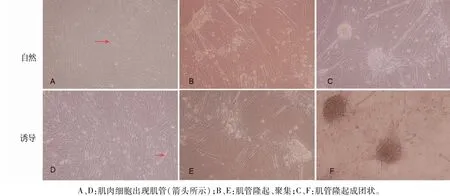
图4 肌肉细胞在自然或诱导下的分化形态(100×)
2.4 超微结构
肌肉细胞经诱导分化后,其超微结构如图5、图6所示。细胞呈扁平、不规则长条形,簇拥叠压在一起;细胞表面伸出丝足,质膜分布有很多空隙孔。线粒体十分丰富,为椭圆形,内嵴发达、致密;核膜完整,核内有电子致密的核仁;核膜外侧有数量较多的糙面内质网,表面核糖体清晰可见;脂滴的电子密度均匀,大量糖原散在细胞质中;肌原纤维束致密、排列规则;细胞间紧密连接明显。

图5 肌肉细胞膜表面超微结构
3 讨论与结论
鲁西黑头羊是山东省农业科学院培育的绵羊新品种,因其具有早熟、多胎、生长发育快、肉质好等优良特性,目前已成为山东省肉羊养殖的主推品种,也被新疆、黑龙江、青海、内蒙古、河南等省(区)引种推广,取得了良好的经济效益。为了更好地研究和利用鲁西黑头羊优良的肉质特性,本研究构建科学、高效的鲁西黑头羊肌肉细胞培养体系,为后续进行肉质和生长速度研究提供有利工具。
目前肌肉细胞培养主要采取两种方法,即组织块培养法[4]和酶消化法[5]。组织块培养法直接在培养瓶/培养皿内接种剪碎的肌肉组织小块,10~15 d后细胞从组织块周围游离生长出来,细胞密度不均匀,生长状态不一致;酶消化法将剪碎的肌肉组织小块进一步加入蛋白酶消化处理成单个游离的细胞,加入培养液后培养,第2 d有细胞散在贴壁生长,细胞分布均匀,生长状态一致。因此,本研究利用0.25%胰酶(含0.05%EDTA)消化处理肌肉组织,放置4℃冰箱过夜;为获得更好的消化效果,第2 d于37℃继续消化1 h,这样既让胰酶充分浸入组织,又不会造成消化过度,提高细胞活性,利于贴壁生长。
生长曲线是反映细胞增殖速度的重要指标,包括潜伏期、指数增长期、平台期和衰退期四个阶段。细胞接种后经过短暂的悬浮状态,然后贴壁生长,不断扩增。在培养的最初几天,肌肉细胞增殖速度相对较慢,处于潜伏期。潜伏期时间长短不定,1.5 d[6]、3 d[7]都有报道,本研究中潜伏期为2 d,这可能与接种的密度、提供的营养物质、培养环境不同有关。之后细胞进入指数增殖期,这一时期细胞分裂速度最快,大量扩增并挤压生长空间,细胞由最初的不规则多角形变为长条形。指数增殖期维持4 d左右,与Wu等[7]报道的基本一致。由于细胞存在生长接触抑制,在生长空间消耗殆尽的情况下,细胞不再增殖,这时处于平台期。本研究中肌肉细胞平台期持续13 d左右,与其他组织来源的细胞相比[8-10],处于平台期的时间较长。这可能因为这一时期肌肉细胞虽然不再增殖,但在营养物质充足的情况下,细胞开始分化,与出现肌管的时间点一致。
体外培养的肌肉细胞在分化阶段发挥其生理功能。细胞出现接触抑制后不再增殖,但在营养物质充足的情况下能自发分化成肌管,但分化速度较慢。采用含有特定物质的培养液对肌肉细胞进行诱导分化能够提高分化速度和效率。已有报道表明,不同物种的肌肉细胞进行成肌诱导采用在培养液中添加2%马血清[11,12],也有报道采用10%马血清[13]。本研究采用在DMEM/F12培养液中添加2%马血清进行成肌诱导,取得了很好的分化效果。但试验中发现必须在肌肉细胞出现接触抑制后进行诱导分化,如果提前换入诱导分化液,2%马血清不能满足细胞继续增殖的营养需要,就不会出现生长接触抑制,也就不能进行分化,这一结果与Wu等[7]的结果不一致。
超微结构是细胞发挥生理功能的物质基础。本研究利用扫描电镜观察到分化的肌肉细胞呈长条形,簇拥挤压在一起,与光镜观察到的结果一致。肌肉细胞在增殖阶段由于存在生长接触抑制,所以细胞都是单层扩增直至贴满;诱导分化后则突破这一限制,细胞聚集、隆起,最后形成团状结构,这与小鼠肌肉细胞[13]、牛肌肉细胞[14]诱导分化结果一致。肌肉细胞由于自身的运动属性,肌原纤维非常发达。本研究发现,大量肌原纤维成束存在,有的存在于质膜附近,有的在胞浆里面。胞浆内含有大量的糖原和脂肪滴,线粒体十分丰富,内嵴致密、发达,可为肌肉细胞活动提供能量。糙面内质网发达,表面核糖体清晰可见,可进行合成蛋白的转运。这些细胞器正常、有序的运行,能够为肌肉细胞生长和发挥功能提供有利保障。
本研究利用酶消化法成功构建鲁西黑头羊肌肉细胞培养体系,首次报道肌肉细胞不同于其他组织来源细胞的生长规律,以及诱导分化后符合自身运动属性特征的超微结构。
