猪丹毒杆菌的分离鉴定及药敏试验研究
2021-11-15张瑞华任丹宁高善颂窦心怡张丹萍李焕发韩先杰
张瑞华,任丹宁,高善颂,窦心怡,张丹萍,李焕发,韩先杰
(青岛农业大学动物医学院,山东 青岛 266109)
猪丹毒病(swine erysipelas)主要有急性、亚急性和慢性三种病型[1]。该病主要靠接触传播,猪最为易感,各日龄的猪均可感染,多数发生于架子猪。天气突变情况易导致动物发病;也可因猪场饲养环境较差,动物的抵抗力下降而发病。多数发生在闷热的夏季,其他季节也有发生[2]。
猪丹毒杆菌菌体细长,大多数呈直或稍弯曲状。该菌血清型复杂,目前有26种血清型,对养猪业危害较大的血清型有1a、1b、2a、2b等。1a亚型多从急性病例中分离到,2型多从亚急性或慢性病猪中分离到[3,4]。
猪丹毒杆菌的毒力因子主要为神经氨酸酶,目前尚未发现有外毒素的产生。在神经氨酸酶的作用下,宿主组织黏蛋白、血纤维蛋白原等被除去,因此黏蛋白对机体的保护作用大大减弱[5]。急性型血液中存在大量神经氨酸酶,引起全身各处毛细血管通透性增高或产生血栓,从而表现出败血症相应症状。急性败血型在养殖过程中比较多见,一般病猪会在较短时间内死亡,大多高热稽留、结膜充血、粪便干燥,部分病猪以皮肤发红为主要症状[6,7]。在亚急性病例中,神经氨酸酶仅作用于存在于皮肤局部的微血管和淋巴间隙,从而在患病动物皮肤上出现类似“打火印”样的疹块。在慢性病例中,细菌会长时间停留在动物体内,特别是心内膜、关节内以及皮肤,从而引起动物的关节炎、心内膜炎以及皮肤坏死[8,9]。
2018年12月,即墨某猪场发病猪突然发病死亡,在其腹下及股内侧皮肤有大小不一的红斑。剖检发现其肾脏肿大、呈暗红色,脾脏肿大,全身淋巴结肿胀充血。为确定病因,本研究对该病死猪进行病原菌的分离鉴定及药敏试验,以期为猪丹毒病的防控提供依据。
1 材料与方法
1.1 病料来源
病死仔猪(40 kg左右),即墨某猪场提供。
1.2 主要试剂
革兰氏染液试剂盒、Mueller-Hinton琼脂、绵羊血培养基、胰蛋白胨大豆琼脂、细菌微量生化鉴定管,均购自青岛高科园海博生物技术有限公司;PCR反应试剂等,购自青岛紫恩生物科技有限公司;药敏试纸,购自青岛科盛源科技发展有限公司;20~24 g健康昆明系小白鼠,购自青岛大任富城畜牧有限公司。
1.3 细菌的分离培养及纯化
采集病死猪的脾脏和肺脏等组织,放在干净托盘里并移至超净工作台中,使用接种环无菌蘸取少量组织后,在绵羊血培养基上三区划线,37℃恒温箱中培养24~48 h后查看其生长情况。挑取单个优势菌落接种到血平板进行纯培养,置于37℃恒温箱中培养24~48 h。用接种环挑取单菌落至载玻片进行革兰氏染色,观察细菌形态。从纯培养的血平板上挑取单个菌落至脑心浸液肉汤中,置于37℃振荡培养箱中增殖培养24~48 h。
1.4 GroEl基因鉴定
用水煮法提取分离菌DNA,并置于冰箱中冷冻保存备用。针对猪丹毒杆菌GroEl基因设计一对特异性引物(表1),进行PCR扩增。PCR扩增体系(25μL):上游引物(F)1.0μL,下游引物(R)1.0μL,2×Master Mix 12.5μL,DNA模板1.5μL,灭菌去离子水9.0μL。PCR扩增程序:95℃预变性3 min;95℃变性15 s,50℃退火15 s,72℃延伸35 s,共32个循环;72℃终延伸5 min,10℃结束反应并保存。

表1 扩增猪丹毒杆菌GroEl基因的引物序列
吸取5μL PCR产物于1%琼脂糖凝胶中进行电泳(115 V,25 min),并将扩增产物交由青岛派森诺基因生物技术有限公司进行测序,利用NCBI的BLAST工具对分离菌的GroEl基因序列进行同源性比对。
1.5 生化鉴定
将菌液离心后使用生理盐水洗涤两次,接种于生化鉴定管,具体参考《伯杰细菌鉴定手册》[10]和中华人民共和国猪丹毒行业标准NYT 566—2002[11]进行,培养结束后按照说明进行结果判定。
1.6 动物试验
将分离纯化的猪丹毒杆菌接种至胰酪大豆胨液体培养基中,37℃振荡培养18~24 h,并计算活菌数。采用改良寇氏法对分离菌进行LD50的测定,设置浓度为104、105、106cfu/mL攻毒组,每组随机选取8只健康小白鼠。每个攻毒组腹腔注射不同浓度的菌液0.3 mL。连续3 d观察死亡情况,计算LD50值。小鼠死亡后,解剖小鼠并观察其内脏病理变化,分离细菌对其进行鉴定。
1.7 药物敏感性试验
使用药敏纸片琼脂扩散法(Kirby-Bauer)对分离到的菌株进行药物敏感性试验,根据相关标准[12]和青岛科盛源科技发展有限公司提供的纸片法药敏试验指导判定该菌对各种药物的敏感性。
2 结果与分析
2.1 细菌形态和培养特性
分离菌经37℃培养24 h,在绵羊血培养基上生长良好,表现为菌落细小,似针尖;培养48 h后菌落呈灰白色,边缘整齐、光滑、湿润,有α溶血现象(图1、图2)。细菌经革兰氏染色后,镜检显示为革兰氏阳性、细长杆菌(图3)。
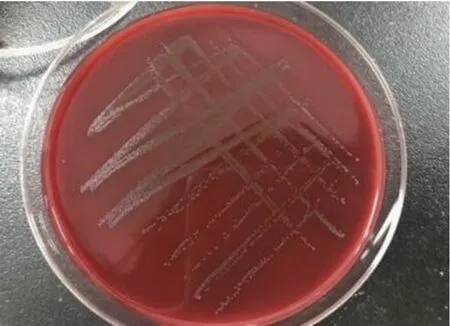
图1 绵羊血培养基上分离菌的菌落形态

图2 分离菌的溶血现象
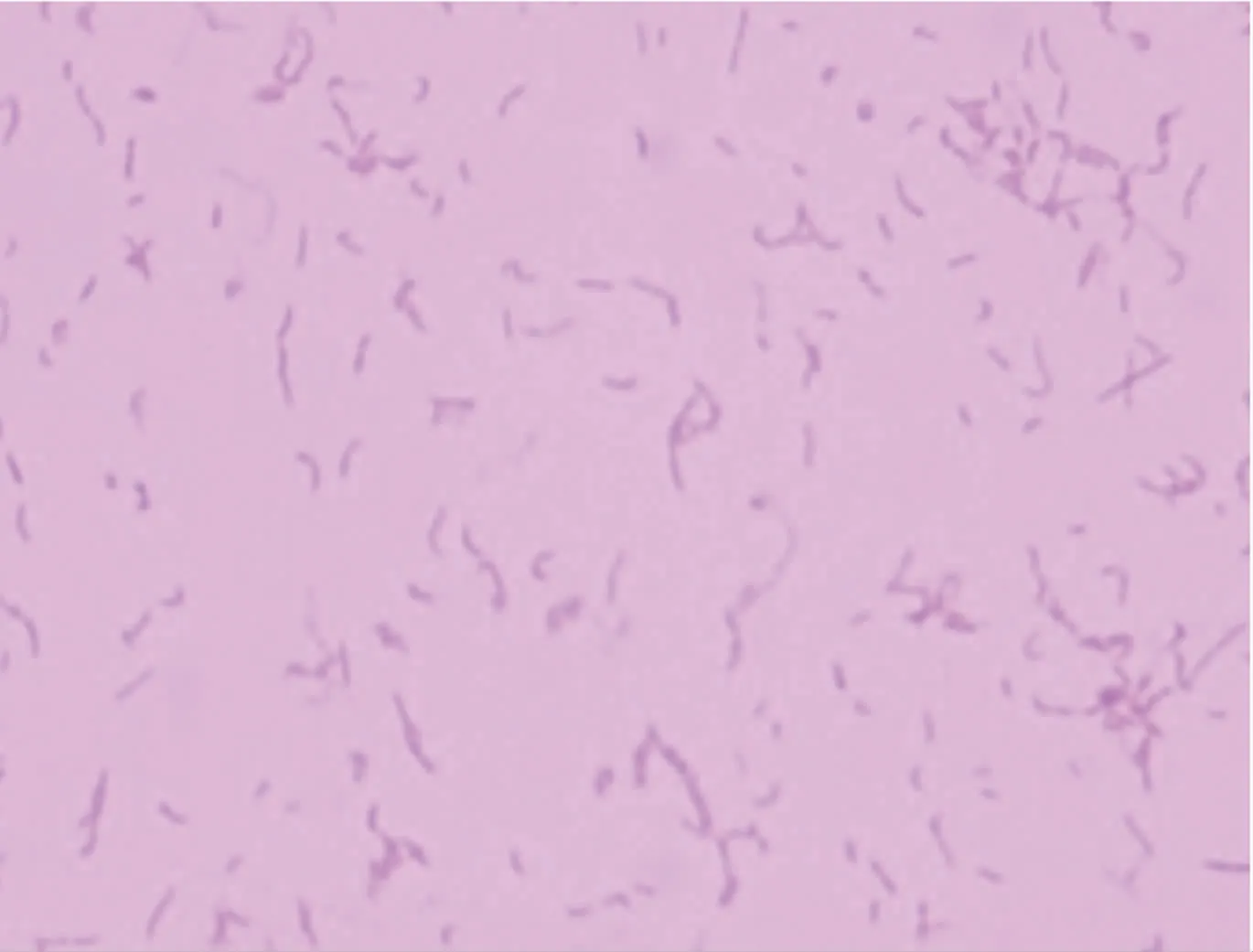
图3 显微镜下细菌形态(1 000×)
2.2 生化试验结果
生化鉴定结果显示该株细菌能发酵葡萄糖、果糖、乳糖,不能发酵甘露醇、菊糖、山梨醇、棉籽糖、水杨酸、蕈糖、海藻糖等(表2)。根据《伯杰氏细菌鉴定手册》[10],符合猪丹毒杆菌的生化鉴定特佂。

表2 生化试验结果
2.3 分子鉴定
电泳结果显示,出现与预期大小相符的目的条带,约377 bp(图4)。利用NCBI的BLAST工具将分离菌GroEL基因序列与数据库中的序列进行同源性比对,结果显示该菌与猪丹毒杆菌序列同源性为99%;GroEl基因系统进化树分析表明,分离株与Erysipelothrix rhusiopathiaeSY1027和Erysipelothrix rhusiopathiaestr.Fujisawa在同一分支,亲缘关系较近(图5)。结合菌落形态和生化试验结果,可以确定分离菌株为猪丹毒杆菌。

图4 PCR扩增GroEl基因结果

图5 GroEl基因进化树分析
2.4 动物试验结果
攻毒后小鼠先后出现精神不振、食欲不佳、不愿活动、被毛蓬乱、身体蜷缩、喜闭眼等表现;3 d后全部死亡。表明该菌对小鼠有较强的致病力。经计算得到分离株的LD50为1.6×105cfu/mL。对死亡小鼠进行解剖,发现其肝脏、脾脏等多处内脏肿胀充血。在死亡小鼠腹腔内用接种环取菌,在血平板上划线,37℃恒温箱培养24~48 h,细菌生长情况和感染菌株形态一致(图6),革兰氏染色可见短杆状阳性菌(图7)。取该菌提取DNA模板进行PCR扩增后电泳,可观察到大小377 bp左右的目的条带。由此可以判断小鼠感染的菌为分离到的猪丹毒杆菌。

图6 小鼠腹腔分离菌培养生长情况
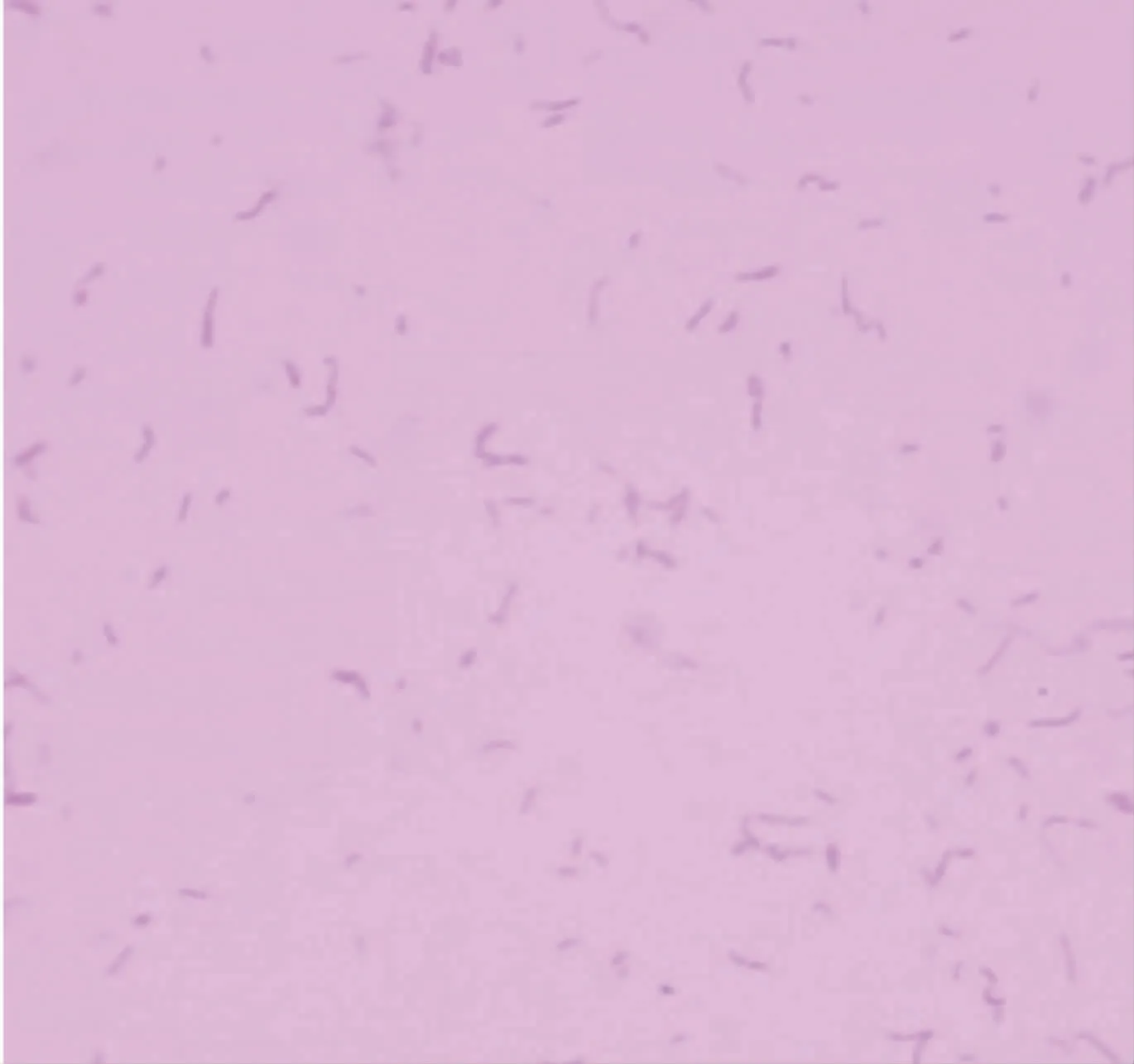
图7 小鼠腹腔分离菌革兰氏染色结果(1 000×)
2.5 药物敏感试验结果
药敏试验结果表明,该菌株对恩诺沙星、头孢克肟、氟苯尼考、氨苄西林、卡那霉素、庆大霉素、阿莫西林敏感,对青霉素和链霉素中度敏感,对林可霉素耐药(表3)。根据药敏试验结果,选取恩诺沙星、阿莫西林等进行治疗,效果良好。

表3 分离菌药物敏感试验结果
3 讨论与结论
猪红斑丹毒丝菌最早于1882年分离得到[13],在世界范围内广泛分布,给养猪业带来严重经济损失[14]。近年来,由于养猪场抗生素的广泛使用和饲养环境的改善,猪丹毒病已很少出现。许多规模化养猪场已经不再接种猪丹毒疫苗,但在我国江西、浙江、湖南、福建等地还有猪丹毒病例的报道[15,16]。
本次实验室所接到的病例为急性败血型,急性病例病程发展较快,死亡率高,而且多数预后不良;在临床上,猪蓝耳病、急性败血性猪链球菌病以及急性败血性猪传染性胸膜肺炎等疾病的临床表现和病理变化与本病有相似之处。因此在疾病发生时,应尽快将病料低温送至检测单位,经过一系列检查,确诊后对症下药,并对猪场其他健康猪群进行提早预防,以减少经济损失。
本试验从病死仔猪脾脏、肺脏中分离到1株细菌,经革兰氏染色镜检、形态学观察、生化试验和PCR扩增鉴定为猪丹毒杆菌。小鼠攻毒试验表明该菌有较强致病性,药敏试验证明该分离菌对恩诺沙星、阿莫西林等敏感且治疗效果良好。
