大强度跳跃负荷下p38MAPK对兔髌腱起止点微细结构影响
2021-11-14陈一言陆阿明齐亚楠刘云逸
陈一言,陆阿明,齐亚楠,王 琳*,刘云逸
髌腱病是髌腱反复承受不合理的负荷导致的退行性变,在篮、足、排等需要反复跳跃的项目中患病率可达34%[1]。目前还没有针对髌腱病的完善有效的预防或治疗措施出现,这种现状与对其发生机制不了解有关,因此,完善髌腱病的发病机制非常重要。
肌腱部位的代谢决定了其对外力负荷的病理和生理适应之间的均衡[2-4],信号通路则在此时承担桥梁的作用。p38促分裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)信号通路是细胞内信息传递的主要信号通路之一,外力负荷下p38MAPK信号传导通路把外部刺激传至细胞内部,从而调节生理生化反应[5-7],应力刺激会影响p38MAPK在肌细胞、腱细胞、骨与软骨中的活跃程度[8]。
髌腱起于髌尖,止于胫骨结节,髌腱病患者触诊最痛点为腱起止点[9-10],大多数针对髌腱与骨结合部的研究只涉及髌骨髌腱结合部(PPTJ)。即使在相同的干预条件下,髌腱中不同部位的变化也不尽相同[11],缺乏胫骨髌腱结合部(TPTJ)的研究则无法全面了解腱病中腱止点的发病机制。虽然肌腱附着点的损伤是由于持续收缩的肌肉不断牵拉附着点而引起的一种慢性损伤,但是一次不适宜运动引起的急性损伤有可能成为腱病的起始原因[12-13]。本文通过电刺激定量跳跃装置使兔进行一次性大强度跳跃负荷,研究在p38MAPK信号通路被抑制前后兔PPTJ与TPTJ的适应性变化有何不同,是否会使组织结构分层相同的两结合部之间产生差异。该研究旨在了解p38MAPK在腱病发展中的作用,丰富和完善髌腱发病机制,为运动中腱病预防提供理论指导。
1 研究方法
该方案经北京体育大学运动科学实验伦理委员会批准(批准号:2016013),实验动物均在麻醉下进行所有手术,并尽一切努力最大限度地减少其疼痛、痛苦和死亡。
1.1实验对象与分组
14只18周龄雌性新西兰大白兔(购买于北京兴隆实验动物养殖中心),随机分为对照组(CON,N=4)、跳跃组(J1,N=5)、跳跃后注射p38抑制剂组(J1P,N=5)。温度20~22℃,湿度55%~65%。常规饲养1周后进行实验。
1.2动物训练方法
本研究采用的动物模型为在北京体育大学运动医学实验室建立的新西兰大白兔大强度定量跳跃模型,该模型需要用到的仪器为:电刺激动物跳台(DSTT-1)、激光发射接收器(ZL-QTJS002)[14]。牵引绳将兔前肢套起,跳跃前训练人员提起绳索使兔前肢呈悬空姿态,后肢位于电刺激器上,与地面呈60°保持预备姿势,兔腾空及落地过程中牵引绳处于不受力状态。电压15 V,电流1 min通5次,电刺激引发兔向前上方跳跃且每次跳跃后迅速将兔重置并重复这一过程。激光发射接收器固定跳台2侧,实时反馈跳跃高度。合格跳跃定义为兔以预备姿势在电刺激的电流刺激下向正前方主动跳跃,高度不低于15 cm(该模型的大强度由兔的最低跳跃高度得出)[14]。实验前所有训练人员接受培训。适应性训练3 d,每天跳跃次数依次增加,分别为50次、100次、150次。训练时安抚兔情绪。正式实验:每日1次,每次150个合格跳跃。分10组完成,每组15次。组间休息3 min,为了控制跳跃质量,第4组与第8组结束后,休息6 min。此举是为了控制跳跃质量,若不延长休息时间将无法完成后续训练。CON组不训练,J1P组于每次训练后腹腔注射SB203580(0.5 mg/kg)。关于p38抑制剂的研究已比较完善,大量文献证明,p38抑制剂SB203580在注射进实验动物体内可产生抑制效应[15]。
1.3样品处理
完成相应训练24 h后25%戊巴比妥钠40 mg/kg腹腔注射,兔固定在解剖台上,沿兔后肢长轴剪开兔膝关节皮肤,取兔髌腱连同髌腱末端区附着的骨和软骨,手术刀切分为PPTJ与TPTJ,10%福尔马林溶液固定24 h,70%酒精保存。保存后的组织常规脱水(LeicaASP200S,德国)后石蜡包埋(Leica,德国),每一部位按横截面一分为二待测,冷却后冰箱4℃保存。随后进行石蜡切片(LeicaRM2235,德国),切片厚度7 μm。每个蜡块保证组织完整的15张切片,烤箱60℃烘烤2 h。
1.4组织染色
使用常规H&E染色(苏木素与伊红染色液G1140,G1110,购于Solarbio)与免疫组化(一抗比例1:100,bs-0812R,bs-6312R,bs-0086R,Bioss;试 剂 盒SP-0022,SP-0023,Bioss)处理。
1.5图像采集
使用光学显微图像采集系统(50i,日本尼康)进行图像采集。H&E在20倍、40倍视野下各拍摄1张,100倍3张,偏振光模式拍摄要求同上。免疫组化20倍视野1张,100倍3张,400倍5张。拍摄标准 统一,PPTJ髌尖朝左下方45°,100倍视野下骨区占画面的三分之一;TPTJ髌腱与胫骨结合位置的长条形空隙一致横向置于画面中线并与上下底边平行。存为TIF格式。
1.6测试指标
采用定性描述和相对定量分析2种方式。定性分析腱止点细胞的形态、胶原排列、潮线变化等组织学表现;定量(MetaMorph 7.7)分析纤维软骨带厚度、细胞密度与免疫组化阳性指标数(选取与p38及腱病联系密切的相关因子,分别为IL-6、IL-1β、TGF-β1)。软骨带厚度与细胞密度在100倍视野下的3张照片测定后取平均值。免疫组化阳性指标在400倍下测定5张后取平均值。在肌腱对负荷的适应性过程中,炎性因子与纤维化因子是影响这一进程的两大重要因素[16]。有研究认为白细胞介素(IL)是腱病的初始致病因子,也有实验通过对急性运动后的组织活检发现IL对腱病的上调作用被夸大[17]。转化生长因子-β(TGF-β1)是调节损伤愈合中纤维化进程的核心因子[18],它可以调节胶原的生成并促进瘢痕形成与组织连续[19]。p38MAPK可以影响IL等炎性因子的产生,并能够在TGF-β激活的蛋白激酶1结合蛋白(TAB1)的帮助下完成自身磷酸化过程[20]。
1.7统计学处理
测试结果用平均数±标准差(X±SD)描述。将干预手段(对照、跳跃、跳跃加抑制剂)作为自变量,使用单因素方差分析法分别对PPTJ和TPTJ进行定量指标分析,后续两两比较采用LSD方法;相同干预条件下的PPTJ与TPTJ 2个不同部位之间进行配对T检验。显著性差异定义为P<0.05。指标包括:细胞密度、软骨带厚度、免疫组化IL-6、IL-1β、TGF-β1阳性计数。
2 结果
2.1 PPTJ与TPTJ的组织形态学定性描述
图1 所示,CON-P为对照组PPTJ的H&E图像,CON-P'是CON-P偏振光图像,CON-T是对照组TPTJ的H&E图 像,CON-T'是CON-T偏振 光 图像,以此类推。

图1 H&E染色显微成像图(放大倍数100×)Figure1 H&E staining microscopic image(magnification 100×)
PPTJ与TPTJ的CON组结果:肌腱细胞核均呈梭形,软骨细胞核呈圆形,均无细胞核聚集现象,肌腱的胶原纤维整齐排列,纤维软骨区靠近肌腱部位的软骨细胞呈扁圆形,在靠近软骨中央的地方细胞体积逐渐增大变为卵圆形,骨区多椭圆形空腔,非钙化的纤维软骨、钙化软骨与骨之间分层清晰。TPTJ纤维软骨区与钙化的软骨区之间可见一条清晰、平滑的圆弧形潮线,PPTJ未见潮线;TPTJ肌腱与软骨细胞比PPTJ的肌腱与软骨细胞排列更加紧凑,且TPTJ的卵圆形细胞核的面积略大于PPTJ,即TPTJ的软骨区域比PPTJ多;偏振光图像显示,TPTJ比PPTJ胶原排列更致密。
J1组:以CON组为参照,PPTJ与TPTJ均产生了小范围的细胞聚集现象,PPTJ细胞聚集情况的改变更明显;PPTJ出现潮线,TPTJ潮线与CON组无明显改变;此时二者潮线相比,TPTJ潮线更加清晰平滑;偏振光图像显示,2个部位未产生明显的胶原形态改变。
J1P组:以J1组为参照,TPTJ潮线边缘模糊且清晰度低于PPTJ潮线。
2.2指标定量分析
如表1所示,干预手段只对PPTJ的IL-6有显著性影响(P=0.045),所以对该指标进行两两比较。
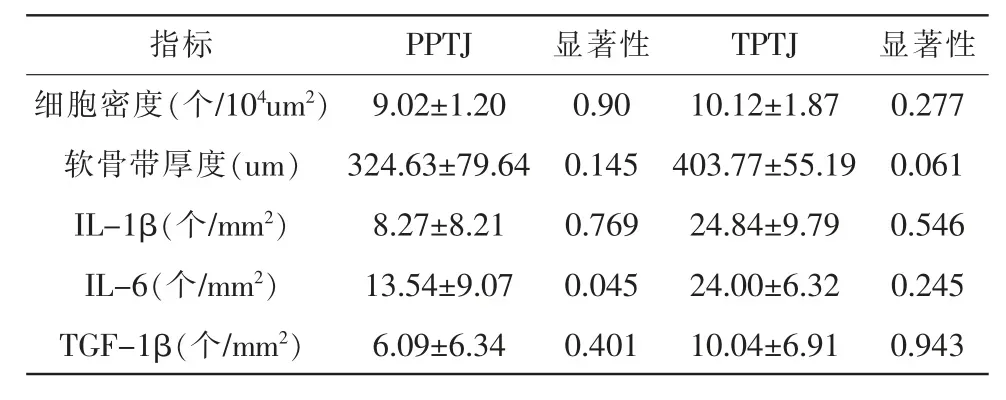
表1 干预手段对PPTJ与TPTJ指标单因素方差结果(X±SD)Table1 The results of single-factor variance of PPTJ and TPTJ indicators by intervention methods(X±SD)
图2 结果显示,J1P组PPTJ的IL-6含量明显大于CON组(P=0.015)。
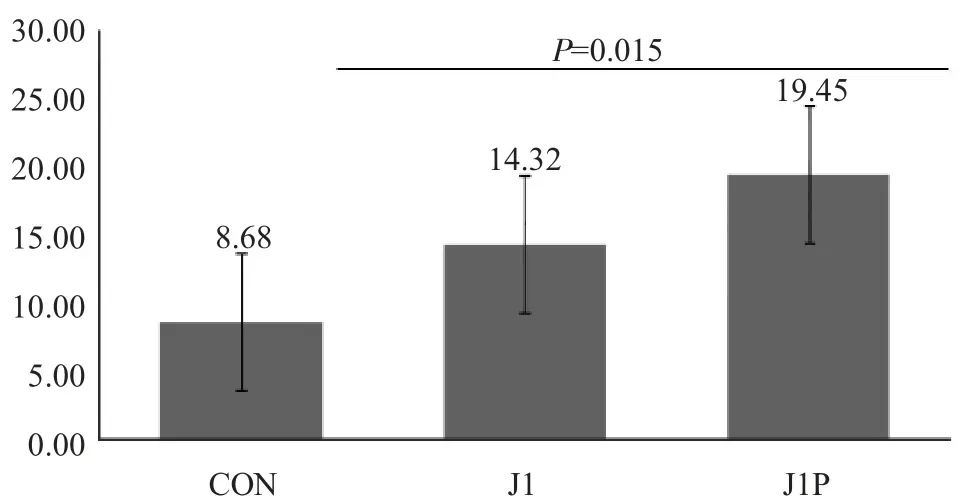
图2 干预手段对PPTJ的IL-6影响两两比较结果(个/mm2)Figure2 Pairwise comparison of the intervention effects on IL-6 of PPTJ(pieces/mm2)
由表2可知,软骨带厚度在J1P组PPTJ明显小于TPTJ(P<0.05),其他时间点均无显著性差异。

表2 PPTJ与TPTJ细胞密度与软骨带厚度的相对值比较(X±SD)Table2 Comparison of cell density and cartilage zone thickness between pptj and tptj(X±SD)
由表3可知,CON组中,PPTJ的IL-1β与IL-6明显少于TPTJ(P<0.05);J1组PPTJ的IL-1β、TGF-β1、IL-6明显少于TPTJ(P<0.05);J1P组中,PPTJ的IL-1β含量明显少于TPTJ(P<0.05)。
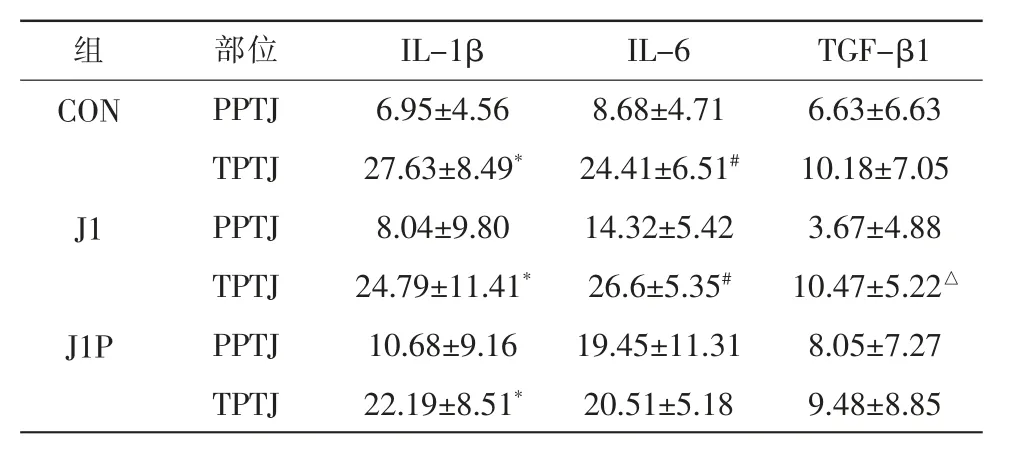
表3 PPTJ与TPTJ免疫组化指标的相对值比较(X±SD)Table3 Comparison of immunohistochemical indexes between PPTJ and TPTJ(X±SD)
3 讨论
3.1大强度跳跃负荷下p38MAPK对兔髌腱起止点组织学影响
组织学上的“潮线”指的是未钙化软骨与钙化软骨的分界线,健康骨腱结合部的潮线通常呈现圆弧形,边缘清晰,这种结构可以帮助减少软骨损伤[11]。在J1组中,一次大强度跳跃负荷使肌腱受应力刺激,细胞内胶原和基质的合成增加,新陈代谢增加,对PPTJ造成细胞核聚集、潮线形态改变、边缘模糊与上涨等情况,对TPTJ仅造成细胞聚集的情况,由此可见,在一次性的大强度跳跃负荷下,PPTJ比TPTJ更脆弱,这可能与二者在健康情况下的组织学结构有关,从CON组的实验结果来看,健康情况下的TPTJ比PPTJ结构更加致密。肌腱的波浪状纤维结构在受到外力刺激时,可以有效利用结构优势进行缓冲,这种机制在一定程度内可以避免肌腱因受力过大而产生损伤[21],J1组偏振光结果显示,PPTJ与TPTJ的胶原排列均无明显变化,说明在这一点上二者均可以良好地适应。通过文献检索未发现一次运动与骨腱结合部相关的研究成果出现,因此本文将结合与肌腱或长期运动相关的研究成果进行讨论。李敏等[22]研究发现一次性中等强度跑台运动会使鼠跟腱的胶原间隙增大、局部排列错乱,与本文结果不一致,原因可能是部位不同或取材时间不同,李敏等[22]的研究取材时间为训练后即刻,而本文的取材时间为训练后24 h,或许可以说明一次急性运动后发生的微细结构损伤可以在24 h内逐渐恢复。
申晋波等[23]发现急性力竭运动使大鼠跟腱胶原排列紊乱、间隙增大,与本实验结果不同,原因可能是取材部位的不同和其干预手段为力竭运动。在J1P组中,注射p38MAPK抑制剂使PPTJ的潮线更清晰,原本潮线更加清晰的TPTJ部位适应性能力降低。p38MAPK在运动过程中将力学因素传递到细胞内,从而使相关细胞对该刺激进行生理生化调节反应,关于p38MAPK的研究 表明:p38MAPK信 号通路的抑制使得许多病理变化得到抑制,如细胞凋亡、炎性因子的产生及基质分解酶的分解作用等[24]。本实验结果提示,一次大强度跳跃负荷下,p38MAPK在2个结合部表达被激活且对PPTJ潮线表现有消极影响,对TPTJ潮线表现有积极影响。汤婷婷[25]研究发现2周与6周跳跃会使大鼠跟腱止点中p38表达显著增加,与本研究结果类似。在损伤修复的早期,相关因子在修复的过程中会通过瘢痕形成来促进组织的连续性,同时也会激活软骨细胞的增殖分化,导致细胞数量增多。只有持续不断的负荷有效地激活了以上进程,才会使腱止点的细胞密度增加,这是组织在损伤早期对应力负荷导致细微损伤所做出的适应性反应[26]。本实验条件下未对细胞密度产生统计学影响,可见在一次大强度跳跃刺激下,p38MAPK激活与否对髌腱起止点细胞的增殖分化未起明显作用。腱止点的纤维软骨带厚度常常被用来评价该部位的损伤愈合与恢复情况。纤维软骨带厚度的增加往往是因为此处受到反复的应力刺激导致纤维软骨细胞增多,骨与肌腱之间接触面更大,使应力有所分散,且随着跳跃负荷的积累和训练时间的延长,活跃的软骨细胞会合成更多的基质,增强抗拉力[27]。
本研究结果显示,实验干预手段未使PPTJ或TPTJ各自的软骨带厚度产生明显变化。梁孝天等[28]发现4周的跳跃训练会使兔PPTJ细胞密度与软骨带厚度显著增加,与本文结果不符,这可能是因为本实验干预时间短。虽然本实验干预未使2个结合部各自的软骨带厚度明显增加,但使二者之间的软骨带厚度差值发生了显著变化。健康的PPTJ与TPTJ之间软骨带厚度不存在显著性差异,一次大强度跳跃负荷也未明显地使二者软骨带厚度产生显著性差异,p38MAPK表达被抑制后,TPTJ的软骨带厚度显著大于PPTJ。该结果提示,一次大强度跳跃负荷下,p38MAPK信号通路被激活并影响PPTJ与TPTJ软骨带厚度差异,使二者的抗拉能力拉开差距。
3.2大强度跳跃负荷下p38MAPK对兔髌腱起止点相关因子含量影响
在腱病发展过程中,早期是否存在炎症反应及其作用尚不清楚,炎性病变能否被认为是腱病的原因目前尚无定论。IL-1β常被认为是炎症反应的核心,它影响细胞外基质降解,调节炎性介质IL-6、COX-2、PGE2的生成,调控胶原生成并促进弹性蛋白生成,改变肌腱细胞的网架结构[29]。TGF-β1则是纤维化反应的核心因子,它与肌腱的力学性能息息相关。在本实验中,只有PPTJ的IL-6含量在其适应性进程中有显著改变,J1P组明显大于CON组。Astill等[30]发现急性抗组运动后3~4 h肌腱中IL-6含量显著上升,与本文结果不符的原因可能是测定时间不同,或许说明一次急性运动后IL-6的变化可以逐渐恢复。申晋波等[23]发现急性力竭运动过程中大鼠跟腱TGF-β1表达过高,与本研究结果不符,可能是因为其实验条件为力竭运动。CON组结果说明在健康的PPTJ与TPTJ中,PPTJ中的IL-1β、IL-6含量明显少于TPTJ,而TGF-β1的含量无明显差异,即这2个部位相关的炎性反应能力存在差异,而纤维化性能在健康状态下并没有存在明显差距。跳跃与抑制并没有改变2个结合部中IL-1β含量的差异,但改变了其他2个细胞因子的结果。J1组,2个部位TGF-β1含量开始有明显差值,具体表现为PPTJ的TGF-β1含量明显少于TPTJ,可知一次大强度跳跃负荷使PPTJ与TPTJ之间TGF-β1含量差值显著增加。注射抑制剂后2个部位TGF-β1与IL-6含量的显著性差异消失,该种现象提示p38MAPK在一次大强度跳跃负荷下会对PPTJ与TPTJ之间TGF-β1、IL-6含量的差异产生影响[31]。
3.3大强度跳跃负荷下p38MAPK与兔髌腱起止点适应性反应的关系
通过本实验中的结果可知,在一次大强度跳跃负荷下,PPTJ的适应性能力弱于TPTJ,这可能是健康情况下的PPTJ无论从细胞密度还是胶原纤维的排列紧密程度都低于TPTJ,并且IL-1β、IL-6这2个炎性因子在2个部位中的原始表达量有较大差异,导致炎症反应机能有一定差异。将组织学表现与细胞因子结果结合分析,J1组大强度跳跃负荷对2个结合部均造成微细结构紊乱现象,TPTJ紊乱程度低于PPTJ,与此同时,2个部位的TGF-β1含量开始产生差异,TPTJ明显大于PPTJ,意味着此时这2个部位的纤维化进程已经产生差距[32],可以认为TPTJ此时的高TGF-β1表达对其适应性进程有积极作用。注射抑制剂后PPTJ中IL-6相比CON组显著提高,2个部位中TGF-β1、IL-6含量差异消失,软骨带厚度差值明显增大,且此时原本适应能力更强的TPTJ在组织学上的表现差于PPTJ。软骨带厚度增加有时被看作是一种正面的适应性反应,但在本实验J1P组中,组织学上TPTJ表现更差,推测在J1P组中,TPTJ软骨带厚度明显大于PPTJ并不能被认为是PPTJ正面的适应性反应,反而会减弱整个骨腱结合部区域的组织柔韧性与肌腱的抗牵拉能力[33-34]。该结果提示,一次大强度跳跃负荷下,抑制p38MAPK会使原本TPTJ优于PPTJ的现象扭转。
一次大强度跳跃负荷下,p38MAPK会对PPTJ与TPTJ的适应性反应产生影响,抑制前TPTJ优于PPTJ,抑制后情况发生反转。本研究结果显示,p38在腱病发展过程中的作用值得进一步研究,以形成成熟的研究成果运用于实际运动中。使用p38抑制剂在特定时间段对特定部位进行干预,从而降低腱病发展的可能性或推迟腱病发展过程中的时间节点。
4 结论
4.1一次大强度跳跃负荷会引起PPTJ与TPTJ微细结构变化(TPTJ的微细结构变化优于PPTJ)并使PPTJ与TPTJ之 间TGF-β1差 值 显 著 增 大,p38MAPK被抑制后结局相反。
4.2一次大强度跳跃负荷下,p38MAPK的活化会维持PPTJ中IL-6含量的稳定,p38MAPK被抑制使PPTJ与TPTJ之间IL-6含量显著性差异消失。
