2 种稀释液对公猪精液冷冻保存效果的影响
2021-11-13余开文李菊芬李琦华
杨 凯,徐 严,余开文,李菊芬,李琦华,李 丽
(1.云南农业大学动物科学技术学院,云南 昆明 657206;2.云南滇东猎人农林开发有限公司,云南 昭通 657000;3.云南省昭通市昭阳区畜牧兽医技术推广服务中心,云南 昭通 657000)
随着养猪业的不断发展进步,人工授精技术在养猪业上取得成功,并在很大程度上提高了养猪业的养殖效益。然而,人工授精技术的推广离不开对猪精液进行长期有效的保存。因此,解决猪精液长期保存问题成为人工授精技术得以广泛应用的关键。1956年,Polge等[1]首次成功进行猪精液的冷冻和保存,并利用人工授精技术获得仔猪。尽管猪精液冷冻保存技术已经取得很大的进展,但与牛、羊相比,猪冷冻精液的生产难度大,精液冷冻保存活率低,受胎率和产仔数不如鲜精液[2],导致猪冷冻精液很难广泛应用于生产中,同时也制约了我国地方猪的改良和地方养殖业的发展。近几年,由于非洲猪瘟的传播,很多地方养殖企业面临严重威胁。为防止非洲猪瘟传播而导致的地方猪减少生长面临灭绝的问题,本研究通过比较2种猪精液冷冻稀释液、解冻液及冷冻-解冻程序对猪精液冷冻效果的影响,以期获得最佳的猪精液冷冻稀释液、解冻稀释液配方及冷冻-解冻程序,为地方猪养殖企业猪冷冻精液的生产提供参考。
1 材料与方法
1.1 试验动物
云南农业大学后山实习猪场1头性成熟、体质健康、性欲旺盛的滇南小耳猪。
1.2 仪器
HH-4 电热恒温水浴锅、303-1B 电热恒温培养箱、DGS-280C高压灭菌锅、IMS-60制冰机、AK-RO-C2超纯水机、LC-LX-H165A 低温高速离心机、SK2009H3 生物显微镜、4 ℃BC18 风冷式陈列柜、BCD-118S 冰箱、85-2 磁力搅拌器、PHS-3C pH 计、FA2004N 电子天平、101-2B 干燥箱、8807探针式低温温度计、Discovery-10000S移液枪、采精器械等。
1.3 试剂
Ⅰ号精液稀释液试剂包括原精稀释液粉(AndroPro®Plus)、冷却保护稀释液粉(AndroPro®CryoGaurdTM)、乳化剂(Equex STM paste)、甘油、解冻稀释粉(AndroPro®CryoGaurdTM-Tham),由德国米尼图公司生产,购自北京田园奥瑞公司;Ⅱ号精液稀释液试剂包括乳糖、青霉素、甘油,Ⅱ号稀释液解冻剂包括葡萄糖、氯化钠、氯化钾、碳酸氢钠、乙二胺四乙酸二钠、硫酸卡那霉素,由云南农业大学蜂学楼实验室提供。
1.4 稀释液的配制
在磁力搅拌器上使用量筒准确量取超纯水于烧杯中,使用电子天平按照稀释液配方准确称取各试剂,溶解于烧杯中,过滤,分装于50 mL 离心管中配制成Ⅰ号冷冻稀释液原精稀释液,放于4 ℃冰箱保存;按配方比例往烧杯中加入超纯水、试剂及无蛋白卵黄充分溶解;放于离心机上800 r/min 离心1 h,过滤,分装于50 mL 离心管中配制成Ⅰ号冷冻稀释液冷却液,于4 ℃冰箱保存。Ⅱ号冷冻稀释液的冷却稀释液按配方进行配制,按比例加入无蛋白蛋黄,离心机800 r/min 离心1 h,过滤分装,保存于4 ℃冰箱。Ⅰ号、Ⅱ号冷冻稀释液的解冻液按配方进行配制、步骤同上、待酸碱度稳定后分装于50 mL 离心管中放入4 ℃冰箱保存。采精前1 d,将配好的Ⅰ号、Ⅱ号冷冻稀释液的冷却液按配方比例加入甘油,并在磁力器上搅拌溶解配制成Ⅰ号、Ⅱ号冷冻稀释液的冷冻液,保存于4 ℃冰箱备用。两种冷冻稀释液配方见表1、表2。

表1 Ⅰ号精液冷冻稀释液、解冻液配方Tab.1 Ⅰnumber Frozen diluent,defrost liquid formula

表2 Ⅱ号冷冻稀释液、解冻液配方Tab.2 Ⅱnumber Frozen diluent,defrost liquid formula
1.5 精液采集
手握法采集公猪精液,采精前先准备好纱布和预热至约36 ℃的套入保鲜袋的集精杯,使用消毒液擦洗公猪包皮,采精后选择中段精液使用4层纱布过滤,并用生物显微镜观察精子的活力、形态,选择精子形态正常、活力70%以上、无异味、色泽乳白色、密度大的精液放入保温壶中,2 h内带回实验室进行试验。
1.6 精液的稀释与平衡
稀释前先将精液预热至32~35 ℃,用移液枪取10 μL于载玻片上,加盖玻片,并在200倍生物显微镜下观察精子活力,再用移液枪取10 μL 精液注入事先配好的盛有1.99 mL 的3.0%氯化钠溶液的试管内混匀,成为200 倍的稀释精液,将备好的血细胞计数板用血盖玻片盖好计数室,用移液枪移取稀释精液于血盖玻片边缘,使稀释精液自行流入计数室,均匀充满;同样的方法给另一计数室加样,静置5 min,在200 倍生物显微镜下观察并计数两个计数室各5个中方格的精子数,取平均值。
Ⅰ号冷冻稀释液稀释与平衡程序采用三步稀释法,把原精稀释液预热至32~35 ℃,按1∶1 的比例与采集的精液混合进行稀释,稀释后放于2 5℃条件下平衡1~2 h,再放于17 ℃条件下平衡2 h,把稀释后的精液分装入50 mL 离心管中,在温度为17 ℃、离心力为800 g 的条件下离心12~20 min,吸去上清液;然后用预热至17 ℃的Ⅰ号冷却稀释液与17 ℃下层沉淀精液1∶1混合均匀,将重悬浮后的精子置于盛有适量17 ℃水的烧杯中,放于4 ℃低温风冷式陈列柜中降温平衡2.5~3 h 使精液缓慢降温至4~5 ℃,并在4~5 ℃下继续平衡0.5~1 h,再等温加入与重悬浮后精液体积相等的Ⅰ号冷冻稀释液,轻轻晃动混匀后立即在5 ℃低温环境下用0.25 mL 的麦角细管灌装封口,并在细管托架上码好。
Ⅱ号冷冻稀释液稀释与平衡程序采用两步稀释法,先将采集的精液分装入50 mL离心管中,在温度为17 ℃、离心力为800 g 的条件下离心12~20 min,吸去上清液;然后用预热至17 ℃冷却的Ⅱ号冷却稀释液与17 ℃下层沉淀精液1∶1混合均匀,将重悬浮后的精子置于盛有适量17 ℃水的烧杯中,放于4 ℃低温风冷式陈列柜中降温平衡2.5~3 h使精液缓慢降温至4~5 ℃;并在4~5 ℃下继续平衡0.5~1 h,再等温加入与重悬浮后精液体积相等的Ⅱ号冷冻稀释液,轻轻晃动混匀,立即在5 ℃低温环境下用0.25 mL的麦角细管灌装封口,每管灌入0.2 mL 精液,麦角细管事先做好标记放在5 ℃低温环境中,封好口的麦角细管立即在细管托架上码好,并计时熏蒸。
1.7 精液的冷冻
精液的冷冻采用液氮冷冻熏蒸法,Ⅰ号、Ⅱ号冷冻稀释液精液冷冻步骤一致,将可上下调动的细管冷冻架置于盛有液氮且标记好刻度线的自制冷冻泡沫箱内,调节细管托架使细管距液氮面4 cm熏蒸10 min,将麦角细管封口向上直接投入装有液氮的液氮罐中保存。按上述方法再封装一批细管,调节细管托架使细管距液氮面5 cm,熏蒸10 min 后将麦角细管封口向上直接投入装有液氮的液氮罐中保存。
1.8 精液的解冻及活力检测
从液氮中取出冷冻24 h以上的精液麦角细管,迅速放入37 ℃水浴锅中,0.25 mL 麦角细管冷冻精液水浴解冻30 s,使用卫生纸擦干细管,把管中气泡轻摇到封口段,在气泡处剪开,开口向上,翻转细管把精液流入预先预热至37 ℃解冻液中,0.25 mL麦角细管冷冻精液加入4.5 mL解冻液中,平衡5~20 min,移取一滴解冻液里的精液于37 ℃载玻片上,并在200倍生物显微镜下进行精子活力检测。
1.9 数据统计与分析
数据使用Excel 16.0处理,使用SPSS 25.0软件进行成对样本t检验,结果以“平均值±标准”差表示,P<0.05表示差异显著。
2 结果与分析
2.1 不同冷冻稀释剂对冻精活力的影响(见表3、表4)

表3 细管距液氮面4 cm时不同冷冻稀释剂对冻精活力的影响Table 3 Effect of different cryo-diluents on the vitality of frozen sperm when the thin tube is 4 cm away from the liquid nitrogen surface 单位:%
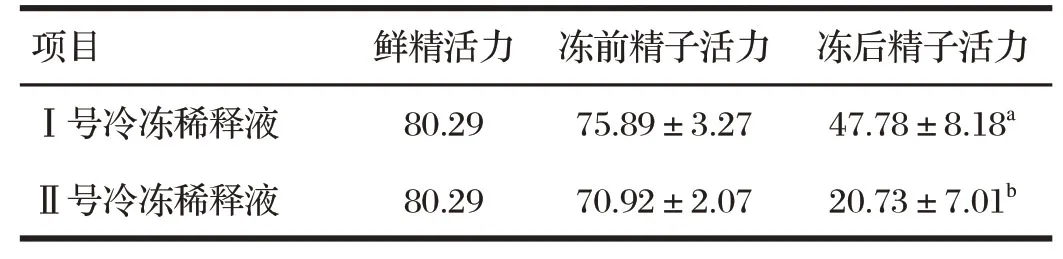
表4 细管距液氮面5 cm时不同冷冻稀释剂对冻精活力的影响Tab.4 Effect of different cryo-diluents on the vitality of frozen sperm when the thin tube is 5 cm away from the liquid nitrogen surface 单位:%
由表3、4 可知,精子冻前活力Ⅰ号冷冻稀释液试验组与Ⅱ号冷冻稀释液试验组差异不显著(P>0.05);当细管距液氮熏蒸面4 cm时,精子冻后活力Ⅰ号冷冻稀释液试验组显著高于Ⅱ号冷冻稀释液试验组(P<0.05);当细管距液氮熏蒸面5 cm时,Ⅰ号冷冻稀释液试验组精子冻后活力显著高于Ⅱ号冷冻稀释液试验组(P<0.05)。
2.2 不同液氮面熏蒸距离相同冷冻稀释剂对冻精活力的影响(见表5)
由表5可知,Ⅰ号冷冻稀释液配方稀释冷冻精液后,细管距液氮熏蒸面5 cm 试验组精子冻后活力高于细管距液氮熏蒸面4 cm 试验组,但差异不显著(P>0.05);Ⅱ号冷冻稀释液配方稀释冷冻精液后,细管距液氮熏蒸面5 cm试验组精子冻后活力高于细管距液氮熏蒸面4 cm试验组,但差异不显著(P>0.05)。

表5 不同液氮面熏蒸距离相同冷冻稀释剂对冻精活力的影响Tab.5 Effect of different liquid nitrogen surface fumigation distance and the same cryo-diluent 单位:%
3 讨论
目前,学者们对冷冻稀释液的配方持有不同的意见,导致猪冻精稀释液配方成分很不统一。但是,总体而言,猪精液冷冻稀释液配方部分成分是一致的,如基本以糖作为稀释剂,甘油作为冷冻保护剂,各类霉素作为抗生素。糖作为稀释剂在猪精液冷冻稀释液中的作用非常重要,但浓度不能太高,否则会损害精子的顶体,导致冻精活力下降[3]。张树山等[4]研究发现,在猪冻精稀释液中添加海藻糖、葡萄糖、乳糖三种双糖3.5 g/100 mL对精液的冷冻保护效果好。目前,家畜中常用的冷冻保护剂是甘油,由于物种不同,添加比例不同。江中良等[5]研究表明,在冷冻稀释液中添加2~4 mL 的甘油,对冻精的保护效果较好。精液采集和保存过程中会受到污染,临床上常添加青霉素、链霉素等杀灭精液冷冻保存过程中可能出现的有害菌[6]。
本试验对比2 种冷冻稀释液对精子冻后活力的影响,结果发现,Ⅰ号冷冻稀释液冻精效果显著优于Ⅱ号冷冻稀释液。Ⅱ号冷冻稀释液配方中本应加入1.5%的OEP,但因无法购得该试剂,因此导致配方中缺少OEP,这可能是Ⅱ号冷冻稀释液冻精活力较低的原因。目前,OEP是猪精液冷冻稀释液中常用的一种添加剂。周佳勃等[7]研究发现,在冷冻稀释液配方中添加1%的OEP,细管法冷冻猪精子的活力提高6%,同时能使精子的活率、弯尾率和顶体完整率明显提高。杜立银等[8]研究发现,将OEP作为冷冻稀释液配方中的添加剂的确提高解冻后猪精子的活力。殷方芝[9]研究发现,添加0.5%OEP能提高猪冻精活力。上述研究表明,OEP 在猪冷冻稀释液配方中非常重要,冷冻稀释液中缺少OEP 会导致冻精活力降低。生产中应保证猪冷冻稀释液配方中OEP的添加,以使解冻后的精子保持较高活力,利于人工授精的成功概率。
本试验采用2 种稀释方法,Ⅰ号液冷冻稀释液采用三次稀释法,Ⅱ号冷冻稀释液采用二次稀释法。二次稀释法少了原精稀释环节,虽然可以降低母猪输精过程中精子的用量[10],但这种方法不利于长距离运输后制作冻精。本次试验采集的精液经一定距离运输回实验室进行试验,可能就是本次试验中Ⅱ号冷冻稀释液冷冻精液效果显著低于Ⅰ号液冷冻稀释液冷冻精液效果的原因之一。目前,比较常用的是三次稀释法,适用于各种细管的冷冻。夏天等[11]采用三次稀释细管法制作猪冻精,解冻后活力较高,给6头母猪输精后,得到9.16 头的产仔数,表明三次稀释法在细管冻精中的效果好。
精液在冷冻保存过程会受到热、机械、化学和渗透压的影响,从而导致活力大幅度下降[12]。另外,冷冻速率也会影响猪精液的冷冻的效果,冷冻过慢、过快都会使精子被破坏。禚艳书等[13]研究发现,0.25 mL 细管适宜冷冻速率为50 ℃/min。细管精液的冷冻方法、细管距液氮面的距离及细管冷冻时间也会影响冻精活力。禚艳书[14]研究发现,冻精细管冷冻时采用液氮熏蒸法冷冻的效果较直接投入液氮好。液氮熏蒸时间过短、过长均会影响冻精活力,高俊锋等[15]研究发现,0.25 mL 细管在液氮面熏蒸10 min再投入液氮获得最佳的冷冻效果。章啸君等[16]对金华猪精液进行液氮熏蒸冷冻,也得出液氮熏蒸10 min再投入液氮有较好的冷冻效果。细管距液氮面的距离也会影响冻精活力,但各种报道得到的结果并不一致。刘运镇[17]研究发现,细管距液氮面3 cm的冷冻效果优于1 cm和5 cm,张伟[18]研究发现,细管距液氮面4 cm时冷冻效果较好。本试验中,两种冷冻稀释剂均采用0.25 mL 细管和10 min 液氮熏蒸法。但由于距液氮熏蒸面距离不一样,解冻后的活力也有所差异。试验结果发现,细管距液氮面5 cm 时,两种冷冻稀释液的冷冻效果优于细管距液氮面4 cm 的冷冻效果,但差异不显著。解冻温度和时间对冻精的活力也有影响。大量研究表明,0.25 mL 细管的冻精解冻温度和时间为37 ℃、30 s 时,冻精解冻后的活力最佳[19-21]。本试验两种冷冻稀释剂解冻温度和时间为37 ℃、30 s,确保冻精解冻时活力达到最佳。
4 结论
本试验结果表明,使用Ⅰ号冷冻稀释液进行猪精液冷冻的效果较好,且细管距液氮熏蒸面5 cm 时,冻精解冻后精子的活力较高;Ⅱ号冷冻稀释液冷冻的猪精液活力较低,主要原因可能是没有添加OEP,造成解冻后精子活力较低,同时可能由于自制冷冻泡沫箱未密封好,造成液氮熏蒸时温度有波动,导致精液冷冻效果降低。
