皮质醇及其衍生物(倍他米松)对青鳉性腺分化影响的探究
2021-11-13向家志苏冒亮张俊彬
向家志, 苏冒亮, 张俊彬, 2, *
皮质醇及其衍生物(倍他米松)对青鳉性腺分化影响的探究
向家志1, 苏冒亮2, 3, 张俊彬1, 2, *
1. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306 2. 深圳大学生命科学与海洋学院海洋生物资源与生态环境科学深圳重点实验室, 深圳 518060 3. 深圳大学光电工程学院光电子器件与系统教育部和广东省重点实验室, 深圳 518060
皮质醇(Cortisol)是鱼类主要的糖皮质激素, 其含量的高低变化会对鱼类性别分化与性激素合成产生关键影响。倍他米松(Betamethasone)是由人工合成的皮质醇衍生物, 在多个国家和地区的自然水域中被频繁检测到, 对鱼类的生殖造成了很大的危害。本研究以日本青鳉()为实验对象, 将获得的青鳉胚胎分别暴露于含20、200和2000 ng·L-1倍他米松或皮质醇的孵化液中, 研究皮质醇及其衍生物-倍他米松对青鳉仔鱼阶段性激素合成酶与性腺分化的关键节点基因表达的影响, 评估其对性腺分化与生殖内分泌的影响。结果表明, 2000 ng·L-1皮质醇暴露加速青鳉胚胎孵化, 孵化时间提前1天, 200与2000 ng·L-1暴露组倍他米松胚胎孵化时长延缓2天。在仔鱼性腺分化阶段, 皮质醇与倍他米松处理都引起类固醇激素合成酶与性腺分化的关键节点基因表达的显著变化。皮质醇处理下仔鱼的基因表达水平均出现显著下降(<0.05), 对雌雄激素合成具有抑制效果, 且抑制效果与暴露浓度呈正相关。倍他米松处理下,基因表达水平显著下降, 且基因表达水平显著上升(<0.05), 该结果提示倍他米松处理对青鳉仔鱼有潜在的雄性化。倍他米松与皮质醇暴露下,基因表达水平均下降, 该结果表明两种糖皮质激素暴露会延缓仔鱼性腺的分化过程。综上所述, 皮质醇与倍他米松的暴露均会干扰生殖内分泌系统, 并延缓仔鱼的性腺分化, 其中倍他米松暴露可能会诱导仔鱼的雄性化。
倍他米松; 皮质醇; 青鳉; 性腺分化; 基因表达
0 前言
皮质醇(Cortisol)是硬骨鱼类主要的糖皮质激素, 由肾间组织分泌合成,参与多种应激反应, 调节体内血糖、渗透压平衡与免疫功能[1]。大量研究表明,硬骨鱼体内皮质醇水平的高低对鱼类性腺分化有着关键影响。高温诱导下日本比目鱼()体内皮质醇含量升高,抑制芳香化酶(Aromatase)基因表达,同时出现雌至雄性逆转的现象[2]。暴露皮质醇下的日本雌性青鳉()出现雄性表型[3]。暴露皮质醇抑制日本比目鱼卵巢发育, 导致鱼群雄性比例上升[4]。体内皮质醇含量升高会导致鱼体内雄激素分泌增加,从而诱导雌鱼雄性化[5]。
倍他米松(Betamethasone)是人工合成糖皮质激素类(Synthetic glucocorticoids)药物,被用于治疗炎症与过敏等症状[6]。人类活动导致倍他米松随医疗、畜牧、生活废水进入自然水环境中[7-9]。医院排放的医疗废水中倍他米松含量可高至1720 ng·L-1[7]。与皮质醇相比,倍他米松在环境中更难降解[10]。工业化污水处理无法完全降解和消除水体中的倍他米松,其清除率只有68—85.5%[7-8]。因未经处理的废水排放导致在巴西Doce河流某段流域中倍他米松平均浓度高达246 ng·L-1[8-9]。在瑞士、捷克、英国等多个国家的自然水环境测出倍他米松平均浓度范围在1—15 ng·L-1[7]。倍他米松会通过与鱼体内的糖皮质激素受体结合,行使糖皮质激素功能, 对于性腺分化有着关键影响。目前研究表明倍他米松暴露会影响斑马鱼()胚胎性激素合成途径酶、性激素受体的基因表达[11],长期处理则会导致雄性青鳉出现雌性第二性征[12]。故鱼类暴露于倍他米松会通过干扰内分泌系统,扰乱鱼类性腺分化与发育过程,进一步导致鱼类生殖能力受损, 对生态稳定带来一定风险。因此,倍他米松对于鱼类生殖的影响值得深入探究。
日本青鳉因具有胚胎透明、第二性征明显、性成熟时间短、性别可塑性强及对环境污染物敏感等特点, 已被广泛应用于毒理学等领域研究中,是研究污染物毒性效应的良好模型生物。本研究选用日本青鳉鱼为实验鱼, 基于环境中倍他米松浓度对其胚胎进行暴露,观察胚胎孵化情况, 测定倍他米松与皮质醇处理后仔鱼阶段性激素合成途径相关基因 aromatase ()hydroxysteroid 17-beta dehydrogenase 3()、hydroxysteroid 11-beta dehydrogenase 2()与性腺分化相关基因gonadal soma derived factor()、doublesex and mab-3 related transcription factor 1()、forkhead box L2()的相对表达变化,评估倍他米松与皮质醇暴露处理对性腺分化与生殖内分泌的潜在影响,为探究糖皮质激素类污染物对鱼类胚胎与生殖毒理机制奠定基础。
1 材料和方法
1.1 主要仪器与试剂
倍他米松(CAS号:378-44-9,纯度≥98.5%)购于萨恩华公司(中国);皮质醇(CAS号:50-23-7,纯度≥99%)购于Med Chem Express公司;总RNA提取试剂(TRIzol)购于Thermo Fisher公司;逆转录试剂盒(RR037A)与荧光定量试剂盒(DRR820A)购于Takara公司;无水乙醇, 氯化钠(NaCl),氯化钾(KCl)等其余试剂购为分析纯, 购于生工生物工程公司。体视显微镜型号为DM500,购于Leica公司。实时荧光定量仪型号为Applied Biosystems 7300 Real- Time PCR System,购于Thermo Fisher公司。
1.2 实验动物
青鳉亲鱼购自Shanghai FishBio公司, 平均体质量0.35±0.5 g,养殖于20 L透明水箱, 水温维持25 ± 1 ℃,早晚各投喂鲜活卤虫饵料一次,保持每日光暗比为14 h:10 h。每日收集青鳉胚胎, 放入清水用镊子将其逐个分开,通过体式显微镜观察剔除未受精胚胎。
1.3 暴露实验
青鳉鱼胚胎孵化液为5 g NaCl, 3 g KCl, 0.4 g CaCl2·2H2O, 1.6 g MgSO4·7H2O溶于1 L无菌水中。本实验设置空白组、对照组(等量无水乙醇处理)、倍他米松处理组(倍他米松质量浓度为20、200、2000 ng·L-1)及皮质醇处理组(皮质醇质量浓度为20、200、2000 ng·L-1),所有药物均用无水乙醇溶解。青鳉胚胎(n=200)养殖在各实验组培养皿中,每隔12 h更换孵化液并剔除死亡胚胎。在仔鱼出膜后3 d,投喂少量鲜活卤虫饵料,养至孵化后14 d,收集各实验组仔鱼,经液氮处理后存入-80℃冰箱。
1.4 引物合成
根据NCBI上已公布的青鳉性腺分化相关基因(NM_001278879)、(NM _001104888)、(AF319994)、(NM_001177742), 类固醇合成酶相关基因(XM_011478970)、(NM_001104791)以及内参基因-(XM_ 023958833) mRNA序列,利用Primer 5.0设计基因特异性引物,并由生工生物工程(上海)合成。引物序列见表1。利用PCR技术扩增目的片段,并利用琼脂糖凝胶电泳检测PCR产物,后续通过胶回收回收目的片段,连接至pGEM-T Easy载体,并转化到DH5α感受态细胞中,挑选单克隆菌落送测(上海生工),利用NCBI BLAST(http://www.ncbi.nlm.nih.gov/ BLAST)对测序结果进行比对分析。

表1 引物序列
1.5 cDNA合成
样品经低温研磨后, 采用TRIzol法提取总RNA,后用DEPC水溶解RNA。所有RNA样品通过凝胶电泳检测完整性,并用Nanodrop 2000(Thermo Scientific)测定RNA浓度、纯度。取500 ng RNA, 使用逆转录试剂盒将其反转合成cDNA, 后保存入-20 ℃。
1.6 基因表达变化的检测
用反转的cDNA样品为模板,采用SYBR®Premix Ex Taq试剂盒进行定量。实时荧光定量PCR (real-time quantitative polymerase chain reaction, RT- qPCR)体系(20 μL):10 μL SYBR,0.4 μL ROX Reference Dye,2 μL cDNA模板,6μL无菌水,上下游引物(10pmol)各0.8μL。RT-qPCR 程序为 : 95 ℃预变性 30 s,40个循环(95 ℃下 5 s, 60 ℃下 30s),10 ℃下 20 min。得到数据后采用 2-△△CT法分析。
1.7 数据统计
定量实验数据均以Mean士S.E.M.表示,使用SPSS软件进行数据统计,进行用单因素方差分析(one-way ANOVA),*<0.05为显著差异。用Origin 8.0软件进行作图。
2 结果与分析
2.1 青鳉胚胎孵化数据统计
在胚胎孵化至仔鱼养殖期间, 空白组与对照组的胚胎与仔鱼死亡率分别达到2.1%、3.2%。在2000 ng·L-1倍他米松暴露组死亡率最高达到5.2% (表2),该结果与对照组死亡率无明显差异。空白组与对照组在13 d时孵化率均达到90%以上。2000 ng·L-1皮质醇暴露组在12 d时孵化率达到90%,相比对照组青鳉胚胎孵化时长缩短1 d。200与2000 ng·L-1倍他米松暴露组分别在15 d与16 d时孵化率达到90%,相较对照组青鳉胚胎孵化时长增加2 d。(图1)。
2.2 青鳉仔鱼基因相对表达结果
RT-qPCR结果分析后显示,对照组与空白组中青鳉仔鱼性别决定基因与类固醇合成酶、与基因相对表达无显著差异,证明本实验以无水乙醇为处理组溶剂对基因表达并无显著影响。皮质醇暴露组所测各个基因相对表达量与浓度呈明显负相关性。相较对照组, 20 ng·L-1皮质醇暴露组,基因相对表达显著下降约2倍(<0.05)。200 ng·L-1和2000 ng·L-1皮质醇暴露组、、与基因相对表达均出现显著下降(<0.05),在2000 ng·L-1暴露组所测各个基因相对表达皆下降10倍以上。倍他米松暴露组青鳉仔鱼基因表达较与对照组,基因相对表达显著下降至约6倍(<0.05);基因表达在20与200 ng·L-1基因表达均显著升高(<0.05);基因表达在显著下降(<0.05), 20, 200, 200 ng·L-1倍他米松暴露组分别降低2.2、13.6、17.6倍。基因相对表达在各浓度均有显著升高(<0.05), 但表达升高趋势与暴露浓度呈负相关性, 其余所测基因表达均无显著变化(图2, 图3, 图4)。
3 讨论与结论
水体环境中类糖皮质激素污染物干扰水生生物性腺分化与发育过程,造成水生生物生殖能力损伤,对生态健康造成巨大威胁。本研究通过青鳉胚胎暴露环境相关浓度的倍他米松与皮质醇下,发现胚胎在倍他米松与皮质醇处理下孵化速率有着不同趋势,死亡率均小于5.2%。在对仔鱼阶段性别决定与类固醇合成酶基因相对表达进行测定,发现暴露倍他米松与皮质醇均显著改变基因相对表达量,且两者影响基因相对表达的趋势存在巨大差异,但都表明对鱼类性激素合成与性腺分化均存在潜在的不利影响。
本研究发现皮质醇与倍他米松处理对青鳉胚胎孵化时长有着不同影响。皮质醇暴露后缩短青鳉胚胎孵化时间, 有报道表明其他合成糖皮质激素类如强的松龙[13]、醋酸氟氯可的松[14]、丙酸氯倍他索[15]等均有加速胚胎孵化情况。该现象可能是由于暴露糖皮质激素可能导致孵化酶提前释放, 从而加速胚胎孵化[16]。外源性糖皮质激素倍他米松处理有延缓青鳉胚胎孵化现象, 但具体原因有待进一步探究。
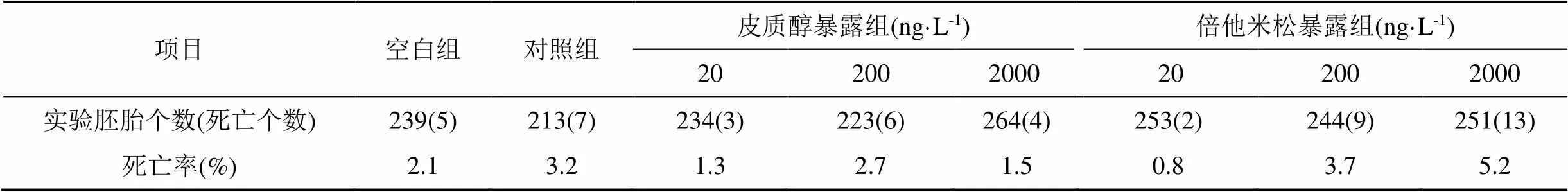
表2 青鳉存活率

图1 青鳉胚胎孵化时间
Figure 1 Hatching time of medaka embryos

图2 皮质醇或倍他米松暴露下青鳉仔鱼cyp19a1a、foxl2基因相对表达量
Figure 2 Relative expression levels of,mRNA in medaka larvae by cortisol or betamethasone exposure

图3 皮质醇或倍他米松暴露下青鳉仔鱼dmrt1、gsdf基因相对表达量
Figure 3 Relative expression levels of,mRNA in medaka larvae by cortisol or betamethasone exposure

图4 皮质醇或倍他米松暴露下青鳉仔鱼hsd17b3、hsd11b2基因相对表达量
Figure 4 Relative expression levels of,mRNA in medaka larvae by cortisol or betamethasone exposure
未分化性腺是经一系列复杂的调控过程下分化发育成精巢与卵巢。本研究中测定四类性腺分化关键调控基因,对两类糖皮质激素对仔鱼阶段性腺分化的分子层面影响进行初步探究。是脊椎动物卵巢决定与分化的标志性启动基因,它表达水平调控着基因表达[17]。基因表达的产物为P450芳香化酶,是负责将睾酮转化为雌激素的限速催化酶,因此基因表达水平对雌激素合成与卵巢分化起着重要的作用[18]。高温诱导体内高水平皮质醇抑制了日本牙鲆性腺基因表达[2]。暴露倍他米松斑马鱼胚胎导致基因表达水平显著下降[11]。与前两则研究结果相似,本研究中暴露皮质醇与倍他米松下均抑制青鳉仔鱼基因的表达。基因仅在皮质醇诱导下表达显著降低(<0.05),且与皮质醇处理组浓度呈负相关性,倍他米松处理组基因表达并无显著变化。综上表明皮质醇可能通过降低基因表达的途径,进而抑制基因表达,而倍他米松处理组则通过其他通路途径抑制基因的表达。
硬骨鱼类性腺分化期间基因会在雄性生殖细胞与体细胞中特异高水平表达,在日本青鳉中缺失基因,会导致精巢里生殖细胞退化,使雄性青鳉发生性逆转[19]。同时基因的过表达会引起雌鱼雄性化[20]。在本研究中,基因表达水平仅在20与200 ng·L-1倍他米松暴露组仔鱼中出现显著升高(<0.05),该结果表明倍他米松可能诱导仔鱼雄性化趋势。基因属于生长转化因子TGF-β家族。在青鳉鱼中敲除基因, 出现100%雌性青鳉现象[21],表明在青鳉鱼基因表达是维持未分化性腺向精巢分化所不可或缺。本研究中,两种糖皮质激素暴露皆引起青鳉仔鱼的基因表达的显著下降(<0.05),这与一些研究中发现皮质醇增加能引起基因表达上升结果并不一致[3]。本研究推测可能是由于实验鱼生命阶段不同,处理方式不同和诱导方式等多个实验条件差异导致结果差异。在性腺分化过程中, 原生殖细胞会分化为精原细胞与卵母细胞,后经分化与发育后形成相应的成熟配子。基因主要在精巢中支持细胞与卵巢中颗粒细胞中表达,对性腺中原生殖细胞与精原细胞的增殖起着重要作用[22]。因此基因在皮质醇与倍他米松暴露下表达水平显著下降(<0.05), 可能延缓仔鱼的性腺分化过程。
基因定量结果表明在皮质醇暴露组会引起它们表达水平显著降低(<0.05),倍他米松组中基因无显著变化,但与暴露浓度呈负相关性,该结果指出皮质醇与倍他米松暴露处理后可能诱导基因表达的下降,对仔鱼时期雌雄激素的“原料”睾酮的合成具有潜在不利影响[23]。暴露皮质醇诱导鱼体内11-酮基睾酮(11-ketotestosterone,11-KT)分泌增加,进而引起雌鱼的雄性化,在此过程中同时参与雄激素11-KT和皮质醇的合成的11β-羟基类固醇脱氢酶2可能起到关键作用[5]。基因表达在皮质醇暴露组与倍他米松暴露组中出现显著差异性表达,在皮质醇暴露组显著下降,倍他米松处理组显著上升趋势(<0.05)。皮质醇暴露组中基因表达显著下降可能是高水平的皮质醇引起的下丘脑-垂体-间肾轴的负反馈调节[24]。
性激素由胆固醇在各类性激素途径合成酶催化下合成,主要有维持性腺正常分化与发育,生殖细胞增殖分化,促进配子成熟的功能。在两种糖皮质激素暴露下性激素合成途径酶的基因相对表达都出现显著的变化(<0.05),该结果表明倍他米松与皮质醇暴露会扰乱生殖内分泌系统,进而影响仔鱼的性腺分化过程[23]。皮质醇与倍他米松暴露下基因表达均显著下降(<0.05), 抑制雌激素的合成,并抑制仔鱼未性腺向卵巢分化。同时,皮质醇暴露下青鳉仔鱼与基因表达显著下降(<0.05),对雄激素的合成具有抑制效果。因此, 皮质醇的暴露可能会抑制性激素的合成,抑制效果与暴露浓度呈正相关。
综上所述, 青鳉胚胎暴露皮质醇与倍他米松至仔鱼阶段,基因相对定量结果表明皮质醇与倍他米松暴露均会扰乱生殖内分泌系统,并可能延缓仔鱼性腺分化过程,其中倍他米松的暴露可能会诱导仔鱼的雄性化。
[1] TAKAHASHI H, SAKAMOTO T. The role of ‘mineralocorticoids’ in teleost fish: relative importance of glucocorticoid signaling in the osmoregulation and ‘central’ actions of mineralocorticoid receptor[J]. General & Comparative Endocrinology, 2013, 181: 223–228.
[2] YAMAGUCHI T, KITANO T. High temperature induces cyp26b1 mRNA expression and delays meiotic initiation of germ cells by increasing cortisol levels during gonadal sex differentiation in Japanese flounder[J]. Biochemical & Biophysical Research Communications, 2012, 419(2): 287–292.
[3] KITANO T, HAYASHI Y. Estrogen Rescues Masculinization of Genetically Female Medaka by Exposure to Cortisol or High Temperature[J]. Molecular Reproduction and Development, 2012, 79(10): 719–726.
[4] HATTORI R S, FERNANDINO J I. Cortisol-Induced Masculinization: Does Thermal Stress Affect Gonadal Fate in Pejerrey, a Teleost Fish with Temperature-Dependent Sex Determination?[J]. Plos One, 2009, 4(8): e6548.
[5] PERRY A N, GROBER M S. A model for social control of sex change: interactions of behavior, neuropeptides, glucocorticoids, and sex steroids[J]. Hormones & Behavior, 2003, 43(1): 31–38.
[6] KEHRL J H, FAUCI A S. The clinical use of glucocorticoids[J]. Annals of Allergy, 1983, 50: 2–8
[7] MACIKOVA P, GROH K J, AMMANN A A, et al. Endocrine Disrupting Compounds Affecting Corticosteroid Signaling Pathways in Czech and Swiss Waters: Potential Impact on Fish[J]. Environmental Science & Technology, 2014, 48(21): 12902–12911.
[8] KUGATHAS S, WILLIAMS R J, SUMPTER J P. Prediction of environmental concentrations of glucocorticoids: The River Thames, UK, as an example[J]. Environment international, 2012, 40: 15–23.
[9] FOUREAUX A F S, REIS E O, LEBRON Y, et al. Rejection of pharmaceutical compounds from surface water by nanofiltration and reverse osmosis[J]. Separation & Purification Technology, 2019, 212: 171–179.
[10] HE Yuanzheng, YI Wei, KELLY S P, et al. Structures and mechanism for the design of highly potent glucocorticoids[J]. Cell Research, 2014, 24: 713–726.
[11] RAFFAEL A W, NOELIA S G, SUSANNE F, et al. Environmental glucocorticoids corticosterone, betamethasone and flumethasone induce more potent physiological than transcriptional effects in zebrafish embryos[J]. Science of the Total Environment, 2019, 672: 183–191.
[12] VESTEL J S, HONG J Y, MENG Q, et al.JESSICA S V, JUNYAN H. The endocrine disruption potential of betamethasone using Japanese medaka as a fish model[J]. Human and ecological risk assessment, 2017, 23(4): 879– 894.
[13] PAUL L M, CAROLINA N, KATHERINE A S. Physiological and behavioral effects of exposureto environmentally relevant concentrations of prednisolone during zebrafish (Danio rerio) embryogenesis[J]. Environmental Science & Technology, 2016, 50(10): 5294–5304.
[14] ZHAO Yanbin, ZHANG Kun, FENT K. Corticosteroid fludrocortisone acetate targets multiple end points in zebrafish (Danio rerio) at low concentrations[J]. Environmental Science & Technology, 2016, 50(18): 10245–10254.
[15] WILLI R A, FALTERMANN S, HETTICH T, et al. Active Glucocorticoids Have a Range of Important Adverse Developmental and Physiological Effects on Developing Zebrafish Embryos[J]. Environmental ence & Technology, 2018, 52(2): 877–885.
[16] CLOUD J G. Deoxycorticosterone-induced precocious hatching of teleost embryos[J]. Journal of Experimental Zoology Part a Ecological Genetics & Physiology, 1981, 216(1): 197–199.
[17] BARON D, COCQUET J, FELLOUS M, et al. An evolutionary and functional analysis of FoxL2 in rainbow trout gonad differentiation[J]. Journal of Molecular Endocrinology, 2004, 33(3): 705–715.
[18] 亢逸, 关桂君, 洪云汉. 用模式生物青鳉概观硬骨鱼性别决定及性分化研究进展[J]. 遗传, 2017, 39(6): 441– 454.
[19] MASUYAMA H, YAMADA M, KAMEI Y, et al. Dmrt1 mutation causes a male-to-female sex reversal after the sex determination by Dmy in the medaka[J]. Chromosome Research, 2012, 20(1): 163–176.
[20] MATSUDA M, SHINOMIYA A, KINOSHITA M, et al. DMY gene induces male development in genetically female (XX) medaka fish[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(10): 3865–3870.
[21] ZHANG Xi, GUAN Guijun, LI Mingyou, et al. Autosomal gsdf acts as a male sex initiator in the fish medaka[J]. Scientific Reports, 2016, 6: 19738.
[22] SHIBATA Y, PAUL-PRASANTH B, SUZUKI A. Expression of gonadal soma derived factor (GSDF) is spatially and temporally correlated with early testicular differentiation in medaka[J]. Gene Expression Patternts, 2010, 10(6): 283–289.
[23] 王慧, 田华, 汝少国. EEDs对鱼类性激素合成途径干扰作用研究进展[J]. 生态毒理学报, 2013, 8(03): 306–314.
[24] CHAPMAN K, HPLMES M, SECKL J. 11β- Hydroxysteroid Dehydrogenases: Intracellular Gate- Keepers of Tissue Glucocorticoid Action[J]. Physiological Reviews, 2013, 93(3): 1139–1206.
Effects of betamethasone and cortisol on gonad differentiation of Japanese medaka
XIANG Jiazhi1, SU Maoliang2, 3, ZHANG Junbin1, 2, *
1. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China 2. Shenzhen Key Laboratory of Marine Bioresource & Eco-Environmental Science, College of Life Sciences and Oceanography, Shenzhen University, Shenzhen 518060, China 3. Key Laboratory of Optoelectronic Devices and Systems of Ministry of Education and Guangdong Province, College of Optoelectronic Engineering, Shenzhen University, Shenzhen518060, China
Cortisol, the main glucocorticoid in fish, plays a key role in gonad differentiation and sex hormone synthesis of fish. Betamethasone, as a cortisol derivative, is widely detected in aquatic environment and can cause the harm to reproduction capacity of fish. In order to study the effect of cortisol and its derivative-betamethasone on the expression of key gene of sex hormone synthase and gonad differentiation in medaka () larvae, and evaluate its effect on gonad differentiation and reproductive endocrine, the medaka embryos were exposed hatching-solution to larvae stage containing 20, 200, 2000 ng·L-1betamethasone and cortisol, respectively. The results showed that 2000 ng·L-1cortisol accelerated the embryos hatching time for 1 day, and 200 or 2000 ng·L-1betamethasone delayed the embryos hatching time for 2 days. During the gonad differentiation stage of larvae, both cortisol and betamethasone treatment caused significant changes in the expression levels of steroid hormone synthase genes and gonad differentiation-related genes. The expression levels of,,genes all decreased significantly (<0.05) by cortisol exposure, reflecting that cortisol treatment may inhibited sex hormone synthesis, and the inhibitory effect was positively correlated with cortisol concentration levels.Betamethasone exposure significantly reduced the expression levels of,, and significantly increased the expression levels of(<0.05). the results showed thatbetamethasone exposure could cause virilization. The expression levels ofgene decreased after cortisol or betamethasone treatment, which indicated the delay of the gonad differentiation of larvae. In summary, both cortisol and betamethasone exposure can disturb the reproductive endocrine system and delay the gonad differentiation of larvae. Betamethasone exposure can induce virilization of medaka larvae.
betamethasone; cortisol; Oryzias latipes; gonad differentiation; gene expression
10.14108/j.cnki.1008-8873.2021.05.003
X171.5
A
1008-8873(2021)05-016-07
2020-03-12;
2020-04-17基金项目:国家自然科学基金项目(41806177, 41976108); 中国博士后基金(2019M653010)
向家志(1995—), 男, 四川省广元市人, 硕士研究生, 从事环境毒理学研究, E-mail: xiyiangxiang@163.com
通信作者:张俊彬, 男, 博士, 教授, 主要从事海洋鱼类生理研究, E-mail: jbzhang@szu.edu.cn
向家志, 苏冒亮, 张俊彬. 皮质醇及其衍生物(倍他米松)对青鳉性腺分化影响的探究[J]. 生态科学, 2021, 40(5): 16–22.
XIANG Jiazhi, SU Maoliang, ZHANG Junbin. Effects of betamethasone and cortisol on gonad differentiation of Japanese medaka[J]. Ecological Science, 2021, 40(5): 16–22.
