长春新碱通过lncRNA XIST/miR-485-5p调控宫颈癌细胞增殖、迁移及侵袭的分子机制
2021-11-13雷玉荣
刘 宇,李 延,雷玉荣
(陕西省延安市人民医院妇产科,延安 716000)
宫颈癌是临床常见的妇科恶性肿瘤,其发病率与死亡率占据我国女性肿瘤第二位,肿瘤细胞增殖、凋亡异常与宫颈癌形成有关,目前宫颈癌发病机制尚未阐明,因而深入探究宫颈癌的发病机制有助于提高治疗效果及改善患者预后。研究表明,中药治疗具有副作用小且疗效好等特点,并可成为治疗肿瘤的重要方法之一。已有研究证实,小柴碱等具有抗宫颈癌的作用[1-3]。长春新碱是长春花提取物,属于二聚吲哚类生物碱,其具有抗肿瘤作用,研究表明,长春新碱可抑制结肠癌细胞增殖及促进细胞凋亡[4]。但长春新碱对宫颈癌细胞生物学行为的影响及其作用机制的研究报道较少。长链非编码RNA(lncRNA)在宫颈癌等肿瘤中异常表达,并可能作为治疗的潜在靶点,研究表明,lncRNA XIST 与miR-200a竞争性结合而上调Fus表达从而促进宫颈癌的发展[5]。靶基因预测显示lncRNA XIST与miR-485-5p存在结合位点,miR-485-5p通过靶向survivin抑制乳腺癌的进展[6]。基于此,本研究旨在探讨长春新碱对宫颈癌细胞增殖、迁移、侵袭的影响及其对lncRNA XIST/miR-485-5p的调控作用。
1 材料与方法
1.1 药物和主要试剂 长春新碱购自上海华联制药有限公司(纯度>98%);宫颈癌细胞HeLa购自湖南丰晖生物科技有限公司;DMEM 培养基、胎牛血清购自美国Gibco公司;胰蛋白酶购自美国Hyclone公司;Lipofectamine 2000、MTT 试剂、Matrigel 基质胶购自北京索莱宝科技有限公司;Transwell小室购自美国Corning 公司;miR-NC、miR-485-5p mimics、si-NC、si-lncRNA XIST购自广州锐博生物科技有限公司;pcDNA 购自武汉淼灵生物科技有限公司;Trizol 试剂购自美国Invitrogen 公司;反转录试剂、SYBR Green 试剂盒购自北京天根生化科技有限公司;兔抗人CyclinD1、MMP2、MMP9 抗体购自美国CST 公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自武汉艾美捷科技有限公司。
1.2 实验分组 HeLa细胞分别培养于含有不同浓度(0.02 μmol/L、0.04 μmol/L、0.08 μmol/L)长春新碱的培养液培养24 h[7],分别记为低剂量组、中剂量组、高剂量组。同时将正常培养的细胞作为NC组。pcDNA-NC、pcDNA-lncRNA XIST、miR-NC、miR-485-5p mimics 分别转染入HeLa 细胞,分别记为pcDNA-NC组、pcDNA-lncRNA XIST组、miR-NC组、miR-485-5p 组。转染过程参照Lipofectamine 2000 转染试剂说明书进行操作。分别将pcDNANC、pcDNA-lncRNA XIST、miR-NC、miR-485-5p mimics、miR-NC 与pcDNA-lncRNA XIST、miR-485-5p mimics 与pcDNA-lncRNA XIST分别转染入HeLa细胞后加入含浓度为0.08 μmol/L长春新碱的培养液培养24 h,分别记为pcDNA-NC+高剂量组、pcDNA-lncRNA XIST+高剂量组、miR-NC+高剂量组、miR-485-5p+高剂量组、miR-NC+pcDNA-lncRNA XIST+高剂量组、miR-485-5p+pcDNA-lncRNA XIST+高剂量组。
1.3 MTT 法检测细胞增殖 取对数生长期HeLa细胞(1×106个/mL),接种于96 孔板(100 μL/孔),各孔加入MTT溶液20 μL,于培养箱内继续培养4 h后弃培养液,每孔加入150 μL DMSO,室温避光孵育5 min后用酶标仪检测各孔吸光度(OD)值。
1.4 Transwell 实验检测细胞迁移与侵袭 收集各组HeLa 细胞(2.5×105个/mL)接种于小室的上室(200 μL/孔),小室的下室加入600 μL含10%胎牛血清的培养液,于培养箱内继续培养24 h,采用PBS洗涤,加入多聚甲醛固定20 min,采用PBS 洗涤后加入0.1%结晶紫染液染色10 min,观察迁移细胞数。采用预冷培养液稀释Matrigel 基质胶后加入上室(40 μL/孔),于培养箱内孵育5 h,后续实验同细胞迁移实验,观察侵袭细胞数。
1.5 qPCR 法检测细胞lncRNA XIST、miR-485-5p的表达 采用Trizol法提取各组HeLa细胞总RNA,应用Nanodrop2000c 超微量分光光度计检测RNA浓度,逆转录为cDNA,进行PCR扩增。PCR反应条件:95 ℃预变性2 min;95℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共36个循环。采用2-ΔΔCt法计算lncRNA XIST、miR-485-5p 相对表达量。XIST 正向引物5’-GTCCCCCAGCAGGCTTTATC-3’,反向引物5’-GAAAAGTGAGTGAAGGAGTA-3’;U6 正向引物5’-CTCGCTTCGGCAGCAGCACATATA-3’,反向引物5’-AAATATGGAACGCTTCACGA-3’;βactin 正向引物5’-CAGGGCGTGATGGTGGGCA-3’,反向引物5’-CAAACATCATCTGGGTCATCTTCTC-3’;miR-485-5p 正向引物5’-CAGCCAGAGTTAGCAATAGG-3’,反向引物5’-CTGTTGTTCCCGTCGGAGTT-3’。
1.6 双荧光素酶报告基因检测lncRNA XIST 和miR-485-5p 的靶向关系 Starbase 预测显示lncRNA XIST和miR-485-5p存在结合位点,将含有结合位点的片段克隆至pmirGLO 载体得到野生型载体lncRNA XIST-WT,利用基因突变技术将结合位点进行突变,将含有突变结合位点的片段克隆至pmirGLO载体得到突变型载体lncRNA XIST-MUT,miR-NC、miR-485-5p mimics 分别与lncRNA XISTWT、lncRNA XIST-MUT 共转染入HeLa 细胞,于培养箱内继续培养24 h后收集细胞,采用双荧光素酶报告基因检测系统检测各组细胞荧光素酶活性。
1.7 Western blotting 法检测CyclinD1、MMP2、MMP9蛋白表达 收集各组HeLa细胞,加入500 μL RIPA 裂解液提取细胞总蛋白,采用BCA 法测定蛋白浓度后,煮沸使蛋白变性,取蛋白样品(50 μg)进行SDS-PAGE 电泳,蛋白转移至PVDF 膜,使用5%脱脂奶粉封闭2 h,加入一抗稀释液(均1:1 000)后置于4 ℃条件下孵育24 h,采用TBST洗涤后加入二抗稀释液(1:2 000)后置于室温条件下孵育1 h,滴加ECL显影,应用Image J软件分析各条带灰度值。
1.8 统计学方法 采用SPSS 21.0统计软件分析数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 长春新碱抑制宫颈癌细胞HeLa 增殖、迁移和侵袭 与NC 组比较,低剂量组、中剂量组、高剂量组细胞活力(OD)值降低(P<0.05),迁移及侵袭细胞数减少(P<0.05),见表1。
表1 长春新碱抑制宫颈癌细胞增殖、迁移和侵袭
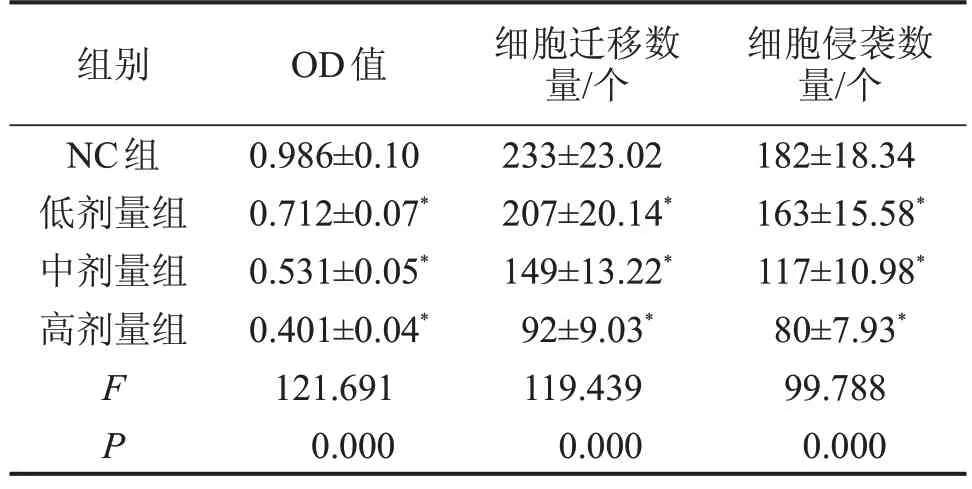
表1 长春新碱抑制宫颈癌细胞增殖、迁移和侵袭
与NC组比较,*P<0.05。
2.2 长春新碱抑制宫颈癌细胞中CyclinD1、MMP2、MMP9蛋白的表达 与NC组比较,低剂量组、中剂量组、高剂量组CyclinD1、MMP2、MMP9 蛋白水平降低(P<0.05),见图1、表2。
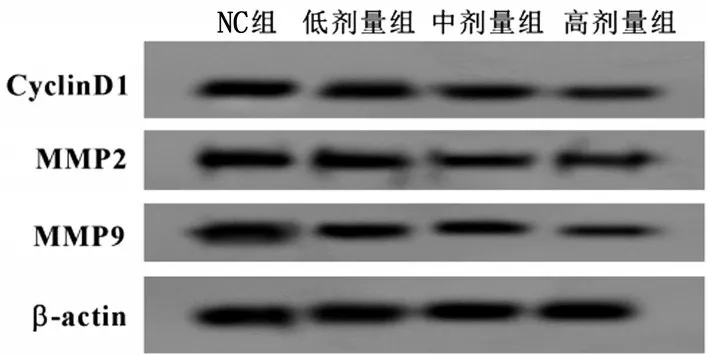
图1 Western blotting 检测宫颈癌细胞CyclinD1、MMP2、MMP9蛋白表达
表2 长春新碱抑制宫颈癌细胞中CyclinD1、MMP2、MMP9蛋白的表达
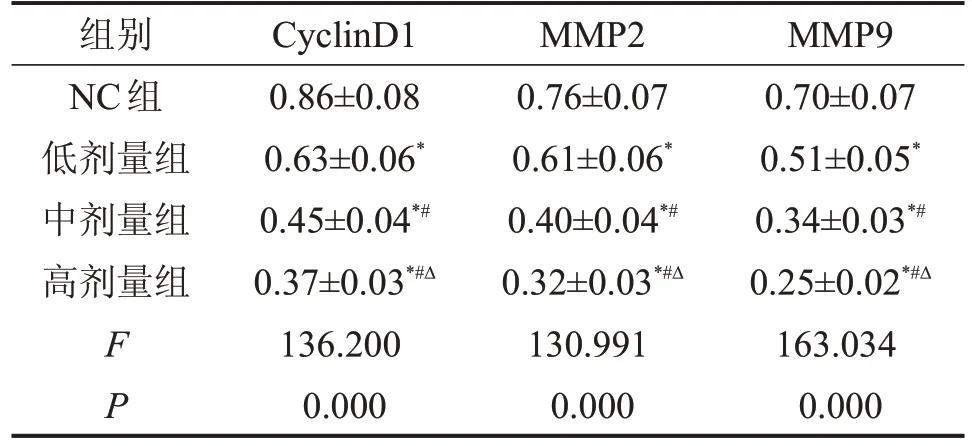
表2 长春新碱抑制宫颈癌细胞中CyclinD1、MMP2、MMP9蛋白的表达
与NC 组比较,*P<0.05;与低剂量组比较,#P<0.05;与高剂量组比较,ΔP<0.05。
2.3 长春新碱对lncRNA XIST 和miR-485-5p 表达的影响 与NC 组比较,低剂量组、中剂量组、高剂量组lncRNA XIST的表达水平降低(P<0.05),miR-485-5p的表达水平升高(P<0.05),见表3。
表3 长春新碱对lncRNA XIST和miR-485-5p表达的影响

表3 长春新碱对lncRNA XIST和miR-485-5p表达的影响
与NC组比较,*P<0.05。
2.4 lncRNA XIST 高表达逆转长春新碱对宫颈癌细胞HeLa 细胞增殖、迁移、侵袭的抑制作用 与pcDNA-NC组比较,pcDNA-lncRNA XIST组细胞活力升高(P<0.05),迁移及侵袭细胞数增多(P<0.05),CyclinD1、MMP2、MMP9 蛋白水平升高(P<0.05);与pcDNA-NC+高剂量组比较,pcDNA-lncRNA XIST+高剂量组细胞活力升高(P<0.05),迁移及侵袭细胞数增多(P<0.05),CyclinD1、MMP2、MMP9蛋白水平升高(P<0.05),见图2、表4。
表4 lncRNA XIST高表达逆转长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的抑制作用
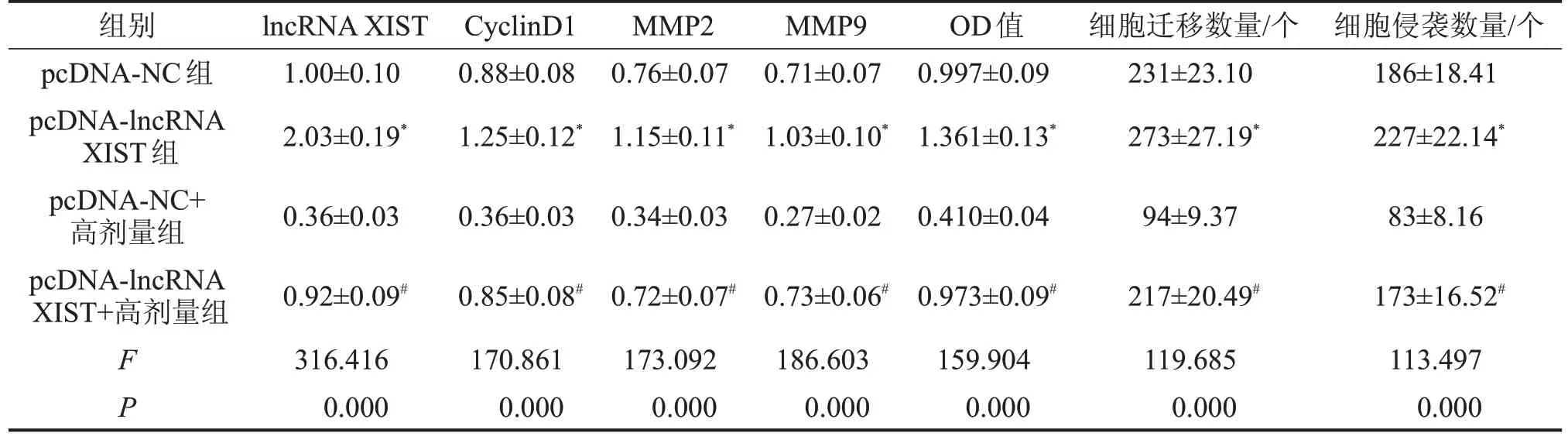
表4 lncRNA XIST高表达逆转长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的抑制作用
与pcDNA-NC组比较,*P<0.05;与pcDNA-NC+高剂量组比较,#P<0.05。
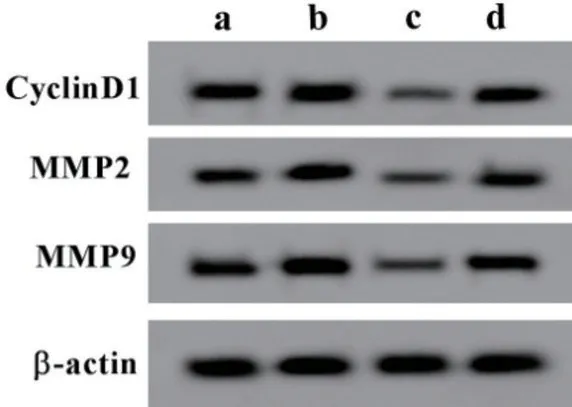
图2 Western blotting 法检测CyclinD1、MMP2、MMP9 蛋白表达
2.5 miR-485-5p 高表达增强长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的抑制作用与miRNC组比较,miR-485-5p组细胞活力降低,迁移及侵袭细胞数减少,CyclinD1、MMP2、MMP9 蛋白水平降低(均P<0.05);与miR-NC+高剂量组比较,miR-485-5p+高剂量组细胞活力降低,迁移及侵袭细胞数减少,CyclinD1、MMP2、MMP9 蛋白水平降低(均P<0.05),见图3、表5。
表5 miR-485-5p高表达增强长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的抑制作用
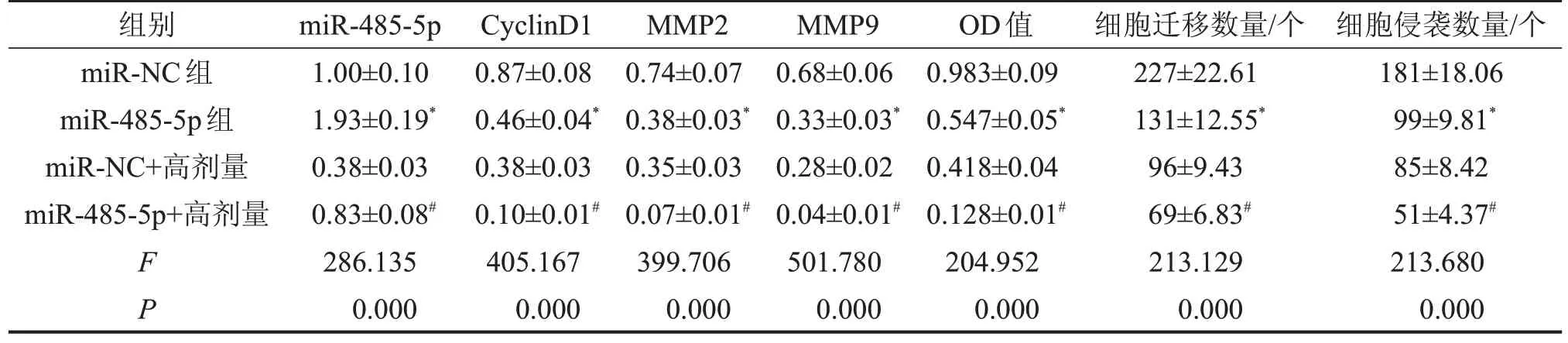
表5 miR-485-5p高表达增强长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的抑制作用
与miR-NC组比较,*P<0.05;与miR-NC+高剂量组比较,#P<0.05。
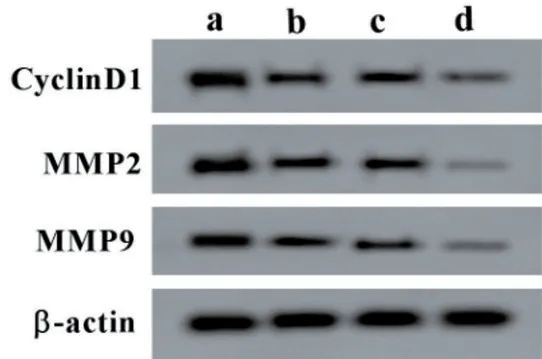
图3 Western blotting检测CyclinD1、MMP2、MMP9蛋白表达
2.6 lncRNA XIST靶向调控miR-485-5p 的表达 Starbase 预测显示lncRNA XIST 和miR-485-5p存在结合位点,见图4A。miR-485-5p过表达可明显降低野生型载体lncRNA XIST-WT的荧光素酶活性(P<0.05),而对突变型载体lncRNA XIST-MUT 的荧光素酶活性无明显影响,见图4B。与si-NC 组比较,si-lncRNA XIST 组miR-485-5p 的表达水平升高(P<0.05);与pcDNA-NC 组比较,pcDNA-lncRNA XIST 组miR-485-5p 的表达水平降低(P<0.05),见图4C。
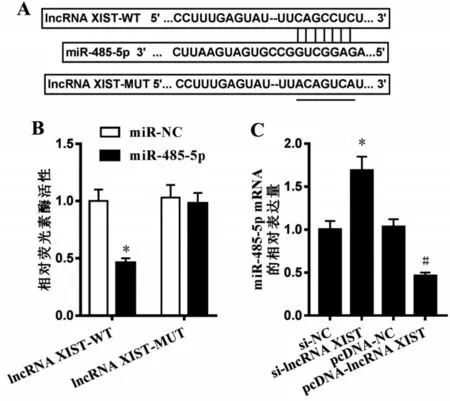
图4 lncRNA XIST靶向调控miR-485-5p 的表达
2.7 miR-485-5p 高表达逆转lncRNA XIST 高表达对长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的抑制作用 与miR-NC+pcDNA-lncRNA XIST+高剂量组比较,miR-485-5p+pcDNA-lncRNA XIST+高剂量组细胞活力降低(P<0.05),迁移及侵袭细胞数减少(P<0.05),CyclinD1、MMP2、MMP9 蛋白水平降低(P<0.05),见图5、表6。
表6 miR-485-5p高表达可以逆转lncRNA XIST高表达抑制长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的影响作用
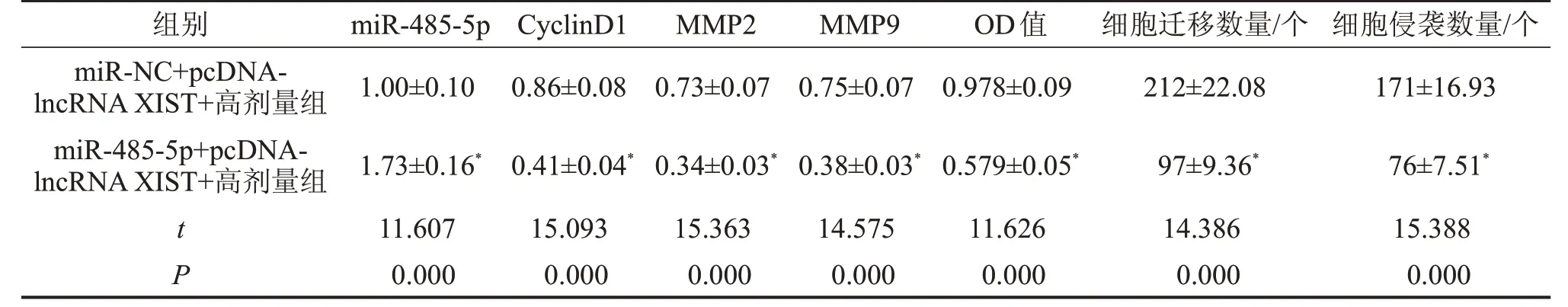
表6 miR-485-5p高表达可以逆转lncRNA XIST高表达抑制长春新碱对宫颈癌细胞HeLa细胞增殖、迁移、侵袭的影响作用
与miR-NC+pcDNA-lncRNA XIST+高剂量组比较,*P<0.05。

图5 Western blotting 法检测CyclinD1、MMP2、MMP9 蛋白表达
3 讨论
化疗、手术等是治疗肿瘤的主要方法之一,但部分患者对化疗药物产生耐药性从而降低治疗效果,患者预后较差,既往研究显示,植物提取物的活性成分具有抗肿瘤的作用,例如,华蟾素可抑制宫颈癌细胞增殖及促进细胞凋亡[8]。苦参碱可通过上调BDNF-AS 而抑制宫颈癌细胞增殖[9]。人参皂苷Rg3 可抑制宫颈癌细胞增殖及上皮间充质转化[10]。但长春新碱调控宫颈癌细胞生物学行为的作用机制尚未阐明。
长春新碱可通过下调细胞增殖与周期相关蛋白表达而诱导胃癌细胞周期阻滞,并可诱导细胞凋亡[11]。长春新碱可诱导舌癌细胞周期阻滞于细胞中期,并可促进细胞凋亡[12]。本研究结果显示,不同剂量的长春新碱处理后可明显降低宫颈癌细胞活力,并可减少迁移及侵袭细胞数。研究表明CyclinD1属于细胞周期相关蛋白,其水平升高可促进细胞周期进展,促进细胞增殖[13]。MMP2、MMP9属于基质金属酶家族成员,可降解细胞外基质,进而增强细胞转移能力[14]。为进一步证实长春新碱对宫颈癌细胞增殖、迁移及侵袭的作用,本研究采用Western blot法检测细胞增殖、迁移及侵袭相关蛋白表达,结果显示,长春新碱可明显降低宫颈癌细胞中CyclinD1、MMP2、MMP9 的表达水平,提示长春新碱可降低宫颈癌细胞增殖、迁移及侵袭能力。
目前长春新碱影响宫颈癌细胞生物学行为的分子机制尚未完全阐明,本研究结果显示,长春新碱处理的宫颈癌细胞中lncRNA XIST 的表达水平降低,提示长春新碱可能通过下调lncRNA XIST 的表达而发挥作用。lncRNA XIST/ miR-34a 轴通过MET-PI3K-AKT 信号传导调节甲状腺癌的细胞增殖和肿瘤生长[15]。lncRNA XIST下调表达通过激活miR-335/SOD2/ROS信号途径介导的细胞凋亡而抑制非小细胞肺癌的发展[16]。lncRNA XIST 通过miR-133a/EGFR 促进胰腺癌细胞增殖[17]。本研究结果显示,lncRNA XIST 过表达后可明显提高宫颈癌细胞活力,迁移及侵袭细胞数增多,lncRNA XIST过表达与长春新碱联合作用后宫颈癌细胞活力升高,迁移及侵袭细胞数增多,提示lncRNA XIST 过表达可明显降低长春新碱对宫颈癌细胞增殖、迁移及侵袭的作用。本研究证实lncRNA XIST 可竞争性结合miR-485-5p,并可负向调控miR-485-5p的表达。LncRNA LINC00460 通过调节LINC00460/miR-485-5p/ Raf1 轴而促进甲状腺乳头状癌的进展[18]。miR-485-5p通过靶向CX3CL1抑制骨肉瘤细胞转移和增殖[19]。miR-485-5p 通过阻断WBP2/Wnt 信号通路抑制肝癌的进展[20]。本研究结果显示,长春新碱处理的宫颈癌细胞中miR-485-5p的表达水平升高,进一步研究显示,miR-485-5p 过表达可明显降低细胞活力,降低迁移及侵袭能力,miR-485-5p 过表达与长春新碱联合作用后细胞活力降低,迁移及侵袭细胞数减少,提示miR-485-5p 过表达可明显增强长春新碱对宫颈癌细胞增殖、迁移及侵袭的作用。分析其原因可能为长春新碱可降低宫颈癌细胞中lncRNA XIST 的表达水平,lncRNA XIST 可竞争性结合miR-485-5p 而负向调控miR-485-5p 的表达,长春新碱可通过调控lncRNA XIST的表达而上调miR-485-5p 的表达从而发挥作用。同时,本研究采用miR-485-5p过表达、lncRNA XIST过表达与长春新碱联合处理宫颈癌细胞,结果显示,细胞活力降低,迁移及侵袭细胞数减少,提示长春新碱可通过调控lncRNA XIST/miR-485-5p 而影响宫颈癌细胞增殖、迁移及侵袭的生物学行为。
综上所述,长春新碱可通过降低lncRNA XIST的表达水平而提高miR-485-5p 的表达水平从而抑制宫颈癌细胞增殖、迁移及侵袭,lncRNA XIST/miR-485-5p 可能作为长春新碱治疗宫颈癌的潜在靶点,可为进一步揭示宫颈癌发病机制奠定实验基础,还可能为宫颈癌治疗药物的研发提供新方向。
