食管癌预后相关的miRNAs研究进展*
2021-11-13兰会华曾江辉黄雪梅
兰会华,曾江辉,黄雪梅
(1.广西壮族自治区人民医院精准联合检验中心,南宁 530021;2.广西南宁市第二人民医院检验科,南宁 530031;3.广西壮族自治区人民医院药物临床试验机构办公室,南宁 530021)
食管癌是人类常见的恶性肿瘤之一,在世界范围内发病率高居第6位,死亡率居第7位,我国男性食管癌的预计发病例数占全球所有男性食管癌的53.6%[1]。目前食管癌临床治疗仍以手术、放疗及化疗等综合治疗为主,5年生存率不到10%[2],该疾病的高死亡率是患者面临的主要挑战,如何提高治疗效果是临床工作的当务之急,随着DNA测序和药物基因组学等方面的研究进展,基于生物标志物检测的个体化治疗逐渐成为一种趋势。
MicroRNAs(miRNAs)存在于真核生物中,是一类可调控基因表达的内源性非编码单链小分子RNA,研究证实miRNAs在癌症的发生、进展和治疗中起着重要的作用,可作为多种肿瘤患者特异性生物标志物[3]。与食管癌相关的miRNAs 标志物研究逐年增多,本综述基于大量文献突出具有前瞻性的研究,根据食管癌中miRNA的表达差异与生存期的关系,分析其作为预后生物标志物和确定新的药物靶点的潜力。
1 miRNAs 的基本生物学特性
miRNAs 是一种内源性的非编码RNA,其长度约为22~24个核苷酸[4]。许多生理过程和疾病的发生发展,包括癌症、心血管和代谢性疾病,都高度依赖于miRNAs 的调控。miRNAs 主要通过抑制信使RNA(mRNA)翻译或促进mRNA降解,从而调控基因转录后水平的表达,多数miRNAs 以不完全互补方式与其靶向mRNA 的3’UTR 区(3’untranslated region)结合,从而阻碍对该mRNA的翻译来调控基因表达,但不影响mRNA 的稳定性。此外,还存在其他的调节机制,包括遗传多态性、miRNA 启动子的甲基化、不对称miRNA链选择、与RNA结合蛋白(RBPs)或其他编码/非编码RNA 的相互作用等,多种调节机制不仅调控它们的表达,还影响它们的活性和/或生物利用度[5]。
miRNA 通过作用于靶向mRNA 促使其降解或抑制其翻译,从而调节原癌基因、癌基因或肿瘤抑制因子等靶基因的表达,如具有抑制癌基因功能的miRNA表达降低可导致癌基因的过表达,而具有抑制抑癌基因功能的miRNA 过表达可导致抑癌基因表达降低,致癌基因的过表达或抑癌基因表达降低均可促进肿瘤的发生发展。
2 食管癌中调控异常的miRNAs 及其有效靶点
食管癌主要有两种类型:食管鳞状细胞癌(ESCC)和腺癌(EAC),目前临床上ESCC 占据95%,因此大量研究的主要组织学类型为ESCC。随着DNA测序的发展,在过去的十年中已经发现了成千上万的miRNAs,而miRNA与其靶基因之间的互补性不完全,每个miRNA 可以靶向数百个靶基因,并且特定的基因可以被多个miRNA 靶向。当前面临最具挑战性的问题是miRNA靶标的识别和实验验证,在此,我们总结了在食管癌中调控异常并被验证具备有效靶点的miRNAs,见表1。调控异常的miRNAs可下调或上调靶基因的表达水平,进而影响细胞的增殖、迁移、侵袭和凋亡来促进癌变,到目前为止,已发现大量miRNAs 的表达发生了显著的改变,其中一些miRNAs 通过抑制抑癌靶基因发挥致癌的作用,另一些miRNAs 通过下调致癌靶基因表现出肿瘤抑制特性。miRNAs通过各种途径对肿瘤细胞的增殖与凋亡,生长与迁移等生物学行为进行调控,参与肿瘤的发生、发展和转移,从而影响肿瘤患者的预后。

表1 在食管癌中调控异常的miRNAs及其有效靶点
3 与食管癌预后相关的miRNAs
虽然与食管癌相关的miRNAs标志物研究逐年增多,但多处于基础研究阶段,本综述基于大量文献突出具有前瞻性的研究,根据食管癌中miRNA的表达差异与生存期的关系,分析该miRNA作为判断食管癌预后标志物的效力。我们归纳总结了与食管癌预后相关的miRNAs 及其预后判断指标,包括总生存期(overall Survival,OS),无病生存期(disease free survival,DFS)或无进展生存期(progress Free Survival,PFS),采用多变量分析对比miRNA高表达组和低表达组的生存时间,用优势比(odds ratio,OR)、风险比值(hazard ratio,HR)、相对危险度(relative risk,RR)、95%置信区间(confidence interval,95%CI)和P值等进行描述,见表2。
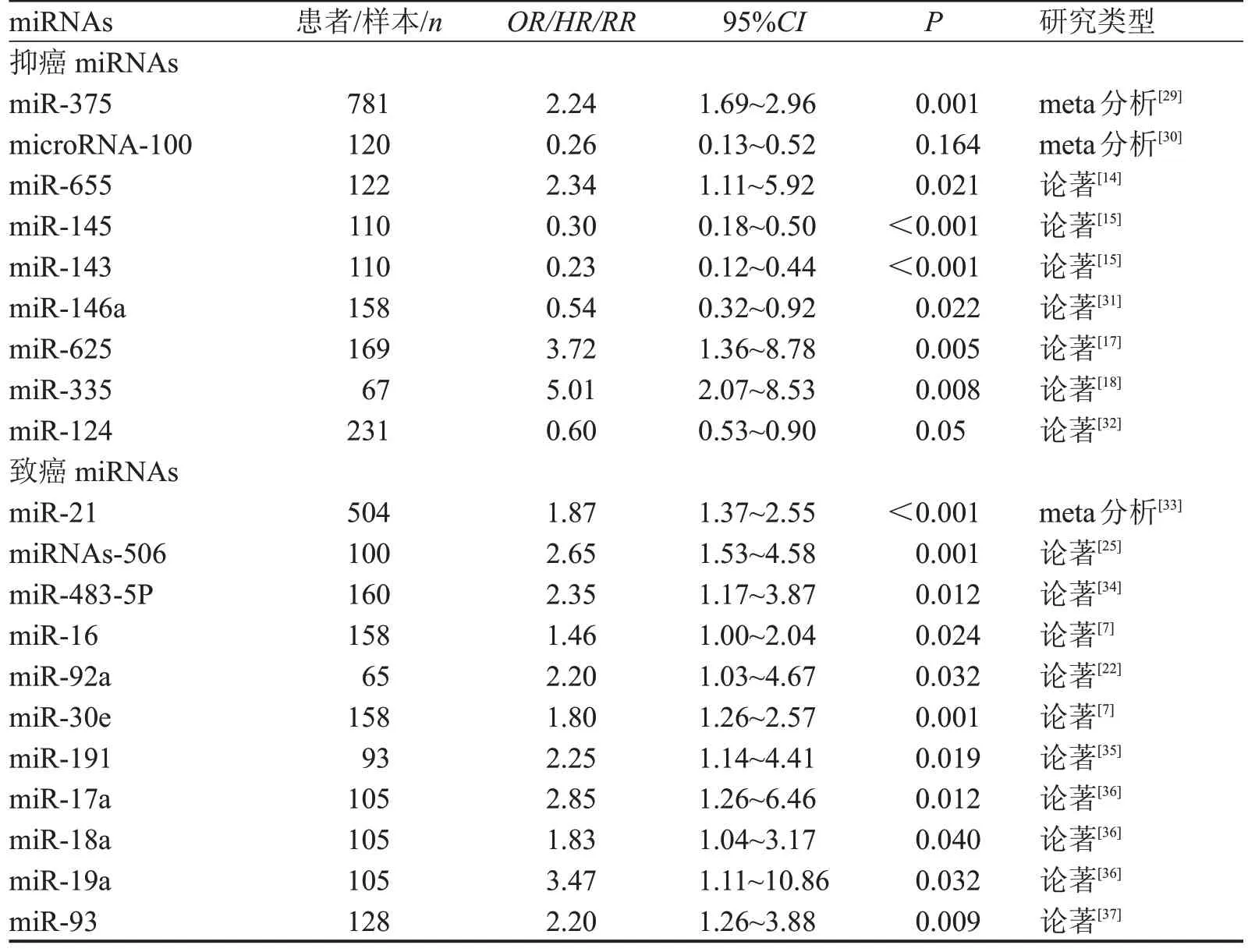
表2 与食管癌预后相关的miRNAs
3.1 miRNAs作为食管癌的独立预后因素
3.1.1 miR-146a的上调预示ESCC预后良好
miR-146a被证明能够直接调控肿瘤的关键致癌靶点,如VEGF、Notch 或其他基因位点[16]。有研究采用侵袭实验表明miR-146a-抑制剂可使食管癌细胞侵袭能力增加,在食管癌中miR-146a低表达会导致细胞增殖的增加和细胞凋亡的减少。分析miR-146a 在组织或血清样本中的表达水平与临床病理因素之间的关系,发现血清miR-146a水平具有较高的敏感性和特异性,可以作为ESCC 诊断的一种良好的非侵入性生物标志物。此外,通过比较肿瘤组织与正常组织中miR-146a 的表达差异及患者的生存时间,分析miR-146a在判断食管癌患者预后中的价值,Kaplan-Meier 曲线显示,其下调水平与OS 和PFS 呈负相关关系,进一步的单变量和多变量分析发现miR-146a 是ESCC 中OS 和PFS 的独立预后因子,T期、N期和适当的治疗也与OS或PFS有关[31]。
3.1.2 miR-655的上调预示ESCC预后良好 ZEB1和TGFBR2 是TGF-b 信号通路的重要组成部分,被认为是miR-655 的直接靶标,这表明通过对miR-655的异常下调激活TGF-b-ZEB1-e-cadherin轴可能会加速癌症的进展。研究结果显示,上皮细胞间质化(epithelial to mesenchymal transition,EMT)的抑制剂通过miR-655 靶向作用于ZEB1 和TGFBR2 可能是癌症的预后良好的标志和治疗有效的预兆[38]。Kiuchi 等[14]的研究同样证实,在食管癌中miR-655 的表达水平与较好的预后有显著的相关性,miR-655 表达水平低是淋巴转移的独立危险因素和预后较差的因素。
3.1.3 miR-625 的下调预示ESCC 预后不良 Li等[17]发现miR-625与食管癌的肿瘤深度、分期、转移有关,通过qRT-PCR 检测169 对ESCC 和癌旁组织的miR-625表达水平,发现在ESCC组织中miR-625的表达水平明显低于癌旁组织;通过K-M生存曲线和log-rank 检验进行比较,发现miR-625 低表达的ESCC 患者总生存率低于miR-625 高表达的患者。低表达组5年总体生存率低于高表达组(P=0.001),提示miR-625下调可能是预测ESCC患者肿瘤进展和预后不良的新型分子标记物。
3.1.4 miR-335 低表达提示ESCC 预后不良 研究显示,ESCC标本中miR-335的表达明显低于正常食管组织,miR-335的表达水平与组织学分级、淋巴结转移、肿瘤分期、和临床分期有显著的相关性,miR-335 可作为一个独立的预后因子,其高表达有利于患者生存。经过5年的随访调查,结果显示miR-335在ESCC 中下调与患者总生存期密切相关,在肿瘤组织中miR-335表达较低的患者的总体生存率比高表达的患者更差,证明了在ESCC 中miR-335 表达的减少可能与差的预后相关[18]。
3.1.5 miR-506 的上调提示ESCC 预后不良 miR-506 是肿瘤发生的重要调控因子,研究表明通过绑定目标mRNA,miR-506抑制靶基因的表达,参与调节和控制凋亡、周期阻滞、分化、EMT、细胞转移以及肿瘤的发生和发展的过程。Li 等[25]的研究发现,在食管癌中miR-506 高度表达,miR-506 可直接与细胞周期素依赖性激酶4/6(CDK 4/6)结合,然后与cyclinD 结合,刺激细胞周期从G1 期到S 期,此外,ets1蛋白是miR-506的重要靶点,ets1和miR-506的结合可能进一步影响食管癌血管生成,促进ESCC肿瘤细胞的生长、增殖和侵袭。根据ESCC 患者的长期随访显示,与miR-506 低表达的ESCC 患者相比,miR-506高表达的患者生存率较低,多因素回归分析显示,miR-506的高表达是预测ESCC患者预后不良的重要独立指标。
3.1.6 miR-16上调提示ESCC预后不良 Li等[26]的研究发现,miR-16 的过表达与细胞生长、迁移和侵袭、细胞周期调控的丧失以及细胞凋亡的减少有关,这一调控是通过下调靶基因基质金属蛋白酶-9(MMP9)、维甲酸受体β2 (RAR-β2)和含有Kazal 基序的富含半胱氨酸的反转录蛋白(RECK)来实现的。此外,在ESCC 中,血浆中miR-16 的高表达与明显减少的PFS 和OS 显著相关。研究还发现,miR-16 的血浆水平不仅在早期检测中表现出令人满意的诊断性能,而且对于接受放射治疗的ESCC患者来说,是一种有用的血液预后生物标志物[7]。
3.1.7 miR-191 上调预示ESCC 预后不良 有报道称,MDM4作为一种癌蛋白,通过负调控P53的功能在P53抑癌通路中发挥关键作用,定位于MDM4 非翻译区的rs4245739 A>C多态性作用于miR-191靶位点,导致MDM4表达降低。为了研究这种多态性与患ESCC的风险及其在体内的生物学功能之间的关系,用食道组织检测基因多态性对MDM4表达的影响,对来自中国两个地区的1 128例ESCC病例和1 150 例对照的两组独立病例-对照进行基因型测定,结果表明,MDM4 rs4245739 多态性有助于ESCC 的易感性,并支持了一种假设,即基因变异,中断miRNA 介导的基因调控,可能会改变癌症的风险[23]。另一研究表明,miR-191 可能通过绑定EGR1mRNA 的3’UTR 减少EGR1 表达参与ESCC的进展,作为转录因子,EGR1参与肿瘤的发生和发展,并发挥抑癌作用,进一步研究证实EGR1下调促进了ESCC 细胞的生长和侵袭[35]。多变量Cox 回归分析表明,miR-191在ESCC组织中过表达与晚期临床分期、转移和ESCC 存活率低有关,miR-191 的上调是ESCC患者生存率低的独立预后因素。为了进一步探讨miR-191在ESCC中的预后价值,采用Kaplan-Meier 分析和log-rank 检验观察miR-191 与总生存率的关系,发现在食管癌中,miR-191高表达组较低表达组存活时间短,预后差。
3.2 miRNAs联合检测在食管癌预后评估中的作用
3.2.1 miR-21/miR-375 联合检测在食管癌预后评估中的作用 一项探讨血浆miR-21 在ESCC 患者中的诊断价值的研究发现,miR-21是食管癌患者的独立预后因素,可作为预测ESCC 放化疗疗效和3年生存率的有效生物标志物[33]。miR-21 上调提示食管鳞癌预后不良,使用miRNA-21 在化疗的风险分层和预测总生存期方面具有重要的临床意义[39]。此外,miR-21 过表达患者的复发概率也明显高于miR-21 低表达患者,证明miR-21 作为监测食管癌复发的敏感标志物的有效力[40]。
另一项研究[41]发现,在食管癌患者的组织和血清样本中,miR-21表达水平显著升高,miR-375则下调,这两种miRNAs的表达与浸润深度、TNM分期、血管浸润、淋巴结转移都相关,表明miR-21和miR-375 在食管癌患者中均异常表达,是影响食管癌预后的独立因素。进一步研究发现血浆中miR-21 高浓度组术后生存率明显低于低浓度组,血浆miR-375 高表达组生存率优于低表达组,血浆miR-21 高水平和miR-375低水平的患者预后明显更差。ROC分析表明联合检测miR-21 和miR-375 的诊断价值高于miR-21或miR-375的单次检测,联合检测可作为ESCC的诊断以及反映肿瘤的动态变化及预后效果的标志物。
3.2.2 miR-21/miR-93 联合检测在食管癌预后评估中的作用 最近的研究表明,miR-93-5p 可能通过PTEN/PI3K/Akt通路影响PTEN下游蛋白p21和cyclin D1 的表达,促进受体细胞增殖。miR-93-5p 在食管癌患者血浆中的表达是对照组的1.39倍,采用logistic回归分析发现血浆miR-93-5p表达上调显著增加食管病变的风险,miR-93-5p 的过表达与不良的预后显著相关,表明miR-93-5p 可作为食管癌诊断及预后判断的生物标志物[42]。
Wang等[37]的研究发现,在食管癌患者的血清样本中,miR-21和miR-93的表达水平显著升高,两者的表达均与患者的TNM 分期密切相关,miR-21 和miR-93在ESCC患者中高表达可能提示由于肿瘤的转移而导致的更差的预后。进一步的研究发现,放化疗后miR-21 和miR-93 的表达明显降低,提示观察miR-21和miR-93的变化可用于预测患者放化疗的疗效。经过对ESCC 患者进行3 年的追踪回访,发现其3年OS为37.50%,miR-21联合miR-93检测的AUC 用于评估ESCC 患者放化疗的疗效为0.894。Cox回归分析显示,患者高T期、N期、M期、高miR-21(>5.60)和miR-93(>3.87)的表达增加了死亡风险,患者miR-21和miR-93的高表达预示ESCC 患者治疗无效的风险增加,表明miR-21 和miR-93联合检测可作为判断ESCC患者预后的生物标志物。
4 结语
综上所述,许多miRNAs 标志物与食管癌的预后密切相关,miRNAs 对于判断食管癌预后生物标志物和确定新的药物靶点可能具有巨大的潜在作用。相信通过进一步的临床试验,将有更多的食管癌预后相关的生物标志物用于指导临床,为食管癌的治疗及预后评估提供新的靶标,提高临床疗效,以期可实现真正的个体化治疗。
