两株副猪嗜血杆菌辽宁分离株sRNA64和sRNA145的转录比较分析
2021-11-12贾永超周媛媛王临喜尹荣兰郭忠博王静宜尹荣焕
贾永超,周媛媛,严 平,郭 营,王临喜,尹荣兰,郭忠博,王静宜,王 超,尹荣焕*
(1.东北畜禽疫病研究教育部重点实验室,沈阳农业大学畜牧兽医学院,辽宁沈阳 110866;2.吉林省畜牧兽医科学研究院,吉林长春 130062;3.辽宁农业职业技术学院,辽宁营口 115009)
副猪嗜血杆菌(Haemophilusparasuis,HPS)能够引起猪的多发性纤维素性浆膜炎、多发性关节炎、脑膜炎,对养猪业危害极大[1]。由其作为病原引起的副猪嗜血杆菌病现已成为影响全球养猪业发展的典型细菌性疾病之一[2]。显微镜下菌株形态呈现多形性,球状或细丝状均可见,无运动性,无芽孢和鞭毛,通常可见荚膜,但是在进行体外培养时,荚膜容易丢失[3]。对于HPS血清分型,可以采用协同凝集试验(CA)、间接血凝试验(IHA)和聚合酶链反应(PCR)等方法。传统的Kieletein-Rapp-Gabriedson(KRG)琼脂扩散血清分型方法可以将HPS至少分为15个血清型,但也有26.2%菌株是不可分型的。目前HPS毒力相关因子和毒力基因的研究一直在进行,但其致病机理及其毒力因子较为复杂,因此在疾病的预防和治疗方面还存在很大的困难。
细菌small RNA(sRNA)是一类长度在40 nt~500 nt之间的RNA分子,可以在细胞基因组中被转录但不能编码蛋白质[4],大部分的sRNA存在于两个蛋白基因编码区之间,也有一些位于编码基因5′和3′ UTR区域。大多数sRNA通过与特定的mRNA靶点相互作用、调节信息稳定性、改变其对翻译机制的可及性,充当转录后调控因子[5]。研究表明,sRNA在病原微生物转录水平调控、适应环境应激、细菌毒力等方面发挥着重要作用[6-7],而HPS相关sRNA的研究还未有报道。本实验室前期转录组测序发现,sRNA64和sRNA145在血清型9型HPS(YK1603)、13型HPS(CY1201)辽宁分离株中差异表达,因此本文以这2个血清型菌株为研究对象,通过对体外不同生长期以及感染PK-15细胞后不同时间点的sRNA64和sRNA145转录情况进行分析,为sRNA在HPS不同毒力菌株致病机制中的进一步研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞 血清型9型HPS(YK1603)、13型HPS(CY1201)辽宁分离株,均由沈阳农业大学人兽共患病重点实验室保存;猪肾上皮细胞(PK-15),由长春军事兽医研究所馈赠。
1.1.2 主要试剂 胰蛋白大豆琼脂(TSA)、胰蛋白大豆肉汤(TSB)、烟酰胺腺嘌呤二核苷酸(NAD)、Gold-View(GV-Ⅱ)、cDNA反转录试剂盒,北京索莱宝科技有限公司产品;DMEM,Hyclone公司产品;2×TaqPCR Mix,上海生工生物工程技术服务有限公司产品;2×ChamQ Universal SYBR qPCR Master Mix、RNA isolater Total RNA Extraction Reagent,南京诺唯赞生物技术有限公司产品。
1.1.3 主要仪器 TC-96/G/H(b)型PCR仪,杭州博日科技有限公司产品;ABI全功能实时荧光定量PCR仪、HERAcell 150i型二氧化碳培养箱,Thermo Fisher Scientific公司产品。
1.2 方法
1.2.1 引物设计与合成 根据Olivera S设计的副猪嗜血杆菌16S rDNA引物;根据Howell设计的血清YK1603、CY1201的特异性引物;根据GenBank(登录号:CP001321.1)设计HPS 16S rRNA的RT-qPCR引物;根据转录组测序结果设计sRNA64和sRNA145的RT-qPCR引物(表1),由上海生工生物工程技术服务有限公司合成,并按照说明书稀释后保存到-20℃冰箱备用。
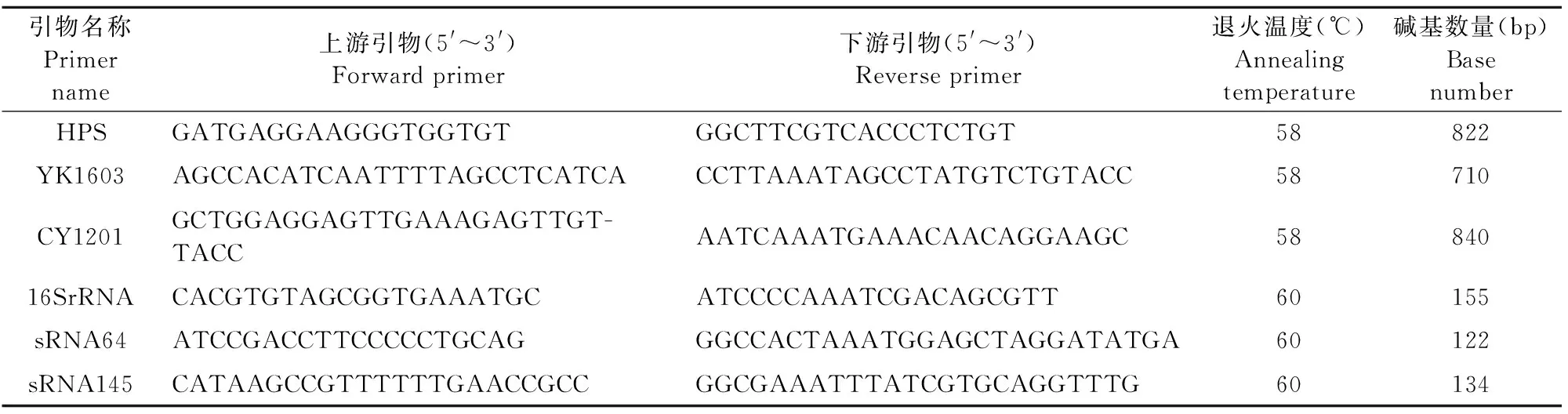
表1 相关引物及碱基数量
1.2.2 冻干细菌的复苏培养 在超净工作台中取适量的YK1603、CY1201冻干菌粉,将其加入到含有20 g/L NAD和50 mL/L血清的TSB液体培养基中,在37℃恒温振荡器中培养24 h后,取菌液均匀涂布于含有20 g/L NAD和50 mL/L血清的TSA固体培养基上,然后置于37℃恒温培养箱中培养12 h。复苏后挑取菌落进行革兰氏染色,镜检观察细菌形态。
1.2.3 16S rDNA及血清型的验证 在超净工作台中将TSA固体培养基中的菌落用无菌接种环挑取适量,混于磷酸盐缓冲液(PBS)中作为模板,PCR扩增16S rDNA序列以及血清型序列。反应体系为20 μL:10 μL 2×TaqPCR Mix,6 μL ddH2O,2 μL DNA模板,引物各1 μL,阴性对照模板为ddH2O。16S rDNA反应程序为:95℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸10 min。4℃结束反应。血清型反应程序为:94℃预变性5 min;94℃变性30 s,58℃退火30 s,68℃延伸1 min,共30个循环;68℃延伸5 min;4℃结束反应。将PCR扩增产物置于10 g/L琼脂糖凝胶电泳中,120 V电压,电泳30 min。电泳结束后,将凝胶置于凝胶成像系统中进行观察分析。
1.2.4 副猪嗜血杆菌YK1603和CY1201菌株菌量与OD600值关系曲线的测定 将菌株接种于TSA固体培养基上,待到其生长至对数期时,用无菌的PBS进行洗板,将洗下来的细菌全部放置于10 mL的离心管中,振荡器充分振荡均匀后,吸取1 mL菌液到另一离心管中,向其中加入9 mL PBS,再次用振荡器充分振荡均匀,以此方法10倍倍比稀释至10-8。稀释后取各个离心管中菌液300 μL加入到96孔板中测定OD600,每个梯度设置3个复孔,取其平均值来避免误差,然后取梯度为10-5、10-6、10-7、10-8的离心管中的菌液各100 μL,均匀涂布于适合其生长的固体培养基上,37℃恒温培养箱中正置培养30 min后,再倒置培养,待其生长至对数期时开始进行菌落计数。
1.2.5 副猪嗜血杆菌YK1603、CY1201菌株体外不同生长时期的培养 将YK1603、CY1201菌株菌量调整为1×108CFU/mL,按1%接菌量接种于TSB液体培养基中,分别取生长迟缓期(细菌生长6 h左右)、指数期(细菌生长12 h左右)、稳定期(细菌生长18 h左右)、衰亡期(细菌生长24 h左右)的YK1603、CY1201菌株提取RNA。
1.2.6 副猪嗜血杆菌YK1603、CY1201菌株感染PK-15细胞 复苏后的PK-15细胞在6孔板中培养至形成单层细胞后,将YK1603、CY1201菌株按照5×107CFU/孔侵染细胞,37℃、5% CO2条件下培养6 h后,用PBS洗涤3次,弃掉上清液,换用含双抗的DMEM培养基,继续培养3 h,杀死胞外菌后,开始计时,取时间点0 h、9 h、24 h、48 h的细胞提取RNA。
1.2.7 总RNA的提取及cDNA反转录 对体外不同生长时期的细菌与杀死胞外菌后0 h、9 h、24 h、48 h的细胞提取RNA后进行cDNA反转录,具体方法参照RNA Isolater Total RNA Extraction Reagent说明书和cDNA反转录试剂盒说明书进行,产物置-20℃保存。
1.2.8 实时荧光定量PCR 以1.2.7中的反转录产物为模板,利用转录组测序得到的结果设计的引物sRNA 64-F/sRNA64-R、sRNA145-F/sRNA145-R,16S rRNA为内参基因,进行RT-qPCR,重复试验3次。反应体系为20 μL:10 μL 2×ChamQ Universal SYBR qPCR Master Mix,7.2 μL ddH2O,2 μL模板,引物各0.4 μL。扩增反应程序为:(1)95℃预变性30 s;(2)循环反应:95℃ 10 s,60℃ 30 s,共40个循环;(3)熔解曲线:95℃ 15 s;60℃ 1 min;95℃ 15 s。
1.2.9 数据统计分析 采用2-ΔΔCt方法,运用IBS SPASS Statistics 23软件进行单因素方差分析,数据用平均数(Mean)±标准差(SD)表示,GraphPadPrism 8.0软件进行数据处理及绘图。
2 结 果
2.1 冻干细菌的复苏培养鉴定
在含有20 g/L NAD和50 mL/L血清的TSA固体培养基中可见边缘整齐、表面光滑、半透明、灰白色小菌落。革兰氏染色后油镜下观察,菌体呈红色,为革兰氏阴性菌,YK1603菌株主要呈现短杆状,CY1201菌株以细丝状为主,少数呈现短杆状(图1)。
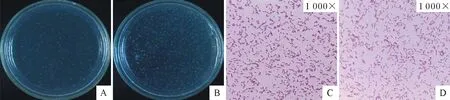
A.YK1603 TSA菌落形态; B.CY1201 TSA菌落形态; C.YK1603染色镜检结果; D.CY1201染色镜检结果
2.2 16S rDNA及血清型鉴定
将PCR产物放置于10 g/L 琼脂糖凝胶电泳中鉴定,2株HPS菌株PCR扩增16S rDNA序列产物电泳泳道均扩增出822 bp的目的条带(图2A),9型YK1603、13型CY1201菌株血清型分别扩增出710 bp、840 bp的目的条带(图2B)。该结果与预期设计扩增的片段大小均一致。
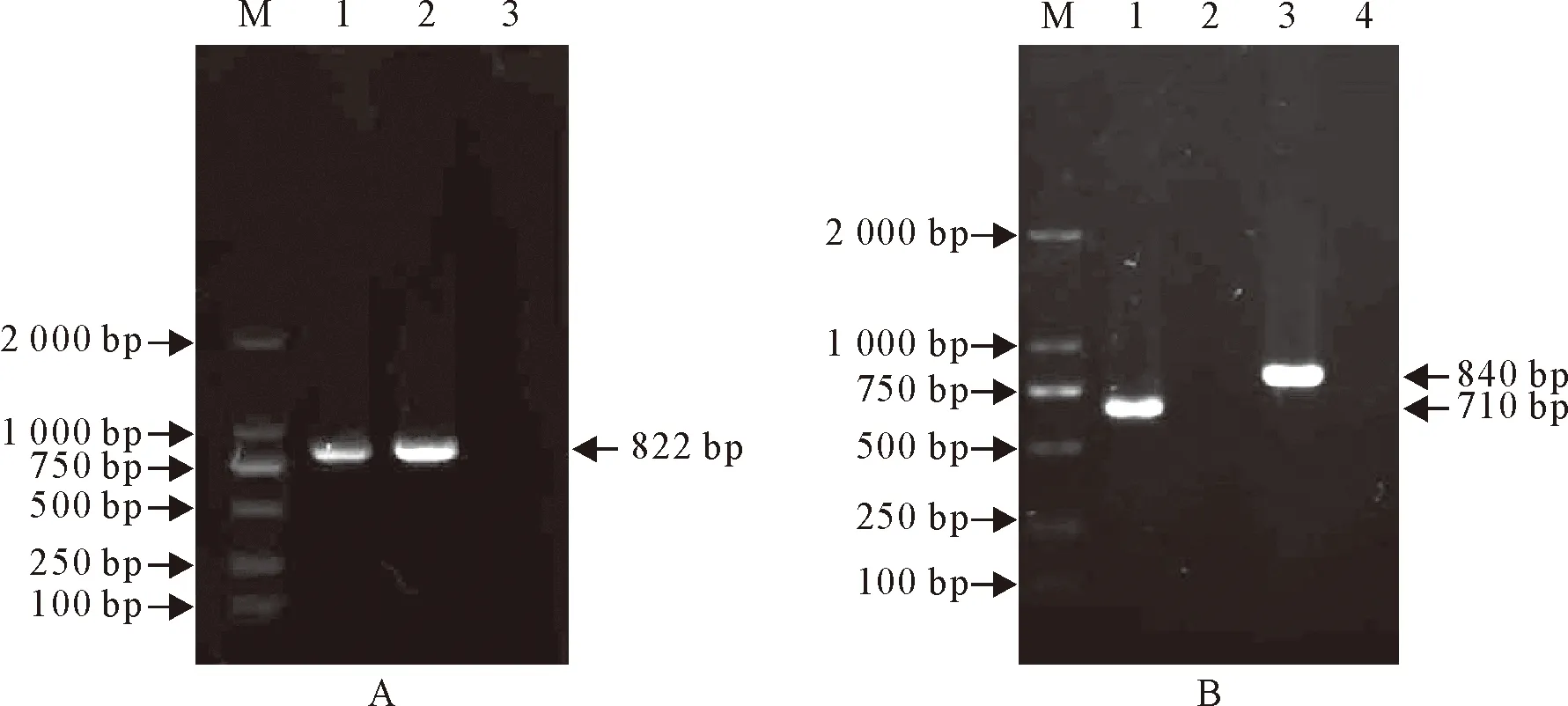
A:M.DNA标准DL 2000; 1.YK1603复苏菌株; 2.CY1201复苏菌株; 3.阴性对照; B:M.DNA标准DL 2000; 1.YK1603复苏菌株; 2.YK1603复苏菌株阴性对照; 3.CY1201复苏菌株; 4.CY1201复苏菌株阴性对照A:M.DNA Marker DL 2000; 1.YK1603 resuscitated strain; 2.CY1201 resuscitated strain; 3.Negative control; B:M.DNA Marker DL 2000; 1.YK1603 resuscitated strain; 2.YK1603 resuscitated strain negative control; 3.CY1201 resuscitated strain; 4.CY1201 resuscitated strain negative control
2.3 副猪嗜血杆菌YK1603、CY1201菌株菌量与OD600的关系
通过对YK1603和CY1201菌株生长至对数期时的菌落进行计数,计算出了菌浓度与OD600之间的关系(图3):
YK1603菌株:y=9×106x-170 974,R2=0.999 2;
CY1201菌株:y=109x-4×107,R2=0.996 3。

A.YK1603菌株菌量与OD600的关系; B.CY1201菌株菌量与OD600的关系A.Relationship between YK1603 strain and OD600; B.Relationship between CY1201 strain and OD600
2.4 副猪嗜血杆菌YK1603、CY1201菌株体外不同生长时期sRNA64和sRNA145转录分析
sRNA64在YK1603菌株生长过程中逐渐呈上调趋势,衰亡期达到转录高峰,各生长期间的转录水平无显著性差异(P>0.05),在CY1201菌株生长稳定期达到转录高峰,稳定期的转录水平极显著高于迟缓期(P<0.01),显著高于指数期和衰亡期(P<0.05),且生长过程中sRNA64的转录水平在指数期时YK1603与CY1201菌株呈现约2倍显著差异(P<0.05),稳定期呈现约8倍极显著差异(P<0.01)(图4);sRNA145在YK1603菌株生长过程中逐渐呈上调趋势,衰亡期达到转录高峰,稳定期、衰亡期的转录水平与各生长期间均存在显著(P<0.05)或极显著差异(P<0.01),而在CY1201菌株生长过程中稳定期达到高峰,各生长期间无显著性差异(P>0.05),且生长过程中sRNA145的转录水平在衰亡期时YK1603菌株与CY1201菌株呈现约15倍显著差异(P<0.05)(图5)。
2.5 副猪嗜血杆菌YK1603、CY1201菌株感染PK-15细胞后sRNA64和sRNA145转录分析
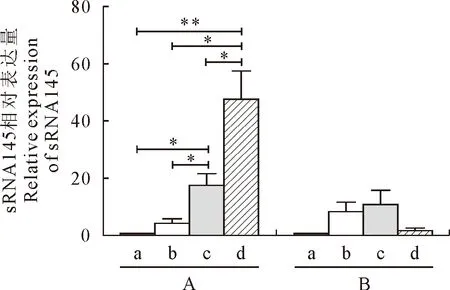
sRNA64在YK1603菌株感染细胞后呈现下调趋势,9 h、48 h的转录水平显著低于0 h(P<0.05),在CY1201菌株感染细胞后不同时间段均上调表达,9 h的转录水平显著高于0 h(P<0.05),24 h、48 h的转录水平与9 h间呈现显著差异(P<0.05),与0 h无显著性差异(P> 0.05),感染细胞后sRNA64转录水平在9 h时YK1603菌株与CY1201菌株呈现约10倍极显著差异(P<0.01)(图6);sRNA145在YK1603菌株感染细胞后各时间点的转录水平无显著性差异(P> 0.05),在CY1201菌株感染细胞后9 h的转录水平显著高于0 h(P<0.05),24 h与0 h的转录水平呈现极显著差异(P<0.01),与48 h呈现显著差异(P<0.05),两种血清型的转录水平均上调表达,在各时间点无显著差异(P> 0.05)(图7)。

A:YK1603菌株; B:CY1201菌株。a.迟缓期; b.指数期; c.稳定期; d.衰亡期; 表示两者的t检验差异具有统计学意义(*.P<0.05; **.P<0.01)
A:YK1603菌株; B:CY1201菌株。a.迟缓期; b.指数期; c.稳定期; d.衰亡期; 两者的t检验差异具有统计学意义(*.P<0.05; **.P<0.01)
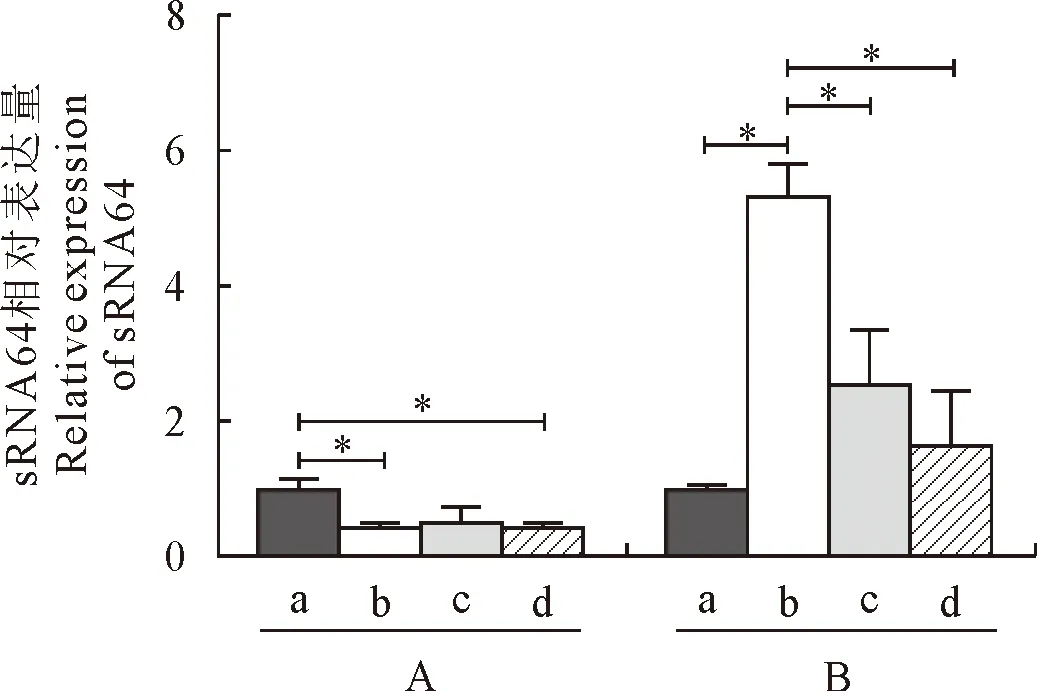
A:YK1603菌株; B:CY1201菌株。a.0 h; b.9 h; c.24 h; d.48 h; 表示两者的t检验差异具有统计学意义(*,P<0.05; **,P<0.01)
3 讨 论
随着对非编码小RNA的探索,逐渐揭示了其在细菌生命活动中扮演着重要角色。已经在大肠埃希氏菌[8]、金黄色葡萄球菌[9]、沙门氏菌[10]、布鲁氏菌[11]等细菌中发现了sRNA,并证明了sRNA进行转录后调控与细菌抵御环境应激密切相关[11-12],对于副猪嗜血杆菌相关sRNA的研究还未有报道。本研究中,sRNA64的转录水平在YK1603菌株体外不同生长期与感染细胞后趋势相反,而在CY1201菌株中大致相同且差异表达。sRNA145的转录水平在YK1603菌株体外不同生长期与感染细胞后逐渐呈上调趋势,体外不同生长期差异表达,在CY1201菌株体外不同生长期与感染细胞后趋势大致相同但在后者中差异表达。推测sRNA64、sRNA145可能分别与CY1201、YK1603菌株适应环境应激有关,同时sRNA64可能在YK1603、CY1201菌株急性感染阶段发挥作用,sRNA145可能在YK1603、CY1201菌株慢性感染阶段发挥作用。

A:YK1603菌株; B:CY1201菌株。 a.0 h; b.9 h; c.24 h; d.48 h; 表示两者的t检验差异具有统计学意义(*,P<0.05; **,P<0.01)A:YK1603 strain; B:CY1201 strain. a.0 h; b.9 h; c.24 h; d.48 h; The difference of t test between the two groups is statistically significant (*,P<0.05; **,P<0.01)
当前已鉴定的副猪嗜血杆菌毒力相关因子包括脂寡糖[13]、外膜蛋白[14]、细胞致死性膨胀毒素[15]、荚膜和生物被膜[16-17]、转铁结合蛋白[18]、神经氨酸酶[19]等。而sRNA作为一种新发现的调控因子,在李斯特杆菌[20]、链球菌[21]等研究中发现其体内的sRNA与细菌毒力相关,同时受靶基因的调控[22]。本研究中sRNA64在强毒株中呈现不同时间段转录水平的显著上调(P<0.05),而在弱毒株中显著下调(P<0.05),同时sRNA64的转录水平与弱毒株感染时间呈负相关,推测sRNA64直接参与调控弱毒株发挥作用,在强毒株中可能会抑制或激活某个途径来影响其调控的能力。sRNA145虽然在强毒株中差异表达,但是在各时间点不同毒力中转录趋势差异不大(P>0.05),推测sRNA145与毒力不相关,可能受其他因素的调控导致sRNA145在HPS强毒株感染时期发挥作用。
细菌侵入宿主体内后,在体内生长发育繁殖受多种因素的调控,而sRNA可以调控细菌对细胞的侵袭以及在胞内生存繁殖能力[23,24]。比如sRNA-EsR240可通过调控靶基因影响爱德华菌胞内生存[25],sRNA InvS与沙门氏菌对上皮细胞的侵袭有关,并受蛋白PrgH的影响[26],sRNA IhtA在衣原体感染细胞时期调控细菌的生长和繁殖[27]。本研究中YK1603菌株在不同的感染时间sRNA64的转录水平存在差异性,而CY1201菌株在不同的感染时间sRNA64和sRNA145的转录水平均存在差异性,这可能与sRNA调控HPS对细胞的侵袭以及胞内生长繁殖的作用有关。
本研究通过对2株副猪嗜血杆菌辽宁分离株体外不同生长期与感染细胞后sRNA64和sRNA145的转录情况进行分析,确定sRNA64和sRNA145是差异表达基因且对调控HPS具有重要意义,但是其具体功能仍需进一步研究。
