人胃癌细胞系AGS外泌体miR-106a对腹膜间皮细胞系HMrSV5表型的影响
2021-11-12朱萌,张宁,陶伟
朱 萌,张 宁,陶 伟
(1.宁夏医科大学 基础医学院,宁夏 银川 750004; 宁夏医科大学总医院 2.病理科; 3.消化内科,宁夏 银川 750004)
胃癌(gastric cancer)腹膜转移发生机制不明,治疗手段欠缺、预后差、病死率高。当前针对腹膜转移的研究,多集中在癌细胞的侵袭转移能力和转移的分子调控上,对于转移的受体,腹膜细胞成分的变化却较少深入阐明,而腹膜间皮细胞的损伤或暴露引起的表型变化却是癌细胞能否种植于腹膜上的必要环节[1]。本研究前期工作表明胃癌细胞系AGS富集外泌体,且miRNA-106a(miR-106a)在胃癌中特异性表达,并鉴定直接靶点Smad7和TIMP2[2-3]。但是关于外泌体miR-106a靶向Smad7/TIMP2对腹膜间皮表型的影响并不清楚。本研究在此基础上,从转移的受体腹膜间皮细胞入手,考察AGS细胞外泌体源miR-106a对腹膜间皮细胞系HMrSV5增殖、凋亡、迁移等表型以及靶基因Smad7、TIMP2和下游效应分子MMP2、MMP9、α-SMA表达的影响,探索外泌体miR-106a在胃癌腹膜转移中的作用。
1 材料与方法
1.1 试剂及细胞
主要试剂:胎牛血清(Gibco公司);RPMI-1640培养基(Hyclone公司);胰蛋白酶(Genview公司);LipofectamineTM2000和外泌体提取试剂盒(Invitrogen公司);EdU检测试剂盒(Ribobio公司);Transwell小室(Costor公司);Matrigel基底膜基质(Corning公司);GW4869≥90%纯度、重组人TGF-beta 1蛋白(Aldrich-Sigma公司);hsa-miR-106a mimic/inhibitor (Genepharma公司);TRIzol(TaKaRa公司);qPCR检测试剂盒(DBI公司);Smad7兔多克隆抗体(Proteinteck公司);Smad2/3兔多克隆抗体(CST公司);p-Smad2/3兔单克隆抗体(R&D公司);TIMP2、MMP9兔多克隆抗体(Immunoway公司);MMP2、α-SMA兔多克隆抗体(SAB公司)。人源胃癌细胞系AGS和腹膜间皮细胞系HMrSV5购自中国科学院典型培养物保藏委员会细胞库。
1.2 方法
1.2.1 外泌体的提取:饥饿培养AGS细胞2 d后,吸弃上清液,2 000 r/min离心20 min,用微孔滤膜过滤,去除细胞和其他亚细胞结构物质;加入外泌体提取试剂(1∶2),颠倒混匀;4 ℃孵育过夜;次日4 ℃ 10 000×g离心1 h;弃上清,PBS重悬,获得外泌体于-80 ℃冰箱保存1周备用。PBS重悬外泌体,得到PBS-Exo,工作剂量8 μg。
1.2.2 细胞的分组及处理:本研究分3个部分:1)AGS细胞来源外泌体与HMrSV5细胞共培养。分组:Exo-control和Exo-GW4869。GW4869药物浓度为10 μmol/L,作用时间24 h。2)AGS细胞转染miR-106a mimic或inhibitor后与HMrSV5细胞共培养。分组:Exo-control、Exo-mimic、Exo-inhibitor。miRNA mimic/inhibitor采用LipofectamineTM2000转染,浓度50 nmol/L。3)AGS细胞来源外泌体与TGF-β处理后HMrSV5细胞共培养。分组:TGF-β、TGF-β-Exo。TGF-β重组蛋白浓度10 ng/mL,作用时间48 h。
1.2.3 qPCR检测细胞miR-106a表达:TRIzol法提取RNA。总RNA模板量1 μg,加入RNase-free H2O,总体系10 μL。取7.0 μL,加入5×反转录缓冲液 2.0 μL,miRNA RT 0.25 μL,U6 R 0.25 μL,RT反转录酶0.5 μL,总体系10 μL。37 ℃ 15 min,98 ℃ 5 min,合成cDNA第一链。取cDNA 1 μL,加入Bestar® SybrGreen qPCR Master Mix 10 μL,miRNA F(10 μmol/L)0.5 μL,ALL R(10 μmol/L)0.5 μL,ddH2O 8 μL,总体系20 μL。反应条件:95 ℃ 2 min;94 ℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,40个循环。融解曲线分析:94 ℃ 30 s,65 ℃ 30 s,94 ℃ 30 s。PCR使用Agilent Stratagene荧光定量PCR仪Mx3000P进行。miR-106a 反转录引物:5′-CTCAA CTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTACCTG C-3′;miR-106a 正向引物:5′-ACACTCCAGCTGGG AAAAGTGCTTACAGTGCA,反向引物:5′-CTCAACT GGTGTCGTGGA-3′。按照2-△△Ct方法处理数据。
1.2.4 EdU检测细胞增殖:将HMrSV5细胞置于96孔板,每孔加入100 μL 浓度为50 μmol/L EdU培养基孵育2 h;弃培养基,PBS清洗,4%多聚甲醛固定30 min,50 μL甘氨酸2 mg/mL孵育5 min,100 μL渗透剂(0.5% TritonX-100的PBS)孵育10 min;PBS清洗后加入100 μL 1×Apollo染色液,避光孵育30 min,弃染色反应液;加入100 μL渗透剂(0.5% TritonX-100的PBS)脱色摇床清洗2~3次,每次10 min,弃渗透剂;加入100 μL 1× Hoechst 33342反应液,避光孵育30 min,弃染色反应液;PBS清洗,倒置荧光显微镜(Leica DMI6000B)观察拍照。每组设3个复孔。
1.2.5 流式细胞测量术检测细胞凋亡:将HMrSV5细胞置于6孔板,胰蛋白酶消化制成单细胞悬液;将单细胞悬液移至流式管,PBS洗涤2次,1 000 r/min离心5 min,弃上清,用500 μL 1×缓冲液重悬细胞,然后取两管样本分别加入5 μL annexin V-FITC 和 10 μL PI,避光孵育15 min,上机检测。
1.2.6 Transwell小室法检测细胞迁移:无血清培养基培养HMrSV5细胞12 h,胰蛋白酶消化,用含0.2% BSA的无血清培养基重悬细胞,调整细胞浓度为2×105个/mL,取100 μL加入Transwell上室,下室加入700 μL 10% FBS完全培养基;5% CO2、37 ℃常规培养48 h;PBS洗涤,4%多聚甲醛固定20 min,结晶紫染色5~10 min,封片镜检。
1.2.7 Western blot检测Smad7、TIMP2、MMP2、MMP9、α-SMA、Smad2/3、p-Smad2/3蛋白表达:将HMrSV5细胞按5×105个/mL接种于6孔培养板,培养48 h后提取总蛋白,绘制标准曲线,进行BCA蛋白定量。经SDS-PAGE进行分离,上样量20 μg,100 V恒压电泳,待样品进入分离胶后,升压至120 V,总时长1.5 h。300 mA恒流转膜。5%脱脂奶粉-TBS封闭。孵育一抗(Smad7 1︰1 000,TIMP-2 1︰2 000,MMP2 1︰2 000,MMP9 1︰2 000,α-SMA 1︰2 000,Smad2/3 1︰1 000,p-Smad2/3 1︰500,GAPDH 1︰10 000),孵育二抗(HRP山羊抗兔IgG 1︰20 000),TBST洗涤。化学发光、显影、定影。凝胶图像分析。
1.3 统计学分析

2 结果
2.1 AGS细胞源外泌体miR-106a表达及对HMrSV5细胞增殖和凋亡的影响
AGS细胞内和外泌体内miR-106a的差异表达,与AGS-control组相比,AGS-Exo组miR-106a表达量增高(P<0.01)。细胞增殖实验,与Exo-control组相比,Exo-GW4869处理后,HMrSV5细胞EdU标记阳性细胞数增加,细胞增殖能力增强(图1)。早期凋亡率两组相比,Exo-GW4869组明显降低(P<0.05)(图2)。
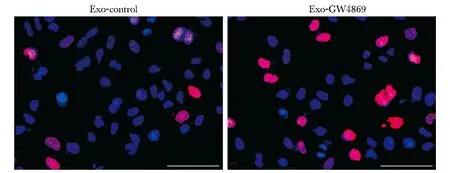
图1 EdU法检测HMrSV5细胞增殖能力Fig 1 Proliferation ability of HMrSV5 cells was detected by EdU assay (scale bar=50 μm)
2.2 AGS细胞源外泌体miR-106a对HMrSV5细胞迁移的影响
细胞迁移实验,与Exo-control组相比,Exo-mimic组HMrSV5细胞迁移率明显增强(P<0.001),Exo-inhibitor组明显下降(P<0.001)(图3)。
2.3 AGS细胞源外泌体miR-106a对HMrSV5细胞Smad7及相关蛋白表达的影响
与Exo-control相比,Exo-mimic组HMrSV5细胞Smad7、TIMP2蛋白表达显著降低(P<0.001),MMP2、MMP9、α-SMA蛋白表达显著升高(P<0.001);Exo-inhibitor组Smad7表达升高(P<0.01),MMP2、MMP9、α-SMA表达明显降低(P<0.001)(图4)。
2.4 TGF-β处理后外泌体对Smad7及相关蛋白表达的影响
与TGF-β处理组相比,TGF-β-Exo组HMrSV5细胞Smad7蛋白表达降低(P<0.001),而Smad2/3及磷酸化p-Smad2/3蛋白表达升高(P<0.001)(图5)。

*P<0.05 compared with Exo-control group图2 流式细胞测量术检测HMrSV5细胞凋亡率Fig 2 Apoptosis rate of HMrSV5 cells was detected by flow cytometry n=3)

*P<0.001 compared with Exo-control group图3 Transwell小室法检测HMrSV5细胞迁移能力Fig 3 Migration ability of HMrSV5 cells was detected by Transwell assay(scale bar=100 μm) n=3)
3 讨论
外泌体是一种细胞外物质,在其生物发生过程中会包裹起源细胞重要信息分子如蛋白质、核酸、脂类及其他代谢物等,可能参与了肿瘤转移过程中的细胞间通讯[4-5]。其中, 核酸类分子中的miRNA就是外泌体的重要包裹物。关于外泌体miRNA在肿瘤转移中的研究显示miRNA经由外泌体的定向转运参与调控恶性肿瘤的器官特异性转移,但具体的作用机制仍有待于深入探索。胃癌腹膜转移是一种器官特异性的转移方式,是由癌细胞出发,到腹膜移植瘤形成的过程。本研究以外泌体为介质,检测外泌体内miR-106a的表达,发现差异表达的miR-106a分子尤其富集于AGS细胞源外泌体中,提示miR-106a可能参与了外泌体所介导的细胞间通讯,进而可能在胃癌的腹膜转移中发挥作用。

*P<0.001, #P<0.01 compared with Exo-control group图4 蛋白质印迹法检测HMrSV5细胞Smad7及相关蛋白表达

*P<0.001 compared with TGF-β group图5 蛋白质印迹法检测HMrSV5细胞TGF-β干预后Smad7、Smad2/3、p-Smad2/3蛋白表达
腹膜细胞构成中最表层的是间皮细胞,间皮细胞的完整性和表型的维持是阻止胃癌等恶性肿瘤发生癌性腹膜播散的屏障[6]。腹膜完整性的保存是间皮细胞增殖和凋亡平衡的结果。本研究显示AGS细胞外泌体抑制HMrSV5细胞增殖,促进细胞凋亡,可能是破坏间皮完整性的一种介质。关于间皮细胞迁移率的实验表明AGS细胞miR-106a表达调控功能增强或减弱的同时,其来源外泌体也能够增强或减弱HMrSV5细胞的迁移能力。间皮细胞增殖、凋亡、迁移等表型可能至少在胃癌AGS细胞外泌体源miR-106a的作用下发生改变,这将是腹膜完整性损伤的一种促进因素。为进一步考察发生此类表型转化的原因,本研究检测miR-106a双靶点Smad7和TIMP2及相关效应分子。Smad7是属于SMAD家族的一种结合E3泛素连接酶的核蛋白,能够与TGF-β相互作用导致TGF-β降解[7-8],据报道TGF-β在Smad依赖的情况下介导细胞发生EMT、MMT转化[9-10]。MMP与相应的TIMP表达之间具有负相关性,MMPs/TIMPs平衡主要参与对肿瘤侵袭性的抑制作用。MMP2/TIMP2有利于维持ECM的平衡和降解[11]。本研究发现Smad7、TIMP2随miR-106a表达的干预而增强或减弱的同时间质标志物α-SMA,及MMP2/9发生相反变化,而TGF-β重组蛋白的逆向观察发现Smad7表达减低的同时Smad2/3及p-Smad2/3表达升高。这些结果一方面表明AGS细胞外泌体具有促使腹膜间皮细胞获得间质样表型的作用[12],另一方面也表明外泌体对间皮细胞的作用在于其转运的miR-106a对靶基因及相关效应通路的影响。
