钙调素结合位点调控环核苷酸门控离子通道研究进展
2021-11-12余冰清严汉池
余冰清,严汉池
(天津大学生命科学学院,天津 300072)
1 CNGC 的发现及其结构研究
细胞信号传导是一种可以响应并适应各种内部及外部因素的进化上的保守机制。环核苷酸门控离子通道(Cyclic nucleotide-gated ion channels,CNGC)是一类阳离子通道,它可以非选择性地直接被环核苷酸(cAMP 和cGMP)这类细胞内信使小分子活化[1]。
对于CNGC 通道的研究最早在动物中进行。但是,与哺乳动物宿主中环状核苷酸信号传导的研究进展相反,这一主题在植物中的研究还较少。植物中的CNGC 不仅能够调节花粉的正常发育并且能维持体内离子的稳态,另外,在植物对生物和非生物胁迫的应答反应中也起重要作用[2]。在植物中,1998年在大麦(Hordeum vulgare)中筛选钙调素(Calmod⁃ulin,CaM)结合伴侣时偶然发现了第一个CNGC 基因。随后,在其他植物中也鉴定出CNGC,例如拟南芥(Arabidopsis thaliana)、大 麦、水 稻[3](Oryza sati⁃va)、玉米(Zea mays)等。对CNGC 家族的研究表明,植物CNGC 基因可能在功能上以群依赖的方式区分。例如,可以依据系统进化关系将拟南芥CNGC家族分成5 个亚家族组(I、II、III、IVa 和IVb)。拟南芥CNGC 家族中包括20 个成员[4],目前对于植物环核苷酸门控离子通道的研究已经较为清晰地阐明其分子结构,并且发现它与Shaker 型钾离子电压门控离子通道的结构相似[5],其核心结构包括6 个跨膜α 螺旋(S1-S6),并且在S5 和S6 的中间有孔状结构,即P loop,该区域是植物CNGC 区别于其他离子通道蛋白的重要标志,因为其影响离子的选择性[6]。C末端具有环核苷酸结合区域(Cyclic Nucleotide mo⁃nophosphates Binding Domain,CNBD)和钙调素结合区域(Calmodulin Binding Domain,CaMBD),CNBD由3 个α 螺旋(αA、αB、αC)和2 个β 折叠(β1 和β2)构成,β1 和β2 构成的片层结构位于αA 和αB 中间,CaMBD结合Ca2+后可以反馈调节CNGC的通道活性,当Ca2+浓度高时,Ca2+与CaM结合,CNGC通道关闭。
尽管有关CNGC 的报道较多,但由于大多数研究都集中在CNGC 的基因组表征、系统发育比较和潜在作用上,因此对其激活和功能机制的了解较少。动物的环核苷酸结合域位于肽链的C 端,钙调蛋白结合域位于N 端;许多研究证明了植物的CaMBD 和CNBD 都位于C 末端[6](图1)。序列比较分析结果显示,植物的CaM 结合域和CNBD 结合域有部分重叠。Arazi 等[7]利用生物化学手段研究了烟草(Nicotiana tabacum)的CNGC 与模式植物拟南芥的CNGC,比较准确地诠释了环核苷酸结合域(CNBD)与钙调蛋白结合域(CaMBD)相重叠的论断。也就是说,植物CNGC 与动物之间的主要区别在于植物CNGC 中包含了重叠的钙调蛋白结合域(CaMBD)和环状核苷酸结合域(CNBD),该结构上的区别表明,动植物的CNGC 之间调节蛋白质活性的机制和功能有所不同。然而近期有关多个钙调蛋白结合位点正向和负向调节拟南芥CNGC12 的研究对于植物CNGC 调控模式产生了新的见解[8],为CNGC 调控新模型的建立提供了新的可能性。

图1 动植物环核苷酸门控离子通道(CNGC)的拓扑结构
2 CNGC 的调控因子——cNMP、Ca2+/CaM
CNGC 是一类阳离子通道,其特点在于具有不同程度的离子传导选择性,这些通道可以允许单价、二价阳离子的扩散,而CNGC 的活性受两个方面的调控,一方面受cGMP、cAMP 的调节,另一方面受CaM 与CNBD 的可逆结合调节,结合后蛋白的变构导致通道的开放和闭合。
2.1 cNMP
环状核苷酸(cNMP)是动植物体内非常重要的第二信使。cNMP 在调控离子动态变化中起重要作用,环核苷酸通过与环核苷酸结合结构域(CNBD)结合来调节其开放。现有的证据已经表明,环状核苷酸门控通道是植物细胞中主要的cNMP 效应子。这些通道是重要的细胞开关,可将细胞内环状核苷酸浓度的变化转化为膜电位和离子浓度的变化。环状核苷酸(cNMP),如3',5'-环腺苷酸(cAMP)和3',5'-环鸟苷酸(cGMP)与所有活生物体中的信号转导相关[9]。
2.2 Ca2+/CaM
钙调素(CaM)是细胞内Ca2+信号传导途径中的主要信号转导分子,它作为一种重要的钙受体蛋白,可以通过与Ca2+结合进而调节细胞内一些钙调结合蛋白(CaMBPs)的活性,介导调节通过Ca2+浓度变化引发的各种生理生化反应。
在 调 控 方 面,Ca2+/CaM 结 合CNGCs 是CNGC 家族首次被鉴定出来的生物化学功能。目前的研究显示,Ca2+/CaM 病原菌入侵细胞后会引起胞质内Ca2+含量增多,一方面激活下游Ca2+依赖型的生理生化反应,进而调控细胞一系列的相关生理过程;另一方面,被激活的CaM 能够反馈抑制钙信号。CNGC 之所以能够被胞质内增多的Ca2+/CaM 抑制,可能是由于Ca2+/CaM 阻碍了环核苷酸激活CNGC,因为该信号级联通过病原菌响应。电生理学试验显示,在施加CaM 拮抗剂后,持续的胞外刺激会导致Ca2+不断内流[10]。用CaM 拮抗剂处理植物细胞,在病原菌刺激下Ca2+含量依然会升高,也就是说Ca2+/CaM 对于CNGC 的反馈抑制可能阻碍了Ca2+的持续内流,因此,其对于维持胞内Ca2+含量稳定具有重要作用[11]。
虽然,研究者已经了解到CaM/Ca2+可以调控其活性,但是,与动物相比,对其活性调控的具体机制还不了解。已有的钙调蛋白与拟南芥环核苷酸门控离子通道的结合的研究显示,CaM 与其动物中的对应部分相似,对植物的CNGC 具有负调控作用。另一方面,CaM 结合亲和力的改变会导致CNGC 调控情况的复杂变化。
2.3 动植物CNGC 活性受cNMP 和CaM 调控
动物CNGC 主要分布于化学感受器和光感受器中,在转换膜外信号中起作用。在嗅觉和视觉信号转导过程中,CNGC 通道通过cAMP 或cGMP 调节通道活性,引起Na+流入,从而介导嗅觉神经元的嗅觉转换以及杆状细胞中光感受器的光转换[12]。而植物CNGC 被激活的方式有2 种,除了被直接激活外,也可以通过与环核苷酸(cAMP/cGMP)可逆性结合的方式被激活,但其门控作用主要依赖于cAMP 和cGMP 的存在[13],同时受Ca2+调控。环核苷酸信号的产生和消退取决于腺嘌呤环化酶和鸟嘌呤环化酶,以及可以将环状核苷酸水解成ATP 和GTP 的磷酸二酯酶[14]。当环状核苷酸与通道蛋白结合时,它会诱导蛋白构象的变化,导致P 区域的旋转,然后通道大门打开,从而促使阳离子跨膜移动[15]。
如上所述,CaMBD 位于与CNBD 的C 末端α-螺旋重叠的部位。CaMBD 具有4 个氨基酸残基,为Trp-Arg-Thr-Trp(WRTW),是CaM 结合所必需的。CaMBD 在CNBD 内的位置允许CaM 与cNMP 作为通道电导的变构门控中的配体竞争。最近,在模式植物AtCNGC20 中发现通过独特的异亮氨酸-谷氨酰胺(IQ)CaM 结合基序与CaM 结合,该基序与CNBD中的α-螺旋相邻但不重叠[8]。一些番茄和拟南芥CNGC 家族的域组织分析试验也证明了一些成员是含有IQ CaM 结合基序的,该结果首次让人们意识到植物CNGC 可能含有2 个替代的CaM 结合基序(CaMBD 和IQ CaM 结合基序)。除此之外,分析结果还显示,它类似于动植物中的电压依赖性Ca2+通道,表明通过CaM 对植物CNGC 的配体调控可能比以往预期的更加复杂,因为上述2 个结构域(CaMBD和IQ)具有不同的功能,具体调控模式还需进一步研究分析。
3 CaM 对CNGC 调节的复杂模式
迄今为止研究的所有植物和动物CNGC 具有至少1 个钙调蛋白(CaM)结合结构域。研究表明,动植物CNGC 的N 端和C 端都延伸至细胞质中,除了CaMBD 的位置不同外,其他基本相同,其中CNBD在多肽的C 末端,由3 个α 螺旋(αA、αB、αC)和2 个β 折叠(β1 和β2)构成,由β1 和β2 组成的片层结构位于αA 和αB 之间。动物CNGC 的CaMBD 位于肽链的N 末端的上游,但植物中CaMBD 位置与动物不同,它位于多肽的C 末端,即CNBD 截短的αC 螺旋的起点处。因此,由于植物CNBD 是重叠的结合域,它既参与钙调蛋白的结合,又参与环核苷酸的结合。
3.1 动物CNGC 的变构调节模式
首先,对于动物中cNMP 对CNGC 的调节,响应激活胞内嘌呤核苷酸环化酶(NCs)的细胞外信号合成cNMP,它们分别由腺苷三磷酸腺苷(ATP)和鸟苷三磷酸鸟苷(GTP)催化cAMP 和cGMP 合成。细胞内cNMP 的浓度受磷酸二酯酶(PDEs)调节,磷酸二酯酶进而将cAMP 和cGMP 代谢为无活性的核苷酸单磷酸[16]。cNMP 结合并激活环状核苷酸结合蛋白(CNBP),包括依赖于cAMP 和cGMP 的蛋白激酶(PKA 和PKG),这被认为是动物中环状核苷酸信号传导的主要作用因子。通过环状核苷酸来激活在动物各种生理过程中起基本作用的通道,其中包括环状核苷酸门控通道(CNGC)[17]。具体调控过程如下:气味分子与化学感受器中的G 蛋白耦联型受体可以通过结合进而激活腺苷酸环化酶,产生cAMP,打开cAMP 门控阳离子通道(cAMP-gated cation channel),并引起Na+内流,膜去极化,从而产生神经冲动,最终形成嗅觉或味觉。
哺乳动物CNGC 变构调节的机制被充分表征,其中环核苷酸单磷酸酯cAMP 和cGMP 与C 端CNBD的结合提供了通道传导的门控机制[18],而哺乳动物CNGC 功能的变构抑制又由CaM 结合调节,这降低了通道对cAMP/cGMP 的亲和力[19]。哺乳动物CNGC具有多种CaM 结合位点,目前在6 种不同CNGC 同种型的N 末端及C 末端均已发现至少9 种CaMBD,然而,到目前为止,试验只提供了N 端CaMBD 的功能作用的证据。通常,CaM 是在升高的细胞内Ca2+水平下,在CNGCs 的反馈调节中通过结合到1 个或多个CaMBD,从而变构性抑制CNGC 电导[20]。
3.2 钙调蛋白结合位点调控植物CNGC 的复杂模式
植物中的CNGC 是信号转导级联反应(Signal transduction cascades)的组成部分。通过这种级联反应,它们将细胞外部信号转换成可以穿过细胞膜并作用于细胞的阳离子流[12]。如前文所述,植物CNGC 能够直接被激活,还受cAMP/cGMP 以及Ca2+调控。
cAMP/cGMP 分别通过跨膜(tmAC)或可溶性(sAC)腺苷酸环化酶/跨膜(tmGC)或可溶性(sGC)胍基环化酶合成。它们都被磷酸二酯酶(PDE)水解成无活性的AMP 和GMP。根据现有技术的实际研究发现,CNGC 是植物细胞中cNMP 的主要靶标。环状核苷酸可以直接与环状核苷酸结合域(CNBD)结合,以诱导蛋白的构像变化,调节CNGC 孔的打开或关闭,并促进阳离子跨膜移动。
先前的研究假设CaMBD 允许CaM 作为配体与环状核苷酸单磷酸在通道电导的变构门控中竞争结合CNBD[21]。首次提出该区域时,它被视为植物CNGC 的惟一CaMBD,就是说,由于植物CNBD 是1个重叠的结合域,CaM 与植物CNGC 的结合会干扰CNGC 与环状核苷酸的结合,竞争性的结合进而影响通道的激活[7],表明由CaM 调节的动植物CNGC之间具有不同的调节机制。CaM、环核苷酸和Ca2+不仅各自都能与CNGC 相互作用,而且可以通过整合的方式控制离子通过植物离子通道。当环核苷酸与CNGC 结合而被激活时,通道打开导致胞外Ca2+内流。一方面,胞内Ca2+的增加将导致Ca2+依赖蛋白激酶(CDPKs)的激活,进而导致下游靶蛋白的磷酸化;另一方面,由Ca2+激活的钙调蛋白将会与环核苷酸竞争性地结合CNGC,这就一定程度上阻止了环核苷酸与CNGC 结合,通道活性受到抑制,从而限制了Ca2+的进一步内流。
此前的研究均假设植物的CNGC 受Ca2+传感器钙调蛋白(CaM)负调控,并且先前的工作也都只集中在与植物CNGC 的CNBD 重叠的C 末端的CaMBD上。而近几年研究发现,模式植物AtCNGC20 通过与αC-螺旋相邻却并不重叠的独特异亮氨酸-谷氨酰胺(IQ)基序与CaM 结合[22],表明植物CNGC,如哺乳动物CNGC,可具有多种CaMBD。
3.3 动植物CNGC 在钙离子变构调节上的异同
为了进一步了解CNGCs 的调节和生理作用,DeFalco 等[8]对模式植物拟南芥CNGC12 的CaM 结合特性和功能进行了全面的表征。拟南芥CNGC12的αC-螺旋区域具有低保守性,因此研究者认为其无法结合CaM,然而,该研究证明这种同种型在其胞质N 和C 末端都具有新的CaMBD,提供了单个植物CNGC 同种型具有多个CaMBD 的证据。表明拟南芥CNGC12 在其胞质N 和C 末端含有多个CaMBD,包括NT、CT 和IQ(图2)。在CNBD 之外的CNGC12的C 末端存在新的CaMBD(CT),该区域以前并未在任何植物CNGC 中表征过。先前已报道植物CNGC同种型中没有N 末端CaMBD,然而在N 末端区域的覆盖测定中也观察到明显的CaM 结合(NT)。由于其试验确定了CaM 与IQ 基序的结合是通道功能所必需的,不仅表明了CaM 可以正向和负向调节CNGC12,同时说明了CaM 对植物CNGC 调节模式较为复杂,它与先前提出的竞争性配体模型相反,这表明有可能植物和动物CNGC 之间存在相似性。
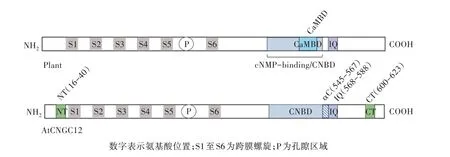
图2 模式植物拟南芥CNGC12 的CaMBD 位置(包括NT 和CT 位点的描述)
鉴于对其CaMBD 的生化和生理解剖,DeFalco等[8]提出了CaM 调节CNGC12 的模型。该模型假定CNGC12 通过IQ 基序以Ca2+独立的方式进行组成性调节,而Ca2+/CaM 可以顺序结合多个CaMBD。该模型显示CNGC12 直接介导Ca2+的内流,但是不能排除CNGC12 信号触发其他通道介导的Ca2+电流的可能性。该模型包含了一些推测性的特征,这些特征与目前的研究结果一致,但仍需要进一步研究验证,其中一些特征与各种动物通道有明显的相似性,例如CaM 介导的亚基间和亚基间相互作用的桥接以及CaM 在多个CaMBD 之间的动态运动[23],类似的CaM 调节特征广泛分布在各种动物电压或Ca2+门控的阳离子通道中,例如很多脊椎动物的阳离子通道中就存在类似机制[24]。
结构性、功能性、生理和电生理学研究的结合将有助于阐明Ca2+对CaM 介导的CNGC 调控的复杂模式。考虑到CNGC 和CaM 在免疫中的重要作用[25],进一步表征CaM-CNGC 相互作用对于理解免疫应答过程中CNGC 介导的Ca2+信号传导至关重要。
4 展望
环核苷酸门控通道作为植物细胞中环核苷酸的靶点,越来越受到人们的关注。尤其是近年来细胞斑块钳位、植物基因组测序以及基因组学方法的进一步发展,促进了CNGC 编码基因的识别和调控等方面研究的进展,为研究人员阐明通道的结构与功能间的联系提供了有效方法和技术支撑。信号转导通路缺陷的突变体的存在,使人们对CNGC 生理功能的认识取得了迅速进展。
几乎所有的植物信号过程都有Ca2+的参与,然而至今为止,植物中只有为数不多的钙离子通道家族被发现。另外,植物中的CNGC、GLR 等钙通道最早是通过动物中的同源蛋白进行序列相似性比对而挖掘出来的。在对CNGC 进行研究时,如果能考虑动植物间的相似点和区别,将对阐明植物CNGCs 功能及其调控机理有很大的帮助。所以探究CNGCs相应的配体、门控分子和活性调节机制是今后研究的一个重要目标。
总而言之,要完全理解CNGC 的功能,还需要采取多种研究手段。结合更多的结构功能、生理和电生理研究将有助于阐明Ca2+/CaM 介导的CNGC 调控的复杂模式。将钙信号整合到植物中更大的信号网络中的研究应该得到更多的关注。
