长链非编码RNA Pvt 1致癌基因在胶质瘤细胞增殖和上皮-间充质转化过程中的作用研究△
2021-11-12杨安强杨晓滨李江涛吴和刚王晓军刘松范莉
杨安强,杨晓滨,李江涛,吴和刚,王晓军,刘松,范莉
宜宾市第一人民医院1神经外科,2中心实验室,3病理科,4麻醉科,四川 宜宾 644000
胶质瘤是中枢神经系统最常见的恶性肿瘤之一,占颅内肿瘤的20%~60%。世界卫生组织(WHO)依其恶性程度分为4级:Ⅰ~Ⅱ级为低级别胶质瘤,恶性程度较低;Ⅲ级为间变性胶质瘤;Ⅳ级为胶质母细胞瘤。Ⅲ~Ⅳ级胶质瘤均为高度恶性胶质瘤,发病率为(5~8)/100 000,在35~55岁肿瘤患者死亡原因中居第四位,在≤34岁肿瘤患者死亡原因中居第二位。据统计,胶质瘤患者5年生存率为20%~30%,而胶质母细胞瘤仅为1%。目前,外科手术、放疗和化疗仍是临床上治疗恶性胶质瘤的主要手段,但一般预后较差。因此,从分子水平上研究胶质瘤的发病机制,对于预防和治疗胶质瘤具有重要意义。长链非编码RNA(1ong noncoding RNA,lncRNA)是一类不能编码蛋白质的RNA,其转录副本超过200个核苷酸。长链非编码RNA的表达与神经发育、神经退行性和免疫性疾病、精神疾病、原发性脑肿瘤、神经肿瘤等存在密切的联系。Pvt1致癌基因(Pvt1 oncogene,PVT1)是由PVT1
基因编码的一个lncRNA,是一种转录激活子。研究发现,PVT1参与多种生理学和病理学过程,与肿瘤的发生和发展高度相关,在肝细胞肝癌、乳腺癌、结肠癌、胃癌、肾癌等多种肿瘤中高表达。此外,已经得到公认的是肿瘤细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT)是其获得侵袭和转移能力的关键环节。然而,PVT1与胶质瘤进展中EMT过程的关系尚未有相关研究。因此,本研究拟通过研究PVT1在胶质瘤细胞增殖和EMT过程中的作用,完善胶质瘤发生和发展的机制,为胶质瘤的治疗奠定实验室基础,提供全新的治疗方向。1 资料与方法
1.1 一般资料
收集2018年1月至2020年1月宜宾市第一人民医院神经外科收治的40例胶质瘤患者。纳入标准:术中病理学检查证实为原发性胶质瘤;术前未接受过任何放化疗及免疫治疗;病历资料完整;自愿签订知情同意书。排除标准:合并内分泌系统疾病;伴有血液系统肿瘤;其他系统肿瘤伴脑转移。取40例胶质瘤患者的胶质瘤组织。肿瘤分级:Ⅰ级5例,Ⅱ级5例,Ⅲ级15例,Ⅳ级15例。另选取5例颅脑外伤后脑肿胀致脑疝形成后进行颅内减压手术患者的正常脑组织标本作为对照。所有标本采集后,迅速置于液氮中速冻,随即转移至-80℃贮存。
1.2 主要材料
胎牛血清和DMEM培养基均购自美国GIBCO公司;Lipofectamine 2000和Trizol均购自美国Invitrogen公司;抗 E-cadherin(ab1416)、抗 N-cadherin(ab76011)和抗Vimentin抗体(ab92547)均购自美国Abcam公司;总蛋白提取试剂盒和CCK-8试剂盒均购自上海碧云天公司。siRNA-PVT1
(正义链5'-UUAGUAUCCUGAAAUGUGC-3',反义链 5'-GCACAUUUCAGGAUACUAA-3')及其阴性对照siNC
(正义链5'-UUCUCCGAACGUGUCACGUTT-3',反义链 5'-ACGUGACACGUUCGGAGAATT-3')均由上海吉玛基因公司合成。正常脑组织细胞HEB,胶质母细胞系U87MG、U251均购自上海细胞库,培养于10%胎牛血清的DMEM高糖培养基中,37℃5%CO培养箱中。1.3 实验方法
1.3.1 定量逆转录聚合酶链反应(quantitative reverse transcription-polymerase chain reaction ,qRT-PCR)检测 正常脑组织样本和临床胶质瘤组织样本经液氮研磨后,加入Trizol提取组织样本总RNA(细胞样本直接加入Trizol,无需液氮研磨)。以提取的总RNA为模板,逆转cDNA。采用qRT-PCR试剂盒SYBR Green法步骤进行扩增,共扩增35个循环周期。每个样本重复3次,以β-actin
基因作为内参。3次独立实验获得的数据运用相对表达量2的方法进行分析。PVT1
引物序列为:5'-GGCCAGCCTTTAGAGAGGTC-3'和 5'-TCGGAAGGGCACACATTCAG-3'。1.3.2 细胞转染 将U87MG和U251细胞按照2×10/孔接种于6孔培养板,各分为两组,分别转染siNC和siRNA-PVT1
。转染48 h或72 h后,qRTPCR检测转染效果,进行后续研究。1.3.3 CCK- 8法检测细胞增殖活性U87MG和U251细胞经转染后,分为siNC组和siRNA-PVT1
组,将其分别接种于96孔板内,5×10/孔,5%CO37 ℃培养 0、1、2、3天,每个时间点5个复孔。培养结束时,加入10 μl CCK-8试剂,置于培养箱继续孵育2 h,然后在酶标仪450 nm处测量各孔的光密度(optical density,OD)值,绘制细胞增殖活性曲线。1.3.4 Transwell法检测细胞侵袭能力 取无血清培养基与BD基质胶按照3∶1的比例混匀,每孔40 μl加入到Transwell小室的上室中,37℃5%CO培养箱中凝固1 h。取转染的细胞(siNC组和siRNA-PVT1
组),无血清培养基重悬计数,10个细胞加入Transwell小室上室,600 μl完全培养基加入到下室中。在37℃5%CO孵育48 h或72 h后,取出小室,擦去上室的细胞后置于4%多聚甲醛中固定15 min,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤1次,结晶紫染色10 min,PBS洗涤1次,计数并拍照(10×10)穿过膜的细胞数量。1.3.5 蛋白质印迹(Western blot)法检测 收集转染后的细胞(siNC组和siRNA-PVT1
组),用蛋白裂解液提取细胞总蛋白并测定其浓度,取30 μg总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE),其参数为浓缩胶60 V电泳60 min,分离胶120 V电泳70 min;采用湿转法转膜,参数为100 V,60 min。然后,5%BSA溶液中封闭60 min,随后分别加入抗E-cadherin、抗N-cadherin、抗Vimentin抗体(1∶1000)和二抗[抗鼠或抗兔免疫球蛋白G(immunoglobulin G,IgG),1∶5000]。超敏电化学发光(electrochemiluminescence,ECL)试剂A液和B液按体积1∶1混匀,加至水平放置的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,移入暗室,取医用X线片覆盖,曝光1 min左右,依次进行显影、定影。以GAPDH作为内参蛋白,以目的蛋白与内参蛋白灰密度的比值作为蛋白的相对表达量。1.4 统计学分析
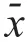
2 结果
2.1 PVT 1表达水平的比较
与正常脑组织相比,随着胶质瘤分级的增加,PVT1
表达水平逐渐升高(P
<0.05)(表1)。胶质母细胞系U251和U87MG(相当于WHOⅣ级)的PVT1
表达水平均明显高于正常HEB细胞系,差异均有统计学意义(P
<0.01)(表2)。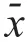
表1 正常脑组织及不同肿瘤分级的胶质瘤组织中PVT 1表达水平的比较(±s)
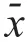
表2 HEB、 U87MG、 U251细胞系中PVT 1表达水平的比较(±s)
2.2 PVT 1对胶质母细胞增殖的影响
培养2、3天后,siRNA-PVT1
组U87MG和U251细胞OD值均低于siNC组,差异均有统计学意义(P
<0.05)。(表3)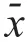
表3 siNC组和siRNA-PVT1组 U87MG和 U251细胞中OD值的比较(±s)
2.3 PVT 1对胶质母细胞侵袭的影响
与siNC组相比,siRNA-PVT1
组U87MG和U251细胞侵袭细胞数量均减少,差异均有统计学意义(P
<0.05)。(图1、表4)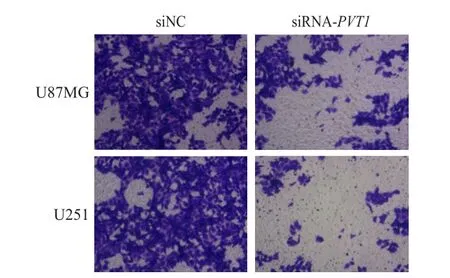
图1 Transwell检测siNC组和siRNA-PVT 1组 U87MG和U251细胞的侵袭情况(结晶紫染色,×100)

表4 siNC组和siRNA-PVT 1组 U87MG和 U251细胞系的细胞侵袭数目比较(x± s)
2.4 PVT 1对EMT相关蛋白表达的影响
siRNA-PVT1
组U87MG和U251细胞系中E-cadherin蛋白相对表达量均高于siNC组,N-cadherin和Vimentin蛋白相对表达量均低于siNC组,差异均有统计学意义(P
<0.05)。(图2、表5)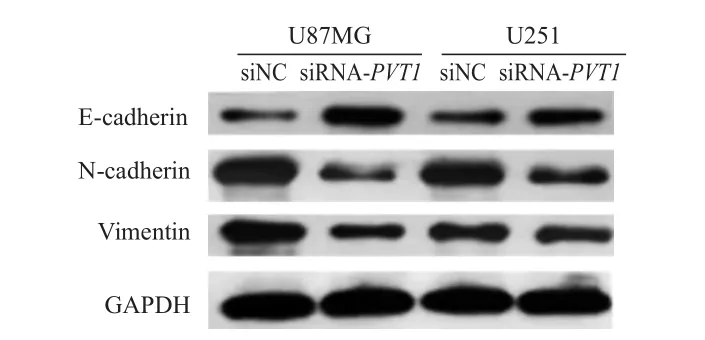
图2 Western blot检测siNC组和siRNA-PVT 1组 U87MG和U251细胞系中E-cadherin、N-cadherin和Vimentin蛋白表达情况
表5 siNC组和siRNA-PVT 1组 U87MG和 U251细胞系中E-cadherin、N-cadherin和Vimentin蛋白相对表达量的比较(±s)
3 讨论
在成年原发性脑肿瘤患者中,胶质瘤的恶性程度最高,预后最差,特别是Ⅲ~Ⅳ级胶质瘤。在胶质瘤的进展中,lncRNA扮演着重要的角色。lncRNA与胶质瘤发病机制、转移性、侵袭性及预后情况等均存在一定的关系,其相互关联性已成为近年来胶质瘤研究的热点和难点。比如,多个与免疫相关 的lncRNA (AC046143.1、AC021054.1、AC080112.1、MIR222HG和PRKCQ-AS1)与患者的生存能力密切相关,可以用作胶质母细胞瘤预后的潜在指标和潜在治疗方法。PVT1在胶质瘤中的作用本课题组早已关注。先前的研究发现,PVT1通过调控Zeste
基因增强子同源物2(enhancer of Zeste homolog 2,EZH2)表达水平来调节胶质母细胞瘤的增殖、迁移和侵袭能力,最终影响胶质瘤患者的预后。临床组织样本的研究发现,胶质瘤的恶性程度越高,PVT1的表达水平越高,高水平的PVT1可能促进胶质瘤进程。那么,PVT1是否参与胶质母细胞瘤的EMT过程呢?EMT可使上皮细胞失去极性,成为具有活动能力、能在细胞基质自由移动的间质细胞。EMT发生时,上皮细胞标志物E-cadherin、α-catenin、β-catenin、黏蛋白等表达下调,间质表型标志物N-cadherin、Vimentin、基质金属蛋白酶等表达上调。其中,E-cadherin
的缺失是EMT最重要的标志性变化,伴随着肿瘤细胞间的黏附减弱和肿瘤细胞运动能力增强。因此,EMT发生后肿瘤细胞的侵袭能力明显增强。胶质瘤作为神经上皮细胞来源的肿瘤,Ⅲ~Ⅳ级胶质瘤不仅具有较强的增殖潜能,极易形成大的肿块,而且具备超强的侵袭性生长的特点,能够持续侵犯正常脑组织。通过siRNAPVT1
细胞转染,沉默U87MG和U251细胞中PVT1
水平发现,细胞增殖活性和侵袭能力显著下降,而Western blot检测显示EMT上皮细胞标志物E-cadherin升高,间质表型标志物N-cadherin和Vimentin下调,EMT过程受到明显抑制。因此,本研究推测PVT1参与了胶质母细胞瘤的EMT过程,进而调控了胶质母细胞瘤的侵袭,但其调控机制尚不清楚。综上所述,lncRNA PVT1在胶质瘤中异常高表达,其表达水平与胶质瘤恶性程度有关;PVT1可能通过调节EMT过程进而影响胶质瘤细胞的侵袭能力;推测PVT1-EMT-侵袭调控过程可能为胶质瘤的基因疗法提供了一个新方向和思路。
