黄枝瑚菌多糖提取工艺优化及其体外抗氧化活性研究*
2021-11-10祝佳惠李玉芹唐裕芳陈禧瑶
周 蓉, 祝佳惠, 李玉芹, 唐裕芳, 陈禧瑶
(湘潭大学 化工学院 生物与食品工程系,湖南 湘潭 411105)
0 引言
枝瑚菌属珊瑚菌科,枝瑚菌属,子实体形秀色美、质地鲜甜脆爽,富含数种必需氨基酸、有益碳水化合物和微量元素,营养价值高[1].中医文献记载其可以和胃现气、祛风、破血缓中[2],近年来的报道表明部分枝瑚菌具有抗氧化、降血糖血脂、调节免疫等功能,对艾氏癌EC和小鼠肉瘤S-l80也有很强抑制作用[3-4].丰富的营养及药用价值使其成为我国野生食药用真菌资源中极其宝贵的组成部分.
多糖是食药用真菌发挥保健和医疗功能的重要成分,且对人体毒副作用较小,近年来成为功能性食品、天然药物和保健品领域的研究热点,目前更是已将源自香菇、银耳、灵芝、灰树花等的多糖应用于临床领域.对枝瑚菌属而言,现已有子实体多糖提取和活性相关的研究报道,如苏凤贤等[5]优化了密枝瑚菌(R.stricta)多糖的提取工艺;王丽娟等[6]发现红顶枝瑚菌(R.botrytoides)多糖具有羟基自由基(·OH)清除活性;董明明等[4]证实萎垂白枝瑚菌(R.flaccida)多糖具有良好的免疫增强功能.然而,黄枝瑚菌(R.flava)作为一类味道鲜美、效用良好的食材及传统中药材,在食品和中医药领域应用广泛,但其子实体多糖研究较少,提取工艺的研究不够深入.
本文以黄枝瑚菌为原料,通过响应面试验对其子实体多糖的热水浸提工艺进行优化,并考察了优化条件下多糖的抗氧化活性,为黄枝瑚菌的功效研究和其多糖产品的开发提供理论依据和技术参考.
1 材料与方法
1.1 材料与试剂
黄枝瑚菌子实体,河南省南阳市南召县明存山货店;DPPH、ABTS、还原型辅酶Ⅰ二钠盐(NADH)、吩嗪硫酸甲酯(PMS)、氮蓝四唑(NBT),上海麦克林生化科技有限公司;其余试剂均为国产分析纯.
1.2 仪器与设备
RE-2000A型旋转蒸发器;Agilent Cary 3500型紫外-可见分光光度计;Nicolet 380型傅里叶红外光谱仪;Netzsch TG209型同步热重分析仪.
1.3 方法
1.3.1 热水浸提黄枝瑚菌多糖黄枝瑚菌子实体烘干、粉碎过筛后,按照所需料液比、浸提温度和时间浸提两次;浸提液合并浓缩后加入4倍体积的无水乙醇,4 ℃静置过夜;离心(8 000 r/min,10 min)收集沉淀并用蒸馏水复溶,加入25% Sevage试剂(v(三氯甲烷)∶v(异丙醇)=4∶1),重复数次后合并收集上层溶液;于4 ℃透析(截留分子量3 500 Da)48 h后,冷冻干燥即得黄枝瑚菌多糖.
1.3.2 多糖含量测定将上述透析后的多糖样品定容后,采用蒽酮-硫酸法[7]测定溶液在620 nm波长下的吸光值,根据同法所得的葡萄糖标准曲线计算多糖得率,计算公式如下:
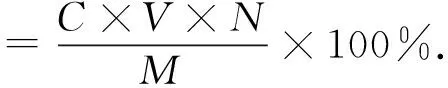
(1)
式中:C为样品中多糖浓度,g/mL;V为定容体积,mL;N为稀释倍数;M为子实体粉末干重,g.
1.3.3 提取工艺优化
(1) 单因素试验
选取料液比、浸提温度和时间3个因素,以多糖得率为考察指标按以下条件进行单因素试验:1) 固定浸提时间4 h,料液比1∶25,浸提温度分别为60、70、80、90、100 ℃;2) 固定浸提温度80 ℃,料液比1∶25,分别浸提1、2、3、4、5 h;3) 固定浸提温度80 ℃,浸提时间4 h,料液比分别为1∶15、1∶20、1∶25、1∶30、1∶35.
(2) 响应面试验
根据单因素试验的结果,利用Box-Behnken设计原理以浸提温度X1、浸提时间X2和料液比X3为自变量,多糖得率为响应值Y,设计3因素3水平响应面试验以优化多糖浸提工艺.设计因素及水平见表1.
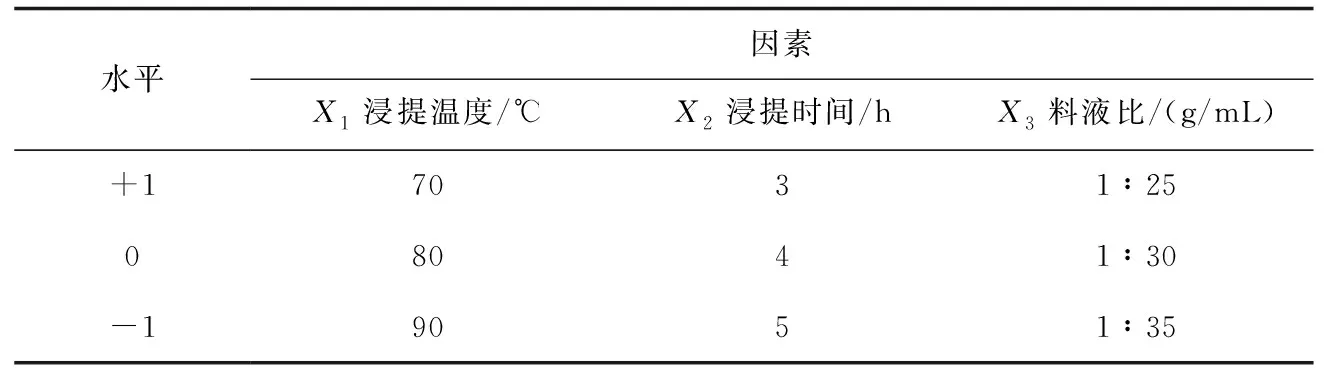
表1 响应面试验因素及水平
1.3.4 热重分析将多糖置于氧化铝坩埚中,在氮气保护下以10 ℃/min的升温速率利用同步热重分析仪评估多糖在30~800 ℃间的质量变化.
1.3.5 傅里叶红外光谱分析取2 mg多糖粉末与干燥KBr混合并压片,在4 000~500 cm-1范围内进行红外光谱扫描.
1.3.6 抗氧化活性测定
(1) DPPH·清除能力
将不同浓度的多糖溶液与DPPH-甲醇溶液等体积混合均匀,黑暗静置30 min后测定OD517值.以L-抗坏血酸(Vc)为阳性对照.
(2) ABTS+·清除能力
7.4 mmol/L的ABTS溶液与2.6 mmol/L的K2S2O8溶液等体积混合后黑暗静置12 h后制成ABTS+·工作液,将工作液与多糖溶液以体积比4∶1混合,避光静置5 min后测定其OD734值.以Vc为阳性对照.
(3) O2-·清除能力
(3)
向700 μL多糖溶液中依次加入78 μmol/L NADH溶液、50 μmol/L NBT溶液和10 μmol/L PMS溶液各100 μL,混匀后测定OD560值.以没食子酸为阳性对照.
多糖的自由基清除率根据式(2)计算.其中Ax为实验组吸光值,Ax0为阴性对照组吸光值(无自由基),A0为空白组吸光值(无样品).
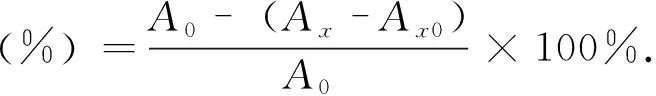
(2)
1.4 数据分析
所有试验重复3次,结果以(平均值±标准偏差)来表示,数据用SPSS 20.0进行统计分析和显著性评价,其中响应面试验利用Design Expert V 8.0.6软件进行设计与方差分析.
2 结果与分析
2.1 单因素试验结果
浸提时间对多糖得率影响的结果见图1(a):浸提时间从1 h逐渐增加到4 h,多糖得率显著升高,在4 h时达到最大值11.49 mg/g,提升了120.96%,主要是由于浸提时间增加促使多糖在浸提液中充分溶解;但继续增加浸提时间至5 h,多糖得率下降1.92 mg/g,其原因是浸提时间过长易引起多糖的降解,产生部分小分子糖类,不利于在醇沉过程中回收[8].因此适宜的浸提时间为4 h.
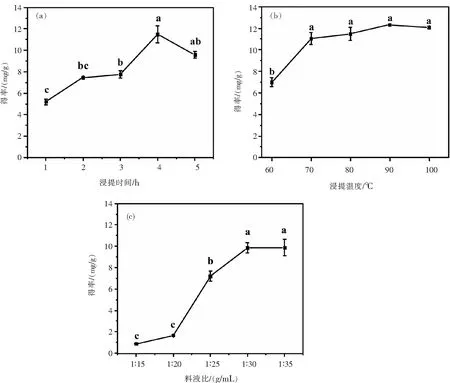
图1 浸提条件对黄枝瑚菌多糖得率的影响:(a) 浸提时间的影响;(b)浸提温度的影响;(c)料液比的影响Fig.1 Effects of extraction conditions on the yield of polysaccharides from R. flava:(a) Effect of extraction time; (b) effect of extraction temperature;(c) effeet of solid liquid ratio
由图1(b)可知,浸提温度由60 ℃升高到90 ℃,分子运动速度加快,利于多糖从细胞中溶出,得率逐渐升高,整体提升76.39%.继续升温至100 ℃,得率略有下降,其原因是随着温度的升高,多糖降解速率增加,最终表现为多糖的宏观溶出速率减少、得率降低[9].又因较高浸提温度会带来较大能耗,因此浸提温度的优化范围选择70~90 ℃.
多糖得率在料液比1∶15~1∶30(g/mL)范围内随溶剂比例的增加而升高,1∶30之后趋于平缓(图1(c)).当料液比低于1∶30时,溶剂比例增大使物料与提取液接触愈加充分,多糖溶解率逐渐增加,得率显著升高,最高为9.86 mg/g;但在多糖已充分溶出后继续增大料液比,浸提液中多糖不再继续增加,得率(9.87 mg/g,P>0.05)基本保持不变.而水量过多会增加浓缩成本,所以确定1∶30为适宜料液比水平.
2.2 响应面试验结果
2.2.1 响应面试验设计与结果在单因素试验的基础上,选取浸提温度(70~90 ℃)、浸提时间(3~5 h)、料液比(1∶25~1∶35)进行三因素三水平的响应面优化试验,具体试验设计及结果见表2,共17组试验,多糖得率为6.13~19.19 mg/g.
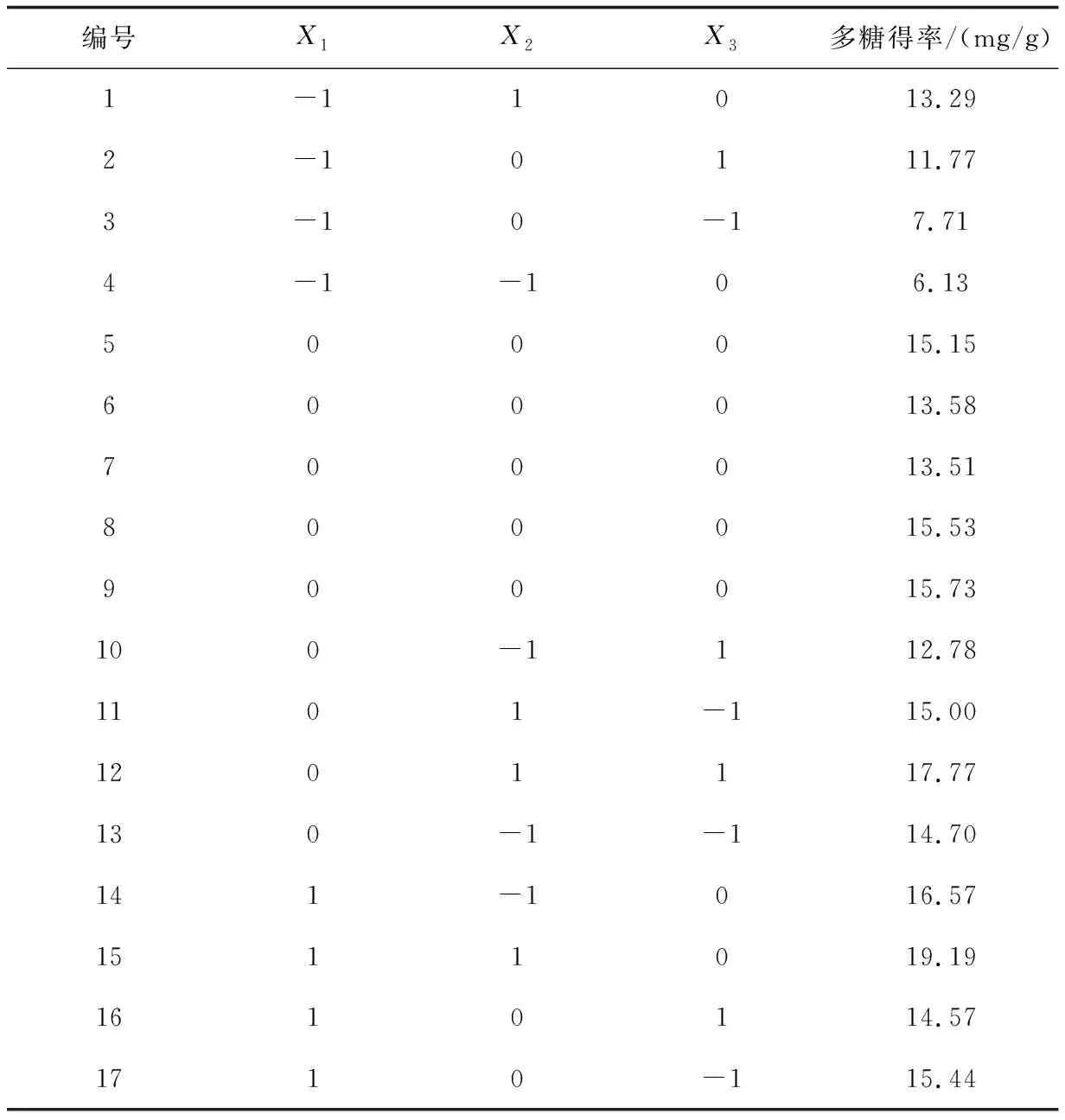
表2 响应面试验设计及结果
2.2.2 回归模型有效性及显著性分析对响应面试验结果进行回归拟合,可得如下多糖得率Y对浸提温度X1、浸提时间X2和料液比X3的多项回归方程:
Y=0.015+3.358×10-3X1+1.884×10-3X2+5.050×10-4X3-1.135×10-3X1X2
-1.230×10-3X1X3+1.172×10-3X2X3-1.798×10-3X12+8.954×10-4X22
-5.293×10-4X32.
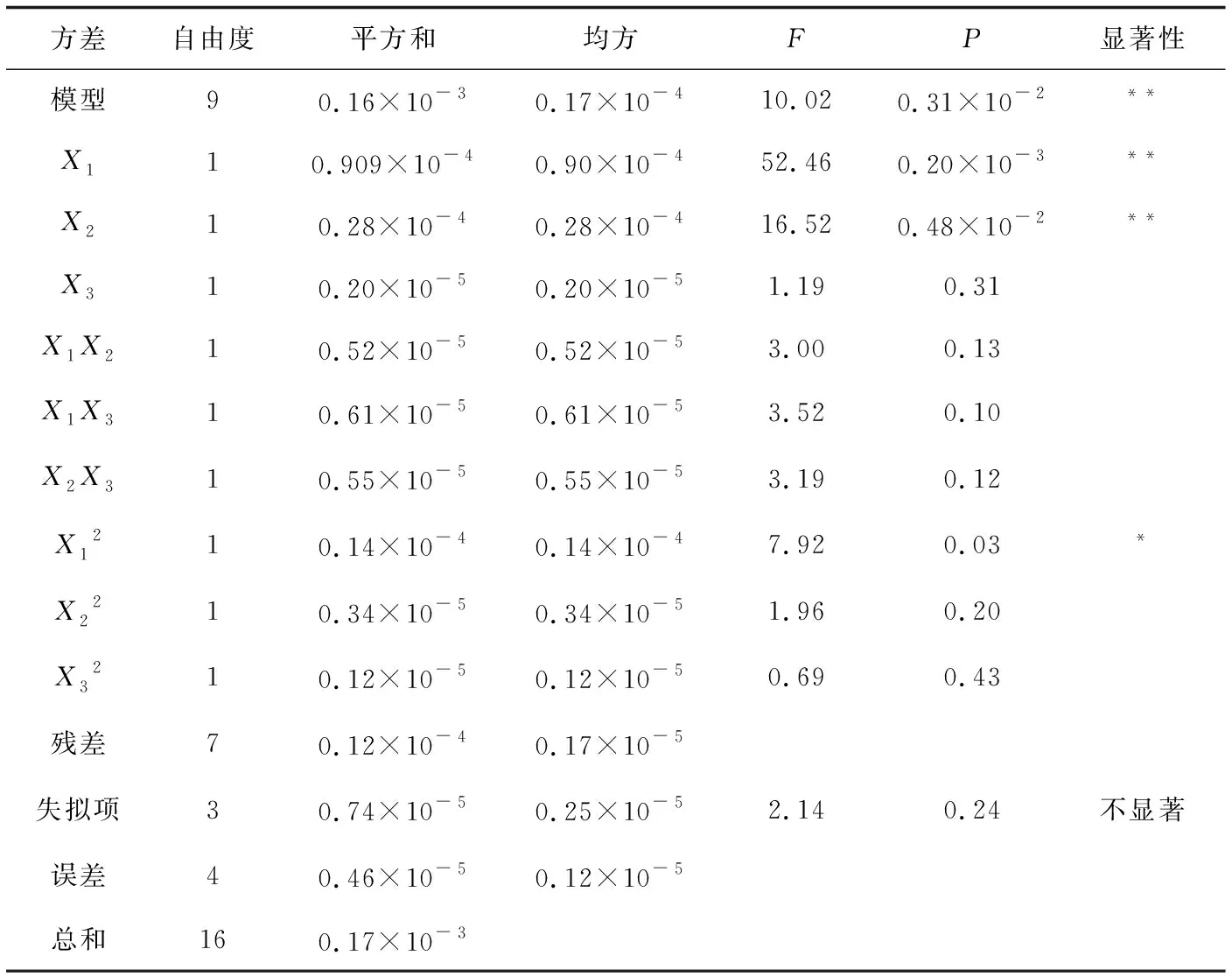
对该模型进行方差和显著性分析(表3)可知,回归模型的P=0.0031<0.01,极显著,失拟项P=0.24>0.05,不显著,说明模型显著可靠.决定系数R2为0.8971,说明有89.71%的试验组结果落在样本的回归曲线上,模型与实际情况拟合较好,变异系数CV值为0.37%,表明变异程度较小,可信度高.同时表3显示:一次项X1、X2极显著(P<0.01),且X1的F值较大,说明浸提温度对多糖得率的影响更显著;二次项X12的P<0.05,表明各因素对多糖得率的影响不是简单的线性关系;但交互项X1X2、X1X3、X2X3均不显著,又说明各因素对响应值影响的交互作用较弱.
2.2.3 响应曲面分析响应曲面和等高线图是将回归方程任一因素固定在0水平后的图形表达形式.响应曲面中曲线越陡峭说明该因素对得率的影响越大.图2显示,曲线的陡峭程度最高为浸提温度,最低为料液比,说明各因素对多糖得率的影响程度为浸提温度>浸提时间>料液比;另外,等高线图的形状越接近椭圆形说明两变量间交互作用越强,越接近圆形越弱,而图2所示的等高线图虽然都接近椭圆形,但弧度较缓,说明各因素间存在一定的交互作用但程度较弱,与表3结果一致.
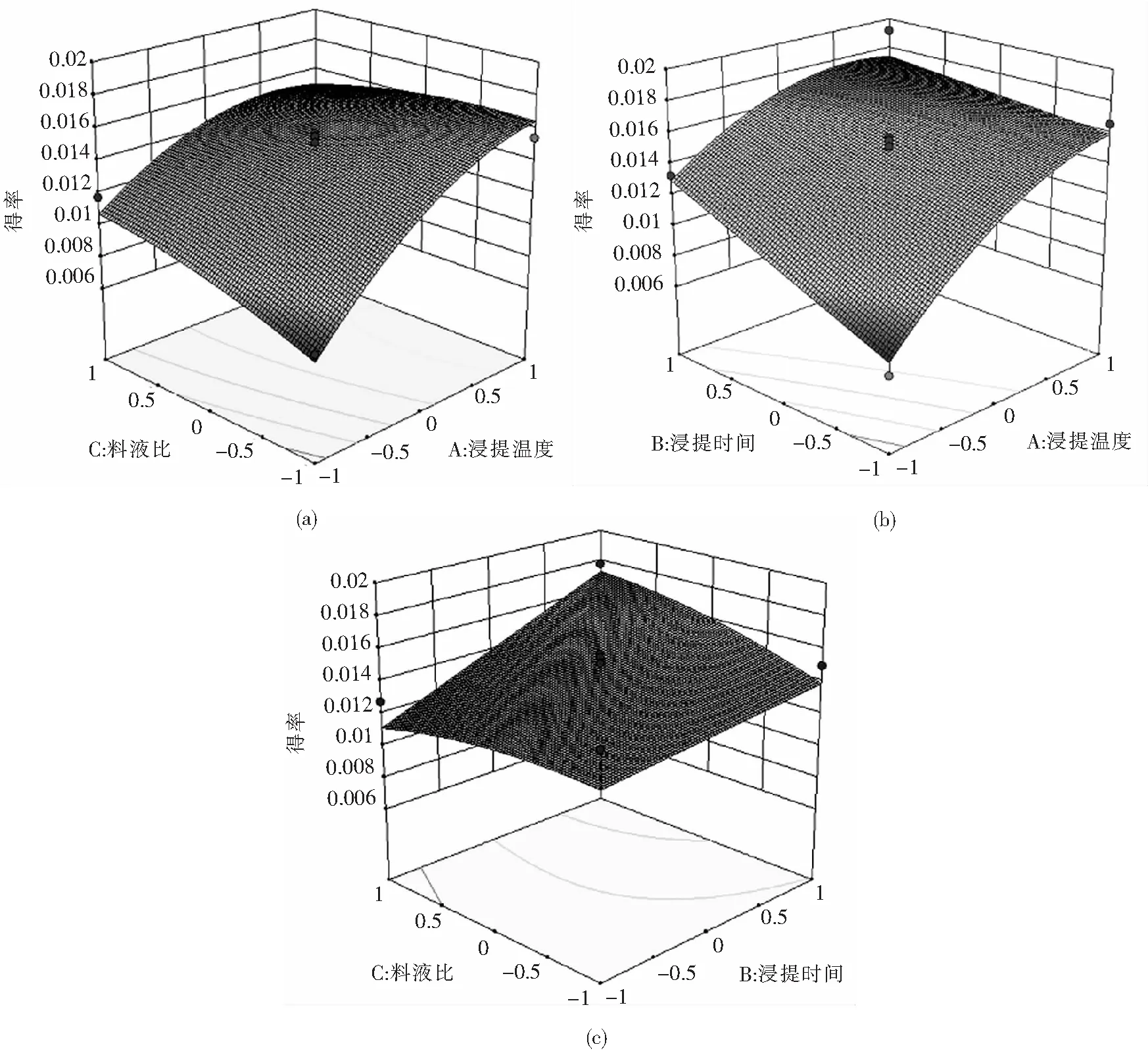
图2 各因素交互作用对黄枝瑚菌多糖得率影响的响应面和等高线:(a) 浸提温度-料液比的影响; (b)浸提温度-浸提时间的影响;(c) 浸提时间-料液比的影响Fig.2 Response surface and contourlines of effects of various interactive factors on polysaccharide yield from R. flava: (a) Effect of extraction temperature-solid liquid ratio;(b) effect of extraction temperature-extraction time; (c) effect of extraction time-solid liquid ratio
2.2.4 最优提取工艺验证通过Design Expert V8.0.6软件分析,预测多糖最佳浸提条件为料液比(1∶34) g/mL,83 ℃下浸提5 h,该条件下多糖理论得率为19.26 mg/g.实际得率为(19.21±0.15) mg/g,与理论值仅相差0.05 mg/g,说明该优化方案可行.
2.3 热重分析
图3所示的热重(TG)和微商热重(DTG)曲线表征了多糖的温度敏感性,其中有2次明显的质量损失:第一次是由于水分蒸发,多糖在30~100 ℃质量损失8.77%,该结果暗示该多糖具有一定持水力,可应用于酸乳和面制品中,以减少乳清析出,应对面制品口感不佳、失水等问题[10];由于多糖热分解,217~800 ℃范围内出现第二次质量损失(84.11%),并于308.67 ℃时达到最快热分解速率.而在100~217 ℃范围内多糖质量保持稳定,表明一定程度的热处理不会引起多糖的热分解,其可应用于需要一定高温处理的领域,如需巴氏杀菌的食品及药品.
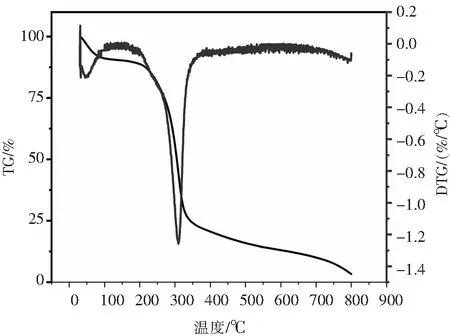
图3 黄枝瑚菌多糖TG和DTG曲线Fig.3 TG and DTG curves of polysaccharides from R. flava
2.4 红外光谱分析
黄枝瑚菌多糖的红外图谱如图4所示:3 440 cm-1和2 931 cm-1波数附近出现的强O—H和强C—H伸缩振动吸收峰,是典型的多糖特征吸收[11].1 540、1 250 cm-1附近为酰胺Ⅱ、Ⅰ的酰胺键弯曲振动吸收峰,说明多糖中可能含有蛋白质[12].1 070 cm-1附近是C—O—C糖化键振动和C—O—H拉伸振动重叠的吡喃糖环振动[13].1 650 cm-1和914 cm-1附近为C=O的伸缩振动和二聚体羧酸O—H基面外变角振动[14],两者表明多糖中含有糖醛酸.
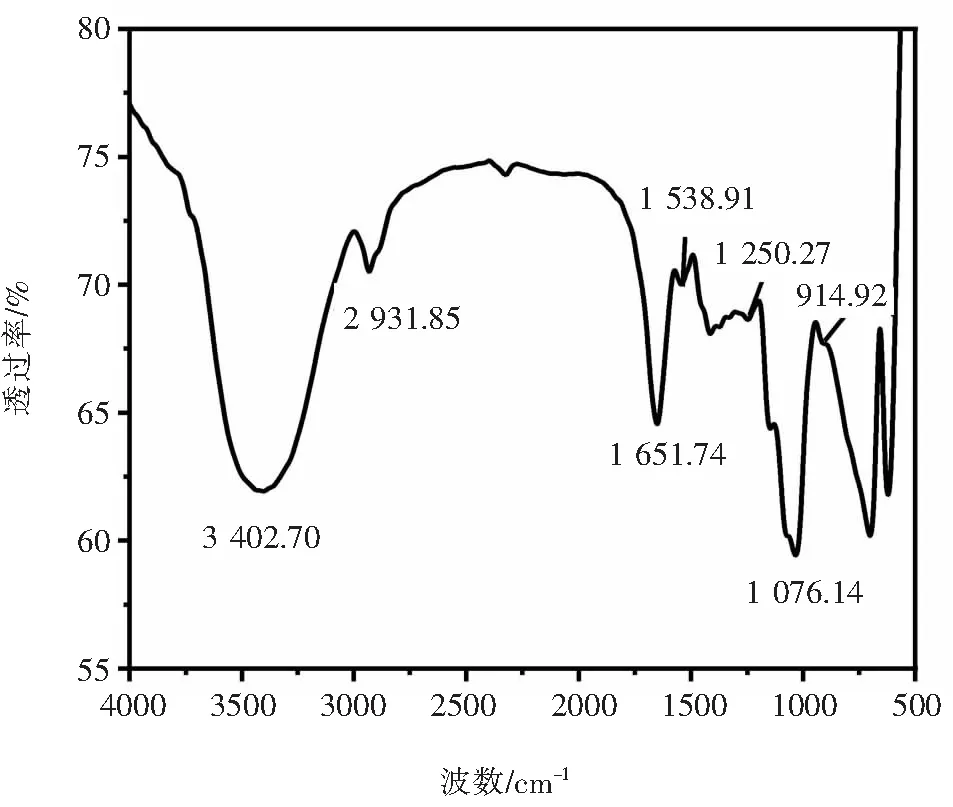
图4 黄枝瑚菌多糖的红外图谱Fig.4 FTIR of polysaccharides from R. flava
2.5 黄枝瑚菌多糖的抗氧化活性
2.5.1 对DPPH·的清除能力图5(a)显示,多糖对DPPH·的清除活性随样品浓度的升高而增大,125~500 μg/mL范围内,清除率增长59.05%;500 ~1 000 μg/mL时,清除率仅增长4.35%,但均在90%以上;当浓度为1 000 μg/mL,达到最高清除率96.33%,基本与阳性对照Vc持平,但明显高于同浓度的葡萄色顶枝瑚菌和红顶枝瑚菌子实体多糖对DPPH·的清除能力(约10%)[15-16].
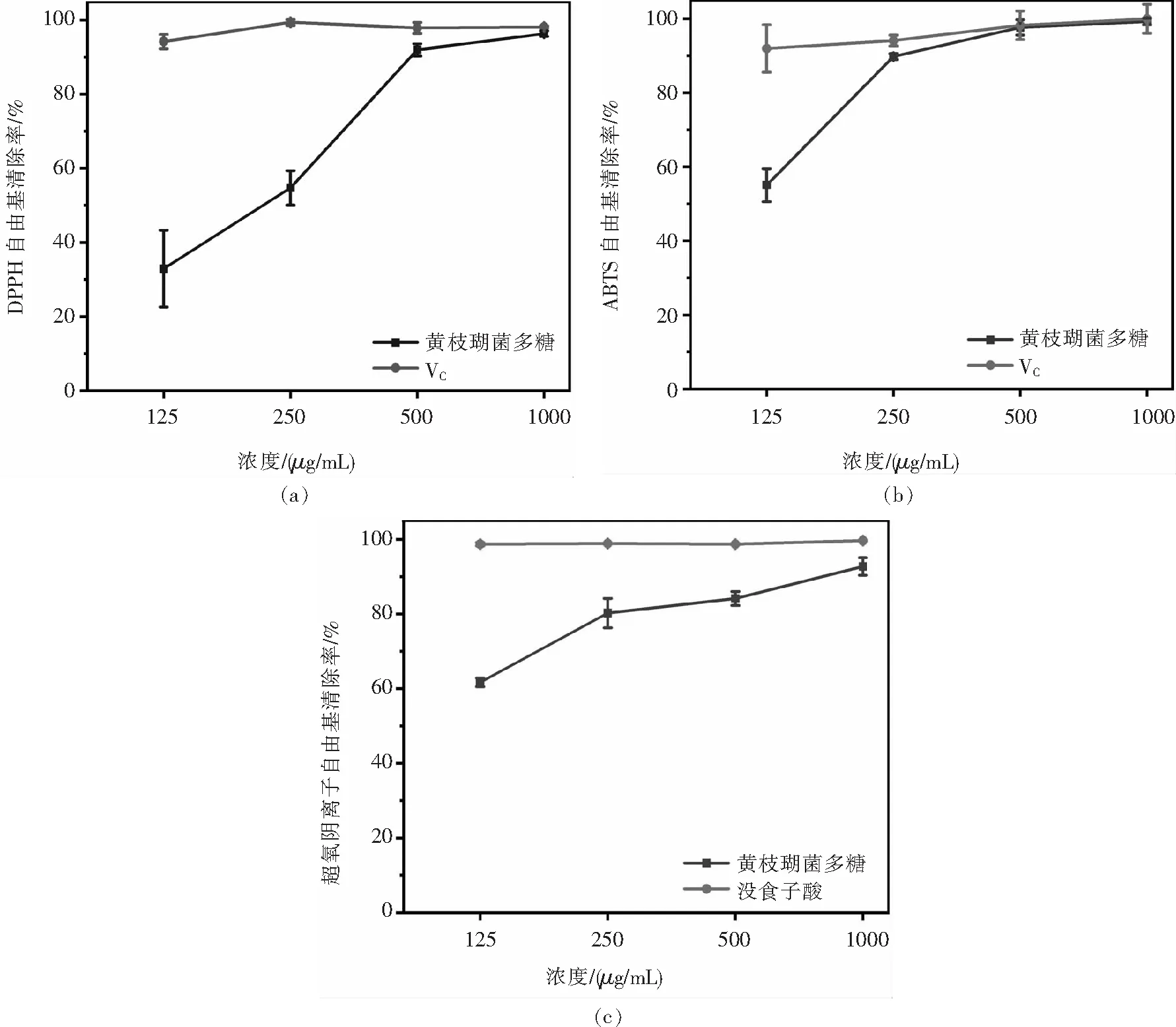
图5 黄枝瑚菌多糖的抗氧化活性:(a) DPPH·清除作用;(b)ABTS+·清除作用;(c)O2-·清除作用Fig.5 Antioxidant activities of polysaccharides from R. flava:The scavenging effect of DPPH·(a);ABTS+·(b);O2-·(c)
2.5.2 对ABTS+·的清除能力随着多糖质量浓度的增加,其对ABTS+·的清除率也呈现增长趋势,250 μg/mL后趋于平稳(图5(b)).在测试浓度范围内,清除率为55.04%~99.25%,最高活性基本与阳性对照持平,远高于红顶枝瑚菌多糖RBP-Ⅰ的清除率(10 mg/mL,15.71%)[16].
2.5.3 对O2-·的清除能力图5(c)显示多糖对O2-·的清除能力呈剂量依赖性.在测试范围内,清除率最高值为92.74%,其半抑制浓度(IC50)为232.08 μg/mL.可能由于83 ℃浸提5 h比沸水浸提2 h对多糖结构的影响小,本文枝瑚菌多糖对O2-·的清除能力优于何荣军等[17]从珊瑚菌中分离的多糖RFPF2A(IC50=2.5 mg/mL).
3 结 论
在单因素试验的基础上通过响应面试验,确定了黄枝瑚菌多糖的最佳热水浸提工艺条件:浸提温度83 ℃,浸提时间5 h,料液比(1∶34) g/mL,得率达19.21 mg/g,且其中浸提温度为主要影响因素.同时,热重分析结果显示该多糖能耐受一定程度的高温,可应用于需要热处理的食品和药品领域.此提取方法简单、重现性好、对多糖结构影响小,可为其工业化提取提供理论与技术支撑.此外,该多糖具有明显的多糖特征吸收峰,主要由吡喃糖构成,可能含有少量蛋白质和糖醛酸,且表现出较好的DPPH·、ABTS+·和 O2-·清除活性,具有作为天然抗氧化剂的潜力.本研究为黄枝瑚菌多糖在医药和功能性食品领域的综合开发利用提供了科学依据.
