固相萃取-高效液相色谱法检测废水中三种β-内酰胺类抗生素*
2021-11-09张西华
孔 瑜, 段 锋, 吴 达, 张西华
(1. 上海第二工业大学电子废弃物研究中心 资源循环科学与工程中心上海电子废弃物资源化协同创新中心,上海201209;2.中国科学院过程工程研究所环境技术与工程研究部 北京市过程污染控制工程技术研究中心,北京 100190;3.华北制药华胜有限公司,河北 石家庄 052160)
0 引言
环境中的抗生素主要来自人类和动物用药、工业生产、畜牧业、水产养殖业、医院、污水处理厂等点源,再通过农业、城市等径流向环境中扩散.目前,地表水、地下水、海水、土壤中常常有痕量抗生素的检出,抗生素已经成为环境中的新兴污染物之一[1-3],其大量排放可能导致抗性细菌(ARBs)和抗性基因(ARGs)的产生,从而具有潜在的环境风险[4-6].β-内酰胺类抗生素是生产和使用最广泛的一类抗生素,主要包括青霉素及其衍生物、头孢菌素、单酰胺环类、碳青霉烯类和青霉烯类酶抑制剂等[7].目前废水和环境水体中β-内酰胺类抗生素的检测没有统一的标准方法,文献中多采用高效液相色谱-质谱联用技术分析水环境中抗生素残留,如文献[8-10]中采用上述方法同时检测环境水体中多种β-内酰胺类抗生素,采用固相萃取预处理或者直接进样,检出限约为1 ng/L.由于制药废水中抗生素残留浓度水平为μg/L~mg/L[11-14],通常采用高效液相色谱法即可以满足检出限要求[15].质谱仪分析费用高,难以满足制药企业日常监测分析的要求,而多种抗生素分别通过高效液相色谱法来检测,时间耗费长,因此,需要建立一种操作简便的分析方法,用于废水中多种β-内酰胺类抗生素的同步检测.
本研究采用固相萃取-高效液相色谱法,建立了制药废水中三种典型β-内酰胺类抗生素美罗培南、普鲁卡因青霉素、头孢唑林钠的同步检测方法,并对固相萃取及液相色谱操作条件进行了优化.该方法精密度和准确度符合要求,检出限低,经验证可用于制药废水中残留抗生素的检测,满足企业检测分析需求.
1 实验
1.1 材料与试剂
抗生素标准品:美罗培南(>98%,上海麦克林生化科技有限公司)、普鲁卡因青霉素(>96%,某药企提供)、头孢唑林钠(>98%,上海阿拉丁生化科技股份有限公司).甲醇、乙腈(色谱纯,美国Fisher公司),乙酸铵、乙酸、盐酸、氨水(分析纯,国药集团化学试剂有限公司).实验用水均为超纯水.
1.2 实验设备与分析仪器
实验所用主要设备与仪器有1200 Infinity Series型高效液相色谱仪,采用G1365C/D多波长紫外检测器(美国Agilent 公司),Agilent ZORBAX SB-AQ液相色谱柱(3.5 μm,2.1 mm×150 mm),Agilent ZORBAX EXTEND C18液相色谱柱(3.5 μm,4.6 mm×150 mm),Extrapid型固相萃取仪、C18 固相萃取柱(6 mL/500 mg,北京莱伯泰科仪器有限公司),Oasis HLB固相萃取柱(6 mL/500 mg,美国Waters公司),DC150-1氮吹仪(杭州佑宁仪器有限公司),EL20K型pH计(瑞士Mettler Toledo公司).
1.3 实验方法
1.3.1 标准溶液的配制美罗培南(MERO)、普鲁卡因青霉素(PROP)、头孢唑林钠(CFZS)分别配置成100 mg/L的单标储备液,密封后放入-20 ℃的冰箱避光保存.每次实验前取出三种单标储备液配制成20 mg/L的混标工作液,溶液均用超纯水定容.
1.3.2 固相萃取预处理方法固相萃取预处理方法参考文献[6].将水样用稀盐酸调节pH,用0.45 μm玻璃纤维滤膜过滤,将100 mL水样以3~4 mL/min的流速连续通过固相萃取柱,始终使萃取柱水样高度大于1 cm,上样流速应保持恒定,然后用10 mL的超纯水以3 mL/min的流速淋洗,继续真空抽吸直到萃取柱完全干燥.最后用一定体积甲醇进行洗脱,收集洗脱液于样品管中,高纯氮气吹至近干,1 mL的超纯水定容,避光保存在-20 ℃的冰箱中.通过改变固相萃取柱类型、固相萃取pH条件、甲醇洗脱溶液体积来优化固相萃取操作条件.
1.3.3 高效液相色谱方法流动相由二元混合体系组成,其中水相为20 mmol/L的乙酸铵-乙酸溶液,有机相为乙腈,进样量20 μL,柱温35 ℃,紫外检测波长285 nm.通过改变液相色谱柱类型、流动相比例、pH、流速来优化高效液相色谱条件.
2 结果与讨论
2.1 固相萃取条件优化
2.1.1 固相萃取柱的选择美罗培南、普鲁卡因青霉素、头孢唑林钠均含有羧基或氨基,具有两性分子的特性.目前许多研究都证明了两亲性的HLB固相萃取柱对β-内酰胺类抗生素有良好的回收率[16-17].本文选用HLB和C18固相萃取柱对三种混合抗生素进行萃取,回收率如图1所示.结果表明,HLB固相萃取柱的萃取效率明显高于C18,尤其是针对美罗培南和普鲁卡因青霉素,HLB柱的回收效率为60%~90%,而C18柱的回收效率小于25%.HLB和C18萃取柱对于头孢唑林钠的回收率差别较小,分别是83.0%和68.6%.HLB固相萃取柱的吸附材料是由亲水性的N-乙烯基吡咯烷酮和亲脂性二乙烯苯共聚物组成,比表面积大,对极性混合物保留效果较好,可适用的pH范围较宽,由于亲水单体的存在,可使填料的润湿性增加,活化的时间缩短.由于HLB柱的吸附材料是由亲水性的N-乙烯基吡咯烷酮和亲脂性二乙烯苯共聚物组成,比表面积大,对极性混合物保留效果较好,可适用的pH范围较宽.根据以上实验结果,选择HLB固相萃取柱对水样进行萃取.
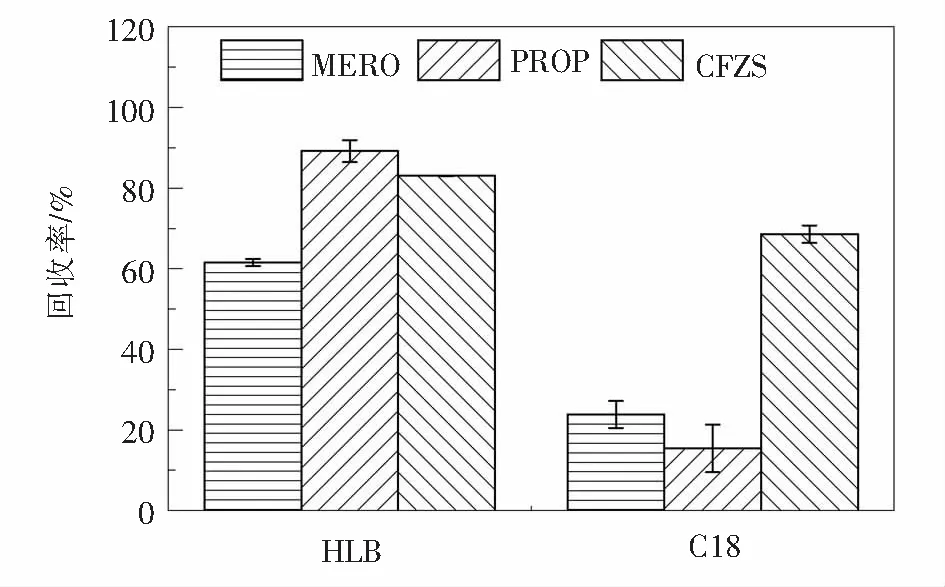
图1 固相萃取柱类型对抗生素回收率的影响Fig.1 Effect of the type of solid phase extraction column on antibiotics recovery rate
2.1.2 固相萃取pH的选择水样的pH是影响抗生素在固相萃取柱上吸附的重要条件,由于抗生素在不同pH条件下呈现离子或分子形态,通过调节pH使目标物质呈现分子状态,在疏水相互作用下被萃取柱保留,离子态的杂质不能有效地吸附而被去除.用盐酸和氨水依次将固相萃取前水样的pH调节为3、4、5、7、9,结果如图2所示.可以看出,普鲁卡因青霉素在不同pH条件下的回收率保持在80%以上,高于美罗培南和头孢唑林钠,原因可能是固相萃取柱对普鲁卡因的保留效果好,普鲁卡因上的-NH2基团可以被HLB萃取柱上的亲水基团所吸引,苯环还可以与二乙烯苯产生π-π 相互作用,增强了吸附效果.头孢唑林钠在不同pH条件下的回收率保持在68%~83%之间,在酸性条件下的回收率高于中性和碱性.美罗培南在酸性、中性、碱性条件下的回收率均不高,并且中性和碱性的环境对该抗生素的影响更大,有研究指出碳青霉烯类抗生素尤其是美罗培南对pH变化较为敏感,在溶液中不稳定[18-19].综上,在pH为3~5弱酸环境中,三种抗生素的固相萃取回收率保持在59.1%~89.2%之间,最终选择将固相萃取上样前水样的pH调节为4.
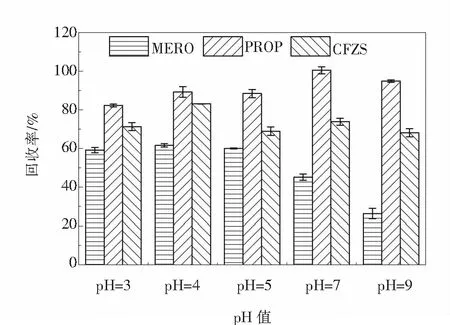
图2 水样pH对抗生素回收率的影响Fig.2 Effect of pH of solid phase extraction on antibiotics recovery rate
2.1.3 洗脱溶液体积的选择分别用6 mL、8 mL、10 mL、12 mL纯甲醇溶液对HLB固相萃取柱进行洗脱,研究不同洗脱液体积对固相萃取回收率的影响,结果如图3所示.结果表明,洗脱溶液体积为6 mL和10 mL时,美罗培南的回收率分别为53.8%和61.5%,头孢唑林钠的回收率分别为77.3%和83.0%;洗脱溶液体积为8 mL时,普鲁卡因青霉素回收率最高可以达到94.4%.甲醇作为质子溶剂,可与物质形成氢键,增强洗脱效果.在洗脱过程中,如果洗脱溶液体积过少,不能完全将目标成分洗脱;洗脱溶液体积过多,造成溶液的浪费,增加固相萃取的时间,还可能将其他干扰杂质洗脱下来,最终影响目标物质的分析.综合考虑选择10 mL作为固相萃取最佳洗脱溶液用量.
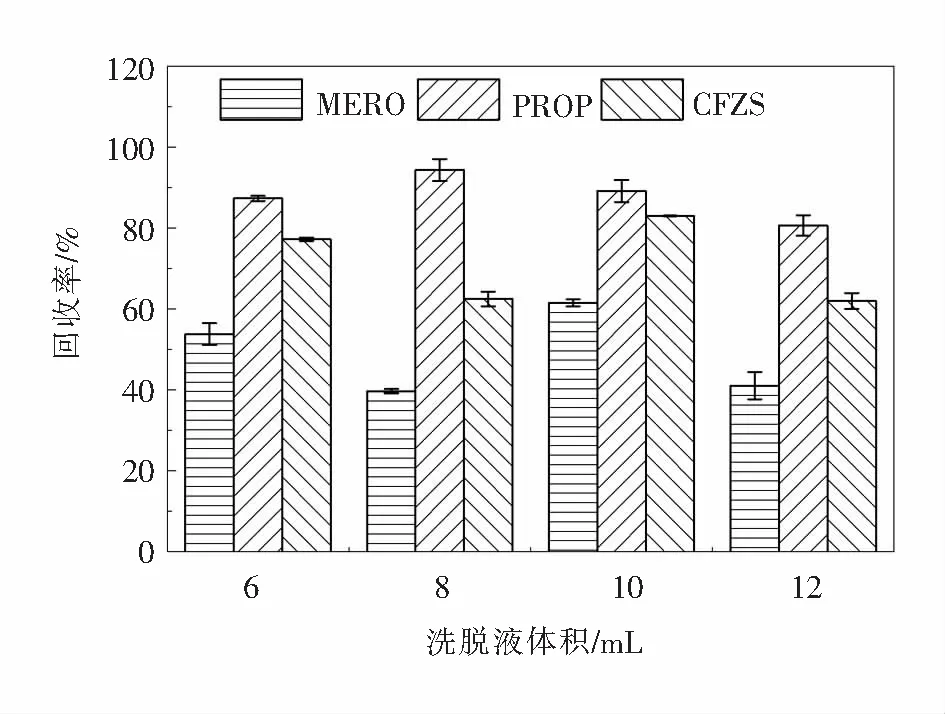
图3 洗脱液体积对抗生素回收率的影响
2.2 高效液相色谱条件优化
2.2.1 色谱柱的选择本文采用了可以耐高水相未封端的Agilent ZORBAX SB-AQ(3.5 μm,2.1 mm×150 mm)和双封端的Agilent ZORBAX EXTEND C18(3.5 μm, 4.6 mm×150 mm)两种亲水性色谱柱进行对比,结果如图4所示,可以看出, EXTEND C18色谱柱峰形、分离度明显优于SB-AQ色谱柱.图4(a)的色谱峰拖尾严重,三种抗生素的峰形没有完全分离.相反地,图4(b)的色谱峰尖锐无拖尾,而且峰高相比图4(a)高出很多,提高了抗生素检测的灵敏度.EXTEND C18色谱柱采用双齿键合、双封端的形式修饰C18色谱柱,最大程度降低了硅胶基质表面的硅羟基对极性基团的吸引作用,而SB-AQ色谱柱未封端的硅羟基与目标分析物中的极性基团产生了静电作用力,导致色谱峰拖尾.所以最终选择封端的EXTEND C18色谱柱进行分析.
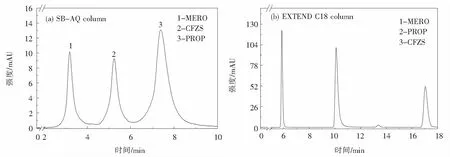
图4 高效液相色谱图:(a)SB-AQ色谱柱,(b)EXTEND-C18色谱柱Fig.4 HPLC chromatograms with (a) SB-AQ column and (b) EXTEND C18 column
2.2.2 流动相比例及pH的选择液相色谱水相流动相为乙酸铵-乙酸混合溶液,有机相为乙腈.实验采用等度洗脱的模式,水相和有机相的比例分别设置为90%∶10%、80%∶20%、70%∶30%,同时分别用乙酸和氨水将水相pH调为4、4.5、5、5.5和10,实验结果如图5所示.由图5(a)所示,流动相中有机相的比例越高,洗脱强度越大,目标物质的出峰时间越靠前,在有机相比例提高的情况下,目标抗生素分成了多个峰,不符合实验的分析要求.因此水相与有机相的最佳比例为90%∶10%.从图5(b)可以看出在偏酸性的条件下物质的峰形较好,分离度较高.随着pH的提高,目标抗生素的出峰时间提前,还可能发生了解离.这是由于抗生素在不同pH条件下呈现离子或分子形态,通过调节pH使目标物质呈现分子状态,从而在色谱柱上得到有效分离.对比发现,在pH=4的条件下抗生素的峰面积更高,灵敏度更好,所以将流动相中水相的最佳pH设定为4.
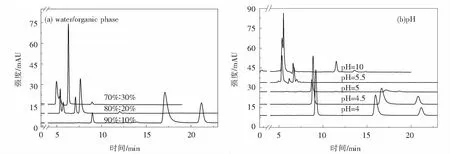
图5 高效液相色谱图:(a)不同流动相比例,(b)不同流动相pH条件Fig.5 HPLC chromatograms of (a) different mobile phase composition and (b) different mobile phase pH
2.2.3 流速的选择为了缩短分析时间,提高分析效率,可将流速提高.因此,设置了0.25 mL/min、0.3 mL/min、0.35 mL/min、0.4 mL/min、0.5 mL/min五个流速.结果显示,随着流速的增加,三种抗生素的出峰时间越来越靠前,大大提高了分析的效率,但是流速越快,保留越弱,峰面积也越来越小,最终影响物质的检出限和灵敏度.考虑到分析效率和灵敏度的问题,选择0.4 mL/min作为HPLC最佳流速,可将单个样品的分析时间缩短至20 min以内,美罗培南、普鲁卡因青霉素、头孢唑林钠的出峰时间分别为5.8 min、10.1 min、16.9 min.
2.3 方法的评价与验证
2.3.1 标准曲线本文采用外标法,将20 mg/L、10 mg/L、5 mg/L、2 mg/L、1 mg/L、0.8 mg/L、0.5 mg/L、0.2 mg/L的混标稀释液依次进样(n=3),三种β-内酰胺类抗生素的峰形较好,分离度较高.以峰面积为纵坐标,浓度(mg/L)为横坐标,进行线性回归分析(n=3),结果如表1所示.三种抗生素在0.2 ~20 mg/L之间的相关系数(R2)均达到了0.999 0,线性关系良好.

表1 β-内酰胺类抗生素标准曲线方程及相关系数(n=3)
2.3.2 方法检出限与定量限一般将色谱峰信噪比为3∶1时对应的目标物浓度确定为仪器检出限,信噪比为10∶1时对应的目标物浓度确定为仪器定量限.结果表明,美罗培南、普鲁卡因青霉素、头孢唑林钠的仪器检出限分别为0.1 mg/L、0.15 mg/L和0.15 mg/L,仪器定量限分别为0.2 mg/L、0.5 mg/L和0.5 mg/L.
方法定量限是指以某种溶液为基质时,通过已建立的方法测到的目标分析物的最低浓度[12],具体如公式(1)所示.
LOQ=IQL/(RC).
(1)
式中:LOQ表示方法定量限,μg/L;IQL表示仪器定量限,mg/L;R表示回收率(%),平均回收率见表3;C表示浓缩倍数.本研究中固相萃取浓缩倍数为100倍,根据公式(1)可计算出以实际水样为基底溶液时的方法定量限为2.65~5.87 μg/L.
表2 β-内酰胺类抗生素检出限和定量限
Tab.2 Detection limit and quantitative limit of β-lactam antibiotics

抗生素仪器检出限/(mg/L)仪器定量限/(mg/L)方法定量限/(μg/L)美罗培南0.10.22.65普鲁卡因青霉素0.150.55.04头孢唑林钠0.150.55.87
2.3.3 加标回收率以空白水样和抗生素污水处理厂实际水样为基底溶液,设置0.5 mg/L、2 mg/L、10 mg/L低、中、高三个浓度水平,分别对空白水样和实际废水进行加标回收实验.结果如表3所示,以超纯水为基底溶液时,三种抗生素的回收率保持在53.2%~98.67%之间,相对标准偏差小于6%;以实际废水为基底溶液时,三种抗生素的回收率保持在74.67%~106%之间,相对标准偏差小于7%.回收率和相对标准偏差均在合理的范围之内,说明该方法具有良好的准确度和精密度,在实际样品的分析之前应进行加标回收率实验,确保实验结果的可靠.
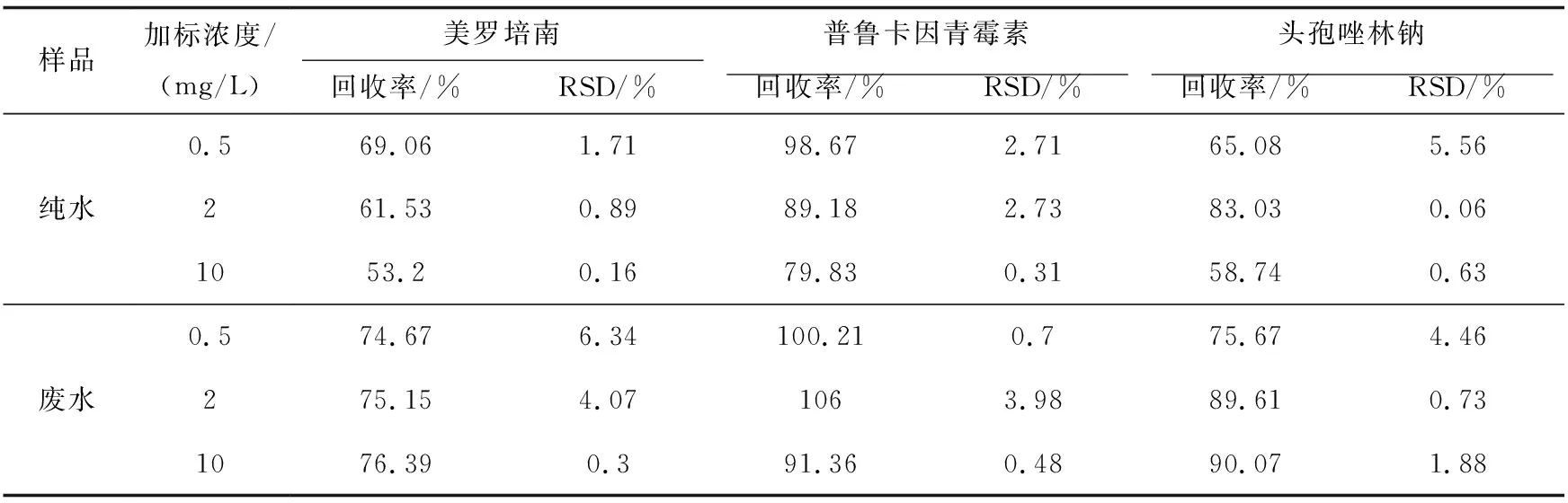
表3 空白水样、污水水样加标回收率和相对标准偏差(n=3)
2.4 实际水样的测定
水样取自国内某大型制药企业污水处理站进出水,该污水处理厂主要采用预处理+生化处理工艺,采用已建立的固相萃取-高效液相色谱法对废水中残留抗生素进行分析,水样检测三次取平均值,结果如表4所示.
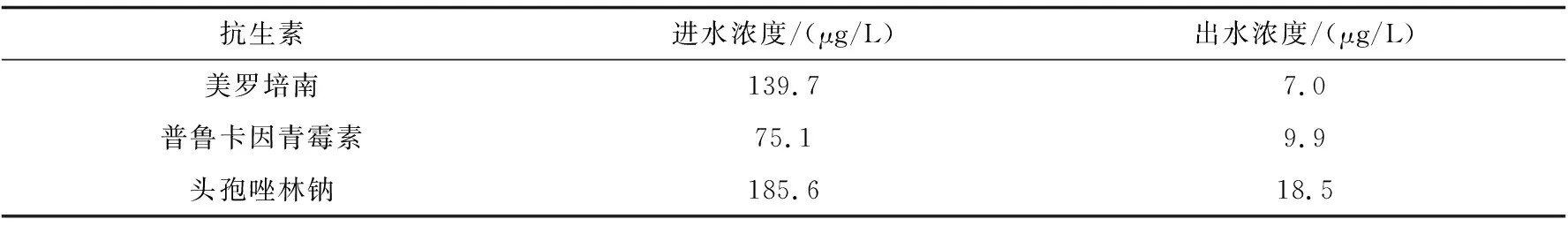
表4 制药污水处理厂残留抗生素的检出浓度
由表4可得,在污水处理厂进水中美罗培南、普鲁卡因青霉素、头孢唑林钠三种抗生素的平均浓度分别为139.7 μg/L、75.1 μg/L、185.6 μg/L,经过处理后,出水中仍然含有微量的残留抗生素,平均浓度分别为7.0 μg/L、9.9 μg/L、18.5 μg/L,三种抗生素的去除率分别为95.0%、86.8%、90.1% .
3 结 论
(1)采用固相萃取-高效液相色谱法,建立了制药废水中美罗培南、普鲁卡因青霉素、头孢唑林钠3种β-内酰胺类抗生素的同步检测方法,该方法定量限为2.65~5.87 μg/L,实际废水加标回收率为74.67%~106%,可用于制药废水日常检测,抗生素标准溶液和废水溶液需在-20 ℃下避光保存,且保存时间不超过48 h.
(2)采用建立的方法测得,制药废水经过预处理和生化处理过程后,出水中仍然含有微量的美罗培南、普鲁卡因青霉素、头孢唑林钠,平均浓度分别为7.0 μg/L、9.9 μg/L、18.5 μg/L,需要关注抗生素后续的迁移转化过程.