构建ADH2和THI3基因敲除酿酒酵母用于降低糯米酒中高级醇的研究
2021-11-10陈文颖闫统帅周世水
吴 亮,陈文颖,闫统帅,周世水
(华南理工大学 生物科学与工程学院,广东 广州 510006)
糯米酒是中国历史悠久的特色饮料酒[1],糯米作为主要发酵原料,经过浸米、蒸饭、酒曲糖化和发酵等步骤酿制而成[2],因其富含蛋白质、氨基酸、维生素和多糖多肽等营养物质,深受人们的喜爱[3-4]。高级醇是糯米酒中重要的呈香呈味物质[5],合适的高级醇浓度可以显著改善糯米酒的品质和风味[6-7],然而高级醇浓度过高时,会给酒体带来苦味和异杂味,也是糯米酒容易使人上头的原因之一[8]。
高级醇俗称杂醇油,是三个及以上碳原子一价醇类的总称[9]。糯米酒中的高级醇主要包括异戊醇、异丁醇、正丙醇和β-苯乙醇,它们都是酿酒酵母(Saccharomyces cerevisiae)次级代谢副产物[10]。酿酒酵母中高级醇的合成主要包括两条代谢途径[11]:氨基酸分解途径(Ehrlich途径)和生物合成途径。Ehrlich途径中,支链氨基酸经过转氨反应形成α-酮酸,然后α-酮酸经脱羧和脱氢反应形成高级醇[12]。生物合成途径中,糖代谢形成的丙酮酸经三羧酸循环(tricarboxylic acid cycle,TCA)形成α-酮酸,再经过脱羧和脱氢形成相应的高级醇[13]。
酿酒酵母ADH2基因编码的乙醇脱氢酶参与了高级醇合成过程的脱氢步骤,它与其他高级醇合成相关基因协同提高异丁醇、异戊醇[14]和β-苯乙醇的生成量[15-16],而敲除ADH2基因对糯米酒高级醇生成量的影响研究甚少。THI3基因编码的类丙酮酸脱羧酶被鉴定为亮氨酸代谢的主要脱羧酶,它催化2-酮异己酸形成异戊醇[17]。STYGER G等[18]通过敲除酿酒酵母THI3基因,导致主要高级醇的生成量都下降。
本研究构建了ADH2和THI3基因敲除的单倍体重组酵母,再杂交成重组双倍体酵母,应用于糯米酒发酵来研究ADH2和THI3基因敲除对高级醇生成的影响,为降低糯米酒中高级醇的含量提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
本实验所用菌株和质粒如表1所示。

表1 本实验所有菌株和质粒Table 1 Strains and plasmids used in the study
1.1.2 主要试剂
安琪白酒曲:安琪酵母股份有限公司;ApexHF HS脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、DNA回收纯化试剂盒、质粒小量提取试剂盒:湖南艾科瑞生物科技有限公司;遗传霉素(G418)、博来霉素(Zeocin):北京普博欣生物科技有限责任公司;引物:上海生工生物工程有限公司合成;酵母提取粉、蛋白胨、琼脂(均为生化试剂):广东环凯微生物科技有限公司;乙酸丁酯、正丙醇、异丁醇、异戊醇、β-苯乙醇(均为色谱纯):上海阿拉丁生化科技股份有限公司;半乳糖、无水乙酸钠、氯化钾、氯化钠、酒石酸钾钠、邻苯二甲酸氢钾、氢氧化钠、3,5-二硝基水杨酸(均为分析纯):天津市科密欧化学试剂有限公司。
1.1.3 主要培养基[19]
Luria-Bertani(LB)培养基:氯化钠10 g/L、蛋白胨10 g/L、酵母粉5 g/L。
浸酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20g/L、蛋白胨20g/L、酵母浸粉10g/L。
半乳糖诱导培养基(yeast extract peptone galactose,YEPG):半乳糖20 g/L、蛋白胨20 g/L、酵母提取粉10 g/L。
麦氏(McClary)产孢培养基:葡萄糖0.1%,氯化钾0.18%,无水乙酸钠0.82%,酵母提取粉0.25%,琼脂2%。
所有固体培养基在液体培养基的基础上添加2%琼脂,并都需115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
T100聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪、PowerPac 3000电泳仪、Gel Doc2000凝胶成像分析系统:美国Bio-Rad公司;5804R高速台式冷冻离心机:德国Eppendorf公司;GC8100气相色谱仪(gaschromatography,GC):滕州中科普仪器有限公司。
1.3 方法
1.3.1 引物设计
根据美国国立生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中酿酒酵母(S.cerevisiae)S288c基因组序列,采用Primer 5.0软件设计聚合酶链式反应(PCR)引物见表2。

表2 本实验使用的引物Table 2 Primers used in the study
1.3.2 基因敲除组件的构建
ADH2基因敲除组件构建:以DC-S和DC-A为引物,质粒PUG6为模板,扩增得到KanMX抗性基因片段(1 703 bp,loxp-KanMX-loxp片段)。以酵母基因组作为模板,分别用引物对ADH2-E/ADH2-F和ADH2-G/ADH2-H合成ADH2基因上游同源臂AU(165 bp)和下游同源臂AD(185 bp)。再用融合PCR方法将三个片段连接成ADH2基因敲除组件AUloxp-KanMX-loxp-AD(1 957 bp)。
THI3基因敲除组件构建:以THI3-R和THI3-T为引物,质粒PUG6为模板,扩增得到KanMX抗性基因片段(1 767bp,loxp-KanMX-loxp片段)。以酵母基因组作为模板,分别用引物对THI3-E/THI3-F和THI3-G/THI3-H合成THI3基因上游同源臂TU(299 bp)和下游同源臂TD(256 bp)。利用融合PCR将三个片段连接成THI3基因敲除组件TU-loxp-KanMXloxp-TD(2 244 bp)。
1.3.3 重组酵母菌株的构建
(1)重组单倍体酵母菌株的获得
本研究采用电转化法[20],将ADH2基因敲除组件转化到酵母菌XF1a7和XF1α6,通过同源重组获得重组菌XF1a7-AK和XF1α6-AK。通过含200 μg/mL G418抗生素的YEPD平板筛选阳性转化子,并进行PCR验证。然后利用Cre/loxP重组系统去除KanMX抗性标记,将Cre重组酶表达载体PSH65质粒转化到XF1a7-AK和XF1α6-AK中,YEPG培养诱导Cre表达并切除KanMX抗性标记。再通过传代的方式使PSH65质粒丢失,最终获得ADH2基因缺失的重组菌XF1a7-A和XF1α6-A。基因敲除过程如图1所示。

图1 ADH2和THI3基因敲除过程Fig.1 Knockout process of gene ADH2 and THI3
类似地,将THI3基因敲除组件转化到XF1a7-A和XF1α6-A中,筛选获得XF1a7-ATK和XF1α6-ATK,最终得到ADH2和THI3双基因缺失的酵母菌XF1a7-AT和XF1α6-AT。
(2)重组双倍体酵母菌株的构建
通过不同配型重组单倍体酵母的杂交得到重组双倍体酵母菌[21]。首先,将菌株接种到10 mL YEPD液体培养基中30 ℃活化培养12~16 h,然后各取1 mL a型和α型单倍体酵母菌液接种到3 mL YEPD培养基中培养杂交24 h,用显微镜观察杂交情况,并将杂交菌液涂布到YEPD平板中培养2 d,挑取较大的菌落划线到产孢培养基中26 ℃培养5~7 d,若能产生孢子则为杂交成功的重组双倍体酵母菌株。
1.3.4 生长曲线的绘制
挑取一环酵母菌接种到10 mL YEPD液体培养基中,30 ℃摇床培养24 h。再将菌液按2%的比例接种到100 mL YEPD液体培养基中,30℃摇床培养,每2h取样测波长600nm的吸光度值(OD600nm值)。以OD600nm值为纵坐标,时间为横坐标绘制生长曲线。
1.3.5 发酵试验
从试管斜面取一环酵母菌接种到10 mL YEPD液体培养基中,30 ℃摇床培养24 h后,取2 mL菌液接种到含18 mL YEPD液体培养基的50 mL锥形瓶中,30 ℃摇床培养16 h,得到种子液。
取40 g糯米、100 mL水加入250 mL烧杯中,浸泡2 h,蒸饭后冷却,加入10 mL种子液、0.8 g酒曲,搅拌均匀,30 ℃发酵4 d。
1.3.6 样品处理
发酵糯米酒过滤酒液,测定其还原糖,另取100 mL滤液和100 mL水到1 000 mL蒸馏烧瓶中蒸馏出100 mL酒液,测定酒精度和高级醇含量。
1.3.7 分析方法
CO2释放量采用称质量法测量[22]、残留还原糖用3,5-二硝基水杨酸法测定[23]、酒精度用酒精计法测定[24],高级醇等挥发性物质通过气相色谱内标法测定[25],内标为乙酸丁酯,气相色谱相关参数如下:
色谱柱为LZP-930白酒分析毛细管柱(25 m×0.53mm×1.0 μm);高纯氮气(N2)为载气,载气流速30 mL/min;柱箱的升温程序为50 ℃保持5 min,以10 ℃/min的速度升温至200 ℃,保持5 min。检测器温度230 ℃,氢气流速30 mL/min,空气流速300 mL/min,尾吹氮气速度30 mL/min;进样口温度220 ℃,进样体积0.4 μL。
2 结果与分析
2.1 重组酵母菌株的构建和验证
按照1.3.3的方法构建重组菌株,阳性转化子菌株通过PCR验证,分别用引物ADH2-A/ADH2-D(基因两端验证引物)、ADH2-A/B-M(上游验证)和C-M/ADH2-D(下游验证)对重组单倍体酵母菌株进行PCR验证,结果见图2。由图2可知,XF1a7的基因两端验证、上游验证、下游验证的结果分别为1 557 bp、无条带、无条带,XF1a7-AK的基因两端验证、上游验证、下游验证的结果分别为2 057 bp、882 bp、1 020 bp,XF1a7-A的基因两端验证、上游验证、下游验证的结果分别为550 bp、无条带、无条带,PCR验证条带和预期一致,因此成功获得ADH2基因敲除的单倍体酵母菌。

图2 重组单倍体酵母菌株XF1a7-AK、XF1a7-A的PCR验证Fig.2 PCR verification of recombinant haploid yeast strains XF1a7-AK and XF1a7-A
对ADH2敲除菌进行THI3基因的敲除,阳性转化子分别用PCR引物对THI3-A/THI3-D(基因两端验证引物)、THI3-A/B-M(上游验证)和C-M/THI3-D(下游验证)进行PCR验证,结果见图3。由图3可知,XF1a7-A的基因两端验证、上游验证、下游验证的结果分别为1 897 bp、无条带、无条带,XF1a7-ATK的基因两端验证、上游验证、下游验证的结果分别为2 355 bp、1 067 bp、1 133 bp,XF1a7-AT的基因两端验证、上游验证、下游验证的结果分别为848 bp、无条带、无条带,PCR验证条带和理论一致,因此成功获得ADH2和THI3双基因敲除的单倍体酵母菌株。

图3 重组单倍体酵母菌株XF1a7-ATK、XF1a7-AT的PCR验证Fig.3 PCR verification of recombinant haploid yeast strains XF1a7-ATK and XF1a7-AT
根据1.3.3的方法,通过XF1a7-A和XF1α6-A杂交得到重组双倍体XF1-A,XF1a7-AT和XF1α6-AT杂交得到重组双倍体XF1-AT,结果见图4。由图4可知,许多哑铃型细胞,即为单倍体杂交过程形态。菌株XF1-A和XF1-AT的产孢验证见图5。由图5可知,XF1-A和XF1-AT都能产生孢子,说明XF1-A和XF1-AT都是成功杂交的双倍体酵母菌。

图4 重组单倍体的杂交过程形态Fig.4 Morphology of hybridization of recombinant haploid
图5 重组双倍体酵母的产孢验证Fig.5 Verification of sporulation of recombinant diploid yeast
2.2 双倍体重组菌的生长性能
根据1.3.4的方法,绘制原始酵母XF1、重组双倍体酵母XF1-A和XF1-AT的生长曲线,结果见图6。由图6可知,重组菌XF1-A的生长曲线和原始菌XF1几乎相同,双基因缺失酵母XF1-AT的前期的生长速率略微低于菌株XF1,但是最终生物量都没有显著差异。这表明ADH2和THI3双基因缺失对酵母菌体生长性能影响不大。
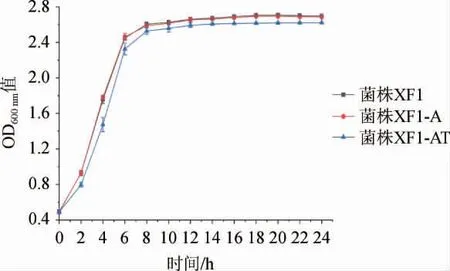
图6 重组菌和原始菌XF1的生长曲线Fig.6 Growth curves of recombinant strains and original strain XF1
2.3 ADH2和THI3基因敲除对糯米酒高级醇生成的影响
重组双倍体酵母菌株和原始菌发酵糯米酒高级醇生成量见图7。
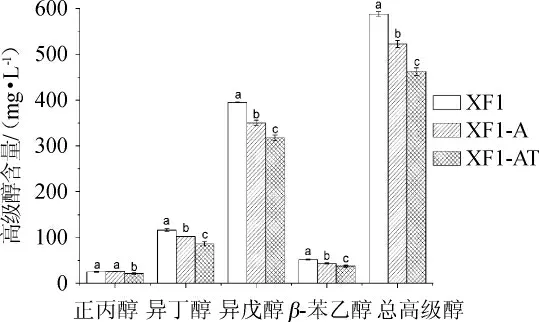
图7 重组菌和原始菌XF1高级醇生成量Fig.7 Higher alcohols production of recombinant strains and original strain XF1
由图7可知,菌株XF1-A的总高级醇生成量为522.16 mg/L,比菌株XF1降低11.16%(P<0.05),其中异丁醇、异戊醇和β-苯乙醇分别降低12.08%、11.32%和16.31%。菌株XF1-AT的高级醇生成量最低,为462.03 mg/L,比菌株XF1降低21.39%,其中正丙醇、异丁醇、异戊醇和β-苯乙醇分别降低15.10%、25.70%、19.63%和28.17%。
实验结果表明ADH2基因缺失的酵母能降低高级醇的生成量,但是降低幅度只有11%左右,原因可能是酵母中存在多种脱氢酶都能催化该脱氢反应[12],而ADH2基因编码的脱氢酶不是主要脱氢酶的缘故。ADH2和THI3基因缺失的酵母能显著降低高级醇的生成量(P<0.05),原因是THI3基因编码的脱羧酶参与高级醇合成中α-酮酸的脱羧,THI3的缺失减少了相应醛的生成,而ADH2基因缺失又减少这些醛脱氢形成的高级醇,因而协同降低了高级醇的生成量。
2.4 ADH2和THI3基因敲除对发酵性能的影响
重组双倍体酵母菌株和原始菌糯米酒发酵后的基本发酵性能测定结果见表3。由表3可知,重组菌XF1-A和XF1-AT的CO2产生量、残留还原糖、酒精度与原始菌XF1相比都无显著差异(P>0.05),说明ADH2和THI3基因缺失不影响酵母的基本发酵性能。

表3 重组菌和原始菌XF1的基本发酵性能的比较Table 3 Comparison of basic fermentation performance of recombinant strains and original strain XF1
3 结论
本实验成功构建了ADH2单基因缺失、ADH2与THI3双基因缺失的单倍体酵母菌和双倍体酵母菌。双倍体重组菌株XF1-A、XF1-AT与原始菌XF1的生长性能、发酵性能都相似,但是酿造糯米酒中的高级醇生成量分别降低11.16%、21.39%。因此,本实验构建的重组双倍体酵母菌XF1-AT可显著降低糯米酒中高级醇生成量,具有潜在的工业应用价值。
