牛栏山二锅头发酵过程中有机酸的变化规律
2021-11-10于晓涛刘轩墀郝文军
李 晴,于晓涛,刘轩墀,郝文军,张 帆,柳 旭,王 瑛
(北京顺鑫农业股份有限公司 牛栏山酒厂,北京 101301)
酿好中国白酒,讲好中国白酒的故事,不仅是一个产业的传承,更是一种文化的传承。酒醅一般指在池内正在进行发酵或者已经发酵完成的粮食的混合物,酒醅中的淀粉在微生物、多种酶作用下经过糖酵解形成葡萄糖,最后由葡萄糖发酵成酒精[1],由于酒醅发酵过程中微生物种类、数量、酶活性及各物质间转换的复杂性,也决定了研究其在发酵过程物质代谢的必要性,目前已有报道对浓香型白酒酿造过程中淀粉、还原糖[2]含量变化,酱香型白酒酒醅挥发性物质[3]进行了分析,但对于二锅头发酵过程中物质变化的研究相对较少。
有机酸是酒醅发酵过程中酸味的重要组成部分,与酒体的品质密切相关[4],同时有机酸是形成酯类的重要前提物质[5],对酒体的香气具有重要的贡献[6],目前,木薯酒[7]、葡萄酒[8]、果酒[9]在发酵、加工过程中有机酸的变化已有相关研究,而二锅头在发酵过程中有机酸含量的变化鲜有人报道,因此准确把握牛栏山二锅头在发酵过程中有机酸含量的变化,对优化生产工艺、指导生产至关重要。
本研究主要以牛栏山白酒发酵过程中酒醅为实验材料,通过超高效液相色谱(ultra high performance liquid chromatography,UPLC)和气相色谱(gas chromatography,GC)对酒醅中的有机酸含量进行测定,同时检测酒醅发酵过程中的温度、微生物总数、总酸、pH值等指标变化,为进一步研究牛栏山白酒发酵过程提供了理论依据,为指导生产提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅样品:取自顺鑫农业股份有限公司牛栏山酒厂酿造车间,分别于入池后第1、2、3、5、9、11、13、17、22、28、36、45天进行取样,每次采集3份样品,-80 ℃保存。
1.1.2 试剂
甲醇(色谱纯):美国Fisher公司;超纯水(三级水):Milli-Q净水仪制备;草酸、苹果酸、乳酸、乙酸、柠檬酸、延胡索酸标准品(纯度均>98%),磷酸二氢铵(分析纯):天津市光复精细化工研究所;磷酸(分析纯):北京化工厂。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基:葡萄糖20 g,酵母粉10 g,蛋白胨10 g,去离子水1 000 mL,pH 4.0,115 ℃灭菌30 min。
乳酸菌分离培养基:牛肉膏10 g,酪蛋白胨30 g,酵母提取物5 g,葡萄糖20 g,乙酸钠5 g,吐温-801mL,柠檬酸氢二胺2 g,MgSO4·7H2O 0.58 g,K2HPO42 g,MnSO4·H2O 0.25 g,萘啶酮酸50 mg,琼脂15 g,去离子水1 L,pH 5.0,115 ℃灭菌30 min。
常规丝状真菌分离培养基采用孟加拉红培养基:北京奥博星生物技术有限公司。
1.2 仪器与设备
L95系列智能温度记录仪:上海发泰精密仪器仪表有限公司;BSC-1100ⅡA2型生物安全柜:北京东联哈尔仪器制造有限公司;SPX-320型生化培养箱:宁波江南仪器厂;Waters ACQUITY UPLC超高效液相色谱仪:美国Waters公司;5975C气相色谱:美国安捷伦公司;Milli-Q Reference超纯水发生器:美国Millipore公司;MS204TS/02万分之一分析天平、FE22-Standard pH计:梅特勒-托利多仪器有限公司;GDANA电热板:广州格丹纳仪器有限公司;BSD-YX2400智能精密摇床:上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 酒醅发酵过程中理化指标的测定
温度:利用智能温度记录仪对酒醅[10]、地表以及环境温度进行监测;总酸:利用酸碱中和法对酒醅中的总酸含量进行测定[11];以氢氧化钠消耗量表示酒醅的酸度,定义每克酒醅消耗0.1 mol/L NaOH溶液为1度。pH值:准确称量10 g酒醅加入90 mL无菌水,静置15 min,利用pH计对滤液pH值进行测定。
1.3.2 酒醅发酵过程中微生物数量的测定
样品前处理:分别取不同发酵时间的酒醅,按四分法混合取样后,称量10g混合酒醅于90mL无菌水中,摇床180r/min振荡10 min,制备的菌悬液定为10-1梯度,无菌环境下吸取1 mL于9 mL无菌水中,计为10-2,依次稀释为10-3、10-4、10-5、10-6梯度。
培养条件:使用灭菌枪头吸取上述不同梯度样液0.1mL,涂布至不同分离培养基平板中,3个平行,设置空白对照。根据微生物的不同培养条件进行恒温培养,酵母28 ℃静置培养48 h,常规丝状真菌30 ℃培养24~48 h,乳酸菌35 ℃静置培养24~48 h。
微生物平板计数:根据培养结果挑选菌落数在30~300 CFU/mL的平板进行计数,乘以稀释倍数计算不同微生物的菌落数量。
1.3.3 酒醅发酵过程中乳酸、柠檬酸、苹果酸、草酸及延胡索酸含量的测定
样品前处理:准确量取5 g酒醅,溶于10 mL的提取液中,超声提取20 min,12 000 r/min离心10 min,取上清液过0.22 μm有机滤膜,待上机分析。
UPLC条件:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),二极管阵列检测器(diode-array detector,DAD),柱温35 ℃,样品室温度20 ℃,进样体积10 μL,检测波长210 nm,流动相为0.002 5 mol/L 磷酸二氢铵(NH4H2PO4)溶液,流速0.2 mL/min进行等度洗脱,进样时间10 min。
定性定量方法:配制乳酸、柠檬酸、苹果酸、草酸及延胡索酸的混合标准溶液20 mg/L、40 mg/L、80 mg/L、100 mg/L、120 mg/L,通过标准品保留时间对样品中有机酸进行定性,以UPLC的检测出峰面积(y)为纵坐标,以标品的质量浓度(x)为横坐标,构建标准曲线,按照标准曲线回归方程计算样品中有机酸的含量。
1.3.4 酒醅发酵过程中乙酸含量的测定
样品前处理:准确称量5 g酒醅样品,在60 ℃条件下进行固相微萃取30 min。
GC条件:固相萃取头涂层50/30 μm DVB/CAR/PDMS,DB-Wax色谱柱(50 m×0.25 mm,0.2 μm),进样口温度250 ℃解吸5 min,升温程序:初始温度40 ℃,以3 ℃/min的速度升温至80 ℃,保持3 min后,继续以3 ℃/min的速度升温至190 ℃维持15 min。
定性定量方法:以标准品保留时间进行定性,以乙酸正丁酯为内标物(质量浓度为17.6 g/L)进行半定量。
1.3.5 数据处理
采用Excel 2016、Origin 8.5软件对实验数据进行处理。
2 结果与分析
2.1 酒醅发酵过程中温度的变化情况
发酵过程中的酒醅温度主要与入缸温度、周围环境以及发酵过程中微生物代谢产能等有关[12],酒醅发酵过程中温度的变化见图1。由图1可知,在整个发酵过程中,地温较为稳定,基本维持在21 ℃,环境温度受天气影响较大,存在一定的起伏,最高温度在发酵的第5天,为12.1 ℃,最低温度在发酵的第43天,为-5.3 ℃。酒醅温度受环境影响的同时,在一定程度上反映了酒醅中微生物活跃程度及物质代谢的变化,发酵初期,酒醅中存在大量氧气,酵母菌、丝状真菌等微生物利用酒醅中的氧气进行有氧呼吸,产生大量的能量,促使酒醅中温度逐渐升高,在第9天时温度达到最高点,为29.2 ℃,此时酒醅中的微生物和物质代谢处于最活跃的阶段,9 d以后,酒醅中的氧气逐渐被消耗,微生物开始有氧呼吸和无氧呼吸相结合,酵母菌、细菌等利用葡萄糖进行发酵生成乙醇等物质,这个过程中物质代谢逐渐减缓,能量产生降低,酒醅温度下降并逐渐趋于平稳。
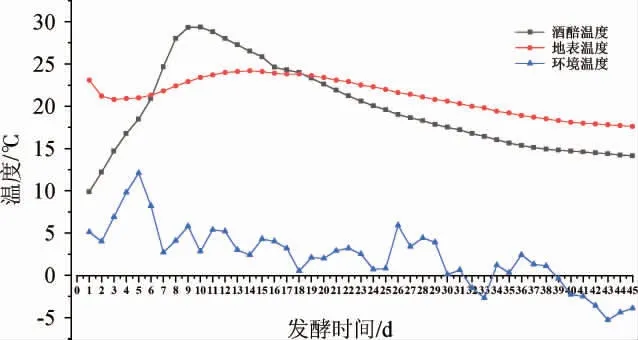
图1 酒醅发酵过程中温度的变化Fig.1 Change of temperature of fermented grains during the fermentation
2.2 酒醅发酵过程中微生物数量的变化情况
发酵过程中微生物复杂的变化与有机酸等代谢物质的产生有着密不可分的联系[13-14],酒醅发酵过程中酵母菌、乳酸菌和丝状真菌数量的变化见图2。由图2可知,发酵初期酵母菌、乳酸菌及丝状真菌均大幅度增加,其中酵母菌、乳酸菌在7~11 d时达到最大值,丝状真菌在第5 d达到最大值。酵母菌是酒醅发酵过程中十分重要的微生物之一,其能够决定乙醇以及一些香气成分的产生[15],由图2A可知,酵母菌在发酵开始的前3 d数量增长较为缓慢,5~9 d呈现急速的增长,在第11天达到最大值为77.7×106CFU/mL,13~17 d呈现大幅度下降,降低约53倍,酵母菌数量变化可能由于发酵初期,淀粉被大量消耗,营养物质丰富,酵母菌生长繁殖旺盛,乙醇逐渐增加,而发酵后期乙醇的大量积累,改变了营养结构,影响了酵母菌的生长繁殖[16]。乳酸菌对于酒体的放香至关重要,其能够直接影响发酵过程中乳酸的形成,乳酸则是呈香物质乳酸乙酯合成的前体物质[17]。由图2B可知,乳酸菌在发酵的3~5 d出现大幅度的增长,于第7天达到最大值247.7×106CFU/mL,7 d后乳酸菌逐渐下降,这一结果与以往的研究相一致[18],其可能原因发酵后期酒醅中高酸环境不利于细菌生长。由图2C可知,丝状真菌与酵母菌和乳酸菌有所不同,发酵初期酒醅中存在大量的丝状真菌,在发酵的第5天时丝状真菌达到了最大值,为20.3×105CFU/mL,发酵5 d以后呈现出逐渐降低的趋势。
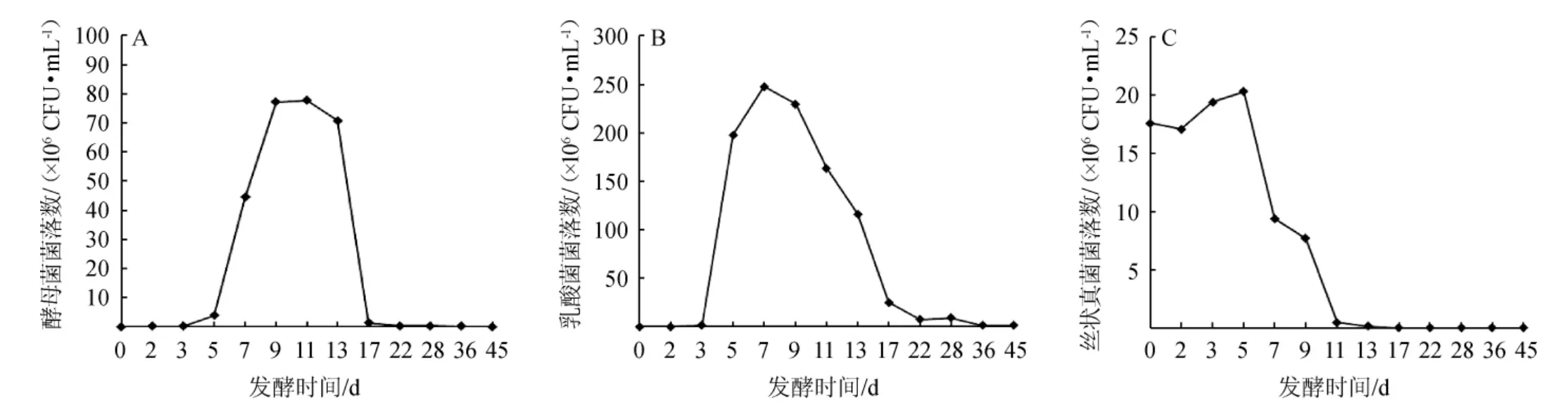
图2 酒醅发酵过程中酵母菌(A)、乳酸菌(B)和丝状真菌(C)数量的变化Fig.2 Number changes of yeasts (A),lactic acid bacteria (B) and filamentous fungi (C) of fermented grains during fermentation process
2.3 有机酸含量的测定
2.3.1 有机酸标准曲线回归方程的建立
乳酸、柠檬酸、苹果酸、草酸及延胡索酸的混合标准溶液UPLC分析色谱图见图3(A),乙酸GC分析色谱图见图3(B),标准曲线回归方程见表1。

表1 5种有机酸线性回归方程及相关系数Table 1 Linear regression equations and correlation coefficients of 5 kinds of organic acids
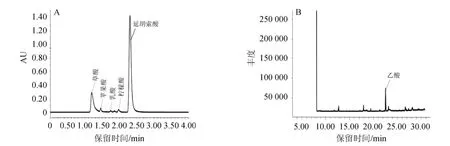
图3 5种有机酸标准品超高效液相色谱图(A)和乙酸气相色谱图(B)Fig.3 Ultra performance liquid chromatography of 5 kinds of organic acids standards (A) and gas chromatography of acetic acid (B)
由图3可以看出,酒醅中的五种有机酸通过超高效液相色谱能够良好的分离,出峰顺序分别为:草酸(1.189 min)、苹果酸(1.456 min)、乳酸(1.745 min)、柠檬酸(1.973 min)、延胡索酸(2.302 min)。
以5种有机酸标品的质量浓度为横坐标,以对应的出峰面积为纵坐标,构建标准曲线,得到5种有机酸的回归方程如表1所示,相关系数R2均>0.99,符合要求,表明超高效液相工作性能稳定,能够对酒醅中的有机酸进行准确的测定。
2.3.2 酒醅发酵过程中有机酸的变化情况
实验利用超高效液相色谱对牛栏山酒醅发酵过程中的乳酸、柠檬酸、苹果酸、草酸及延胡索酸进行测定,同时,由于乙酸的沸点低,强挥发性的特点,对乙酸采用气相色谱进行检测,实验结果见图4。
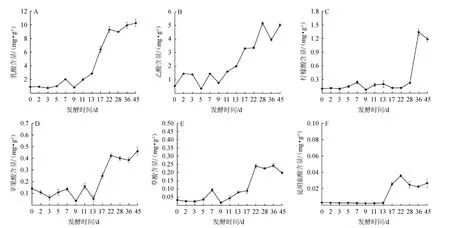
图4 酒醅发酵过程中有机酸含量的变化Fig.4 Change of organic acid contents of fermented grains during fermentation process
由图4可知,在酒醅发酵过程中,乳酸和乙酸的含量较高,最高时可分别达到10.26 mg/g和5.16 mg/g。
白酒发酵过程中乳酸的含量对白酒的生成至关重要[19],由图4A可以看出,酒醅中乳酸的含量在13 d前呈现稳定增长的趋势,在第9天出现一个降低点,含量为0.82 mg/g,13~22 d乳酸的含量呈现出大幅度的增长,增加了6.46 mg/g。乳酸是构成白酒风味的主要物质之一,主要由葡萄糖在乳酸菌和乳酸脱氢酶等作用下经糖酵解产生[20],通过观察发现在发酵初期,乳酸含量(图4A)和乳酸菌数量(图2B)均在不断增加,为乳酸的积累创造了条件。
乙酸对于清香型白酒而言是更为关键的有机酸,是合成清香型白酒主要呈香物质乙酸乙酯的重要前提[21],由图4B可知,发酵开始前13 d,乙酸呈现出一定的波动,13 d以后乙酸的含量逐渐增加,在第28天时含量达到最大值为5.16 mg/L,发酵后期大量乙醇的产生促进了乙酸的积累。
柠檬酸是人体细胞代谢必不可少的酸,能够促进乳酸的分解,帮助缓解人体疲劳[22],由图4C可知,柠檬酸的含量在28 d前呈现出较为稳定的状态,而第9天出现一定的降低,含量降为0.07 mg/g,发酵28 d后,柠檬酸出现了大幅度的增加,达到0.025 mg/g。柠檬酸属于不挥发性酸,其含量的增加能够增强酒体的醇厚感,并与其他呈香呈味物质共同作用,从而能在一定程度上提高白酒的品质。
微生物代谢能够产生大量的有机酸类物质,适量的有机酸积累能够使酒体更加丰满协调,苹果酸虽然酸度较大,但却拥有柔和的风味,能够与其他有机酸共同作用在一定程度上影响酒体的风味品质,由图4D可知,在酒醅发酵过程,苹果酸在13 d前处于一种动态的平衡,含量在0.04~0.16 mg/g之间,作为三羧酸循环、苹果酸-乳酸发酵过程等多种物质代谢途径过程的中间枢纽,苹果酸不仅在代谢中产生,同时也不断被微生物等消耗[23],在13~22 d发酵过程中,苹果酸的含量急速增加,在第22天达到0.42 mg/g,同时观察苹果酸在28 d后的含量,发现其仍有上升的趋势。
草酸是一种常见的二元酸,能够参与调节Ca+、pH及渗透压等生理学过程[24]。由图4E可知,草酸的含量在前7 d呈现出上升的趋势,在7~9 d有所降低,9 d以后开始不断增加,到22 d含量达到一个最高值,为0.24 mg/g,草酸含量在28 d以后呈现下降的趋势,避免了草酸的大量积累。
由图4F可知,延胡索酸在前13 d均未被检出,可能原因是延胡索酸在前13 d其产生量与其消耗量一致,延胡索酸在含量上保持动态的守恒,13~22 d延胡索酸的含量持续上升,增加了0.032 mg/g,22 d后延胡索酸的含量有所降低且随着发酵的进行基本保持稳定。
从实验结果可以看出,乳酸、乙酸、柠檬酸、苹果酸、草酸随着酒醅发酵的进行呈现出逐步增长的趋势,且在第9天左右均出现一个低点,这一结果与曹云刚等[25]报道相一致,分析其可能原因在第9天时微生物的种类、数量处于一个高点(图2),微生物代谢活动旺盛,酒醅温度升高,酶活性增强,致使有机酸的消耗过大,导致其含量出现一定的波动,而延胡索酸则在发酵开始的13 d以后呈现出增长的趋势,并且延长发酵时间(常规发酵时间28 d)在整体上会增加有机酸的积累。
2.4 酒醅在发酵过程中总酸和pH的变化情况
总酸是一个定数,本实验指酒醅样品最终能释放出的氢离子数量;pH与H+的平衡相关,本实验中指酒醅溶液中释放氢离子(或氢氧根)的能力[26],总酸和pH均能够对酒醅中微生物的代谢产生影响,进而影响有机酸的形成。酒醅发酵过程中总酸含量及pH值变化分别见图5和图6。
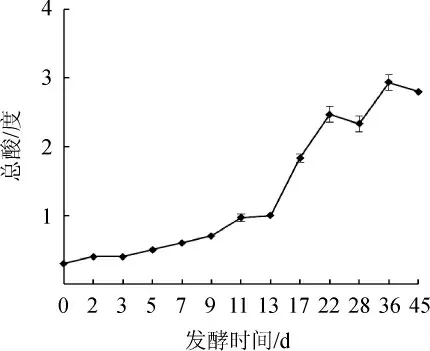
图5 酒醅发酵过程中总酸含量的变化Fig.5 Change of total acid contents of fermented grains during fermentation process
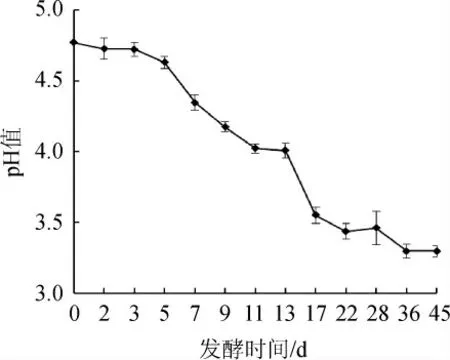
图6 酒醅发酵过程中pH值的变化Fig.6 Change of pH of fermented grains during fermentation process
由图5可知,总酸的含量随着发酵的延长逐渐递增,0~7 d总酸的增长速度较为缓慢,酒醅入缸时的总酸度为0.3度,经过36 d的发酵,总酸含量达到2.8度,同时通过对比有机酸的实验结果,发现总酸的递增规律与乳酸的递增规律大致相同,且乳酸为发酵过程中重要的有机酸之一。
由图6可知,酒醅的pH随着发酵时间进行逐渐的下降,由酒醅开始入池的pH4.77降低到3.28,pH的结果与总酸的含量呈现出负相关性,说明酒醅中的总酸含量在一定程度上能够影响酒醅的pH的大小。
3 结论
牛栏山二锅头发酵过程中酒醅的温度在第9天出现最高点,达到29.2 ℃;酵母菌、乳酸菌及丝状真菌均是先增加后降低,在7~11 d时左右其微生物的数量达到最大,与发酵过程中酒醅温度的变化呈现出相关性;总酸度随着发酵的进行而不断升高,最后达到2.8度;pH随着发酵的进行而不断降低,最后下降到3.33。
通过超高效液相和气相色谱测定牛栏山二锅头发酵过程中乳酸、乙酸、草酸、柠檬酸、苹果酸、延胡索酸的含量,其中,大多数有机酸在第9天存在低点,9~28 d呈上升的趋势,随后保持缓慢增长,同时发现有机酸含量变化与乳酸菌变化呈显著正相关,实验的展开为提升牛栏山二锅头白酒品质提供了理论依据,今后可探究在传统牛栏山二锅头发酵周期28 d的基础上适当延长发酵时间,以提高有机酸含量,生产一些高品质的调味酒。
