基于测序基因分型技术的3种石斛兰遗传关系分析
2021-11-10王趁芳黄守程周玉丽王晓鹏刘爱荣侯北伟叶梅荣
王趁芳,黄守程,周玉丽,王晓鹏,刘爱荣,侯北伟,叶梅荣*
(1.安徽科技学院,安徽凤阳233100;2.南京野生植物综合利用研究所,江苏南京211100)
测序基因分型技术(Genotyping by sequencing,GBS)是基于二代测序技术的简化基因组测序,可以检测大量单核苷酸(Single nucleotide polymor⁃phisms,SNP)变异位点,并且成本低[1]。SNP为第三代分子标记、具有密度高、分布范围广、遗传稳定、分型简单、可自动化等优点[2],SNP多态性是指由于单个核苷酸变异所引起的基因组上DNA序列的多态性[3]。目前GBS-SNP标记已广泛用于动植物群体的进化、育种、亲缘关系、遗传结构、物种鉴定等研究[4]。如周萍萍等[5]利用该标记研究栽培六倍体燕麦(Avena sativaL.)的起源;Talaveraet al.[6]应用该标记研究牛油果(Persea americanaMill.)的遗传多样性和群体结构。
霍山石斛(Dendrobium huoshanenseC.Z.Tang and S.J.Cheng)、铁皮石斛(Dendrobium officinaleKimura et Migo)和 细 茎 石 斛(Dendrobium monili⁃forme(L.)Sw.)均为兰科(Orchidaceae)石斛属(Den⁃drobiumSw.)多年生附生草本植物,是我国传统名贵的药用植物[7]。霍山石斛俗称米斛、霍石斛等,仅分布在我国大别山区,如湖北英山、河南南召、安徽霍山等地区[7];而铁皮石斛和细茎石斛分布范围广泛,从我国云南最南部的热带到北部的河南省均有分布[8-9]。霍山石斛的茎杆加工成的枫斗被称为“金霍斗”,为“枫斗之王”;而铁皮石斛和细茎石斛的茎杆被加工成著名的中药“铁皮枫斗”和“铜皮枫斗”[10-11]。中国约有40多种石斛作为传统的中药药材,具有重要的药用和保健功能,据《神农本草经》记载“石斛,一名林兰。味甘,平,无毒。主伤中,除痹,下气,补五藏虚劳赢瘦,强阴。久服厚肠胃,轻身延年”[12]。现代药理研究表明,石斛具有养胃润肺、清音明目、增强免疫力、抗氧化、抗肿瘤、降血糖、防衰老和延年益寿等功效[13]。因此石斛枫斗被当作高档保健饮品,价格昂贵,市场需求极大。虽然有近40多种石斛被作为药用植物,而历代本草及现在被公认的优质“石斛”应该指“铁皮石斛”与“霍山石斛”[14]。目前关于霍山石斛、铁皮石斛与细茎石斛的遗传关系及其鉴别的研究报道已有不少,如罗宇琴等[15]从含量测定、指纹图谱、药理作用等方面分析霍山石斛和铁皮石斛的异同。这3种石斛的遗传关系一直是石斛研究者感兴趣的问题,因此该文基于GBS标记的SNP位点研究3种石斛的遗传关系,为进一步促进3种石斛的研究提供参考。
1 材料和方法
1.1 试验材料
该研究于2019年9月在安徽霍山地区只收集到栽培3年以上的霍山石斛样本8份和栽培铁皮石斛样本7份。因霍山石斛、铁皮石斛及细茎石斛的野生样本稀缺,所以未能收集到霍山石斛和铁皮石斛的野生样本。而细茎石斛除收集到霍山地区栽培的3份样本外,又收集到2份广西伟江的野生样本。所有石斛样本均由王晓鹏教授鉴定并保存在安徽科技学院里。将样本的新鲜叶片收集于密封袋,然后迅速投入液氮里速冻,取出密封袋埋藏于干冰里,运送到菲莎基因有限公司进行DNA提取和GBS分析。
1.2 DNA提取、文库构建和GBS分析
用改良的十六烷基三甲基溴化铵法(Cetyltri⁃methylammonium bromide,CTAB)提取样本的DNA,利用琼脂糖凝胶电泳检测样品DNA的完整性及DNA片段长度,DNA纯度用Nanodrop微量分光光度计检测,DNA的浓度用Qubit 3.0精确定量,只有单个样本的DNA浓度≧10μg才能用于文库构建;将检测合格的DNA样品用Covaris超声波破碎仪随机打断,用Msel酶降解,末端修复后加A尾和测序接头、纯化、聚合酶链式反应(Polymerase chain reaction,PCR)扩增等步骤完成构建整个文库,用Illumina测序仪PE150对构建好的文库进行测序。
1.3 序列处理和比对到参考基因组
测序平台获得的原始图像数据文件用碱基识别分析转化为原始测序序列即Raw data[所有Raw data数据已上传美国国家生物技术信息中心(Na⁃tional center for biotechnology information,NCBI),登录号为PRJNA659117],用Trimmomatic Version 0.38软件对Raw data过滤,去除含有接头、两端连续质量小于20碱基对(base pair,bp)及碱基长度小于50 bp的测序片段,成对的测序片段被保留,即最后获得干净的测序片段称为clean data或clean reads。用Burrows-wheeler alignment tool(BWA)[16-17]将clean data比对到黄石斛(Dendrobium catenatumLindl.)[18]参考基因组上。
1.4 变异检测
Clean data的SNP数目用The genome analysis toolkit(GATK)[19]软件进行检测和过滤,Minor allele frequency(MAF)<0.01和20%样本没有的SNP被去除掉,得到的SNP可用作遗传结构等分析。
1.5 居群的遗传结构特征和遗传距离分析
居群遗传结构用Admixture软件[20]进行分析,交叉验证误差最小的值为最适的K值,邻接树(Neigh⁃bor-joining tree,NJtree)用TreeBeST[21]构建,为探讨3种石斛的遗传结构关系用Genome-wide complex trait analysis(GCTA)[22]软件进行主成分分析。用GenAlEx软件计算3种石斛的遗传距离。
2 结果与分析
2.1 数据过滤和比对到参考基因组
霍山石斛、细茎石斛和铁皮石斛平均每个样本产生的clean reads是霍山石斛>细茎石斛>铁皮石斛,分别为1 535 753、1 380 009和1 208 693个。平均每个样本产生的clean bases也是霍山石斛>细茎石斛>铁皮石斛的,分别为436 387 047 bp、391 592 914 bp和344 268 426 bp。3种石斛比对到黄石斛参考基因组的reads数占比最高的是铁皮石斛,为99.06%,霍山石斛和细茎石斛相差不明显,分别为97.00%和96.98%;测序长度符合一定阈值且双端的reads都比对上参考基因组的reads数占比最高的也是铁皮石斛,为91.35%,霍山石斛、细茎石斛之间差异不明显,分别为79.79%和80.08%(表1)。

表1 每样本产生干净片段的数目和平均比对到参考基因组的比例Table 1 Summary of clean reads per specimen detected by GBSand percentage of alignment to reference genome sequence
2.2 SNP的变异检测数目
霍山石斛、细茎石斛和铁皮石斛的平均每个样本产生的SNP数目霍山石斛>细茎石斛>铁皮石斛,分别为1 509 648、1 364 605和903 183个。其转换和颠换的SNP数目也是霍山石斛>细茎石斛>铁皮石斛,分别为899 064和6 108 125,810 614和551 968,552 704和347 449个,铁皮石斛的转换和颠换的比例是1.59,其余的都是1.47。霍山石斛、细茎石斛和铁皮石斛平均每个样本产生的杂合和纯合SNP数分别为204 940和1 304 709,168 830和1 195 774,216 436和686 747个,杂合SNP数占总SNP比最高的是铁皮石斛为0.24,霍山石斛和细茎石斛差异不明显分别为0.14和0.12(表2)。

表2 GBS检测获得的每个样本SNP数目Table 2 Summary of average SNPs per specimen detected by GBS
2.3 群体结构和遗传距离分析
Clean reads过滤后得到用于群体结构分析的总SNP数为187 143个,其中霍山石斛、细茎石斛和铁皮石斛分别有120 734、97 441和73 787个。根据Tree BeST软件计算遗传距离阵,然后用邻接法构建系统NJ进化树(图1),从图1中看出明显分为2大支,铁皮石斛聚为一支,细茎石斛和霍山石斛聚为另一支,细茎石斛和霍山石斛又被严格分为2支。根据Admixture软件分析的遗传结构(图2A和图2B)显示:最佳的K值是2,铁皮石斛聚为一支,霍山石斛和细茎石斛聚在一起,暗示其遗传关系更接近;当K=3时,分为3支,3种石斛被严格分开与NJ树相似。主成分分析(Principal component anal⁃ysis,PCoA)与Structure和NJ树分析类似(见图3),也是3种石斛被严格分开,总的遗传变异是38.21%,而PC1和PC2分别为26.99%和11.22%。遗传距离分析发现:霍山石斛与铁皮石斛间的遗传距离最大为0.3052,其次是细茎石斛与铁皮石斛间的为0.2792,最低为霍山石斛与细茎石斛间的为0.2141。
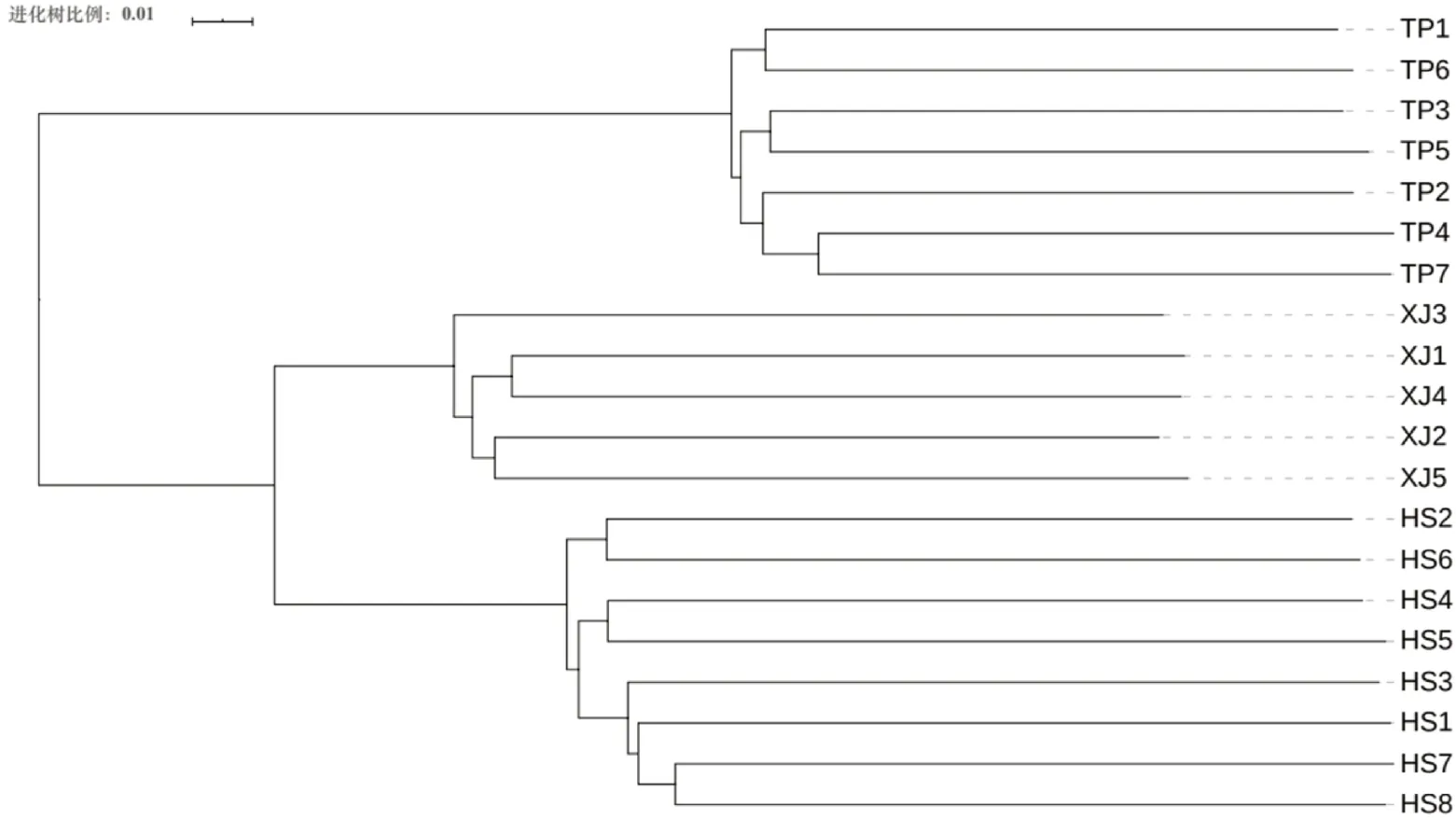
图1 基于20个石斛植物样本的187 143 SNPs-GBS的遗传距离矩阵构建邻接树Fig.1 NJ tree based on pairwise distance matrix representing the grouping of the 20 Dendrobium specimens obtained from 187 143 SNPs-GBS

图2A 根据Admixture软件构建的20个石斛样本的遗传结构图Fig.2A Genetic structure of 20 Dendrobium specimens for K=2-8 based on the Admixture software

图2B 交叉验证误差和K值Fig.2B Cross-validation error and K value

图3 根据样本间匹配相似性构建的主成分图(PCoA)Fig.3 Principal coordinates analysis(PCoA)of pairwise sim⁃ple matching dissimilarities between specimens
3 讨论
霍山石斛、铁皮石斛与细茎石斛都是我国传统的名贵药用植物,而关于三种石斛的遗传关系一直是石斛研究者感兴趣的问题。如邓辉等[23]、刘明珍等[24]分别用重复序列聚合酶链式反应(Inter-simple sequence repeat,ISSR)技术证明了霍山石斛与相似种铁皮石斛、细茎石斛等存在较大的、稳定的差异,认为霍山石斛不属于铁皮石斛,应为一独立的种;樊洪泓等[25]根据随机扩增多态性DNA(Random am⁃plified polymorphic DNA,RAPD)分子标记研究认为霍山石斛与细茎石斛亲缘关系更近,而与铁皮石斛的亲缘关系相对较远;而其根据相关序列扩增多态性(Sequence-related amplified polymorphism,SRAP)标记研究认为铁皮石斛与霍山石斛也具有较近的亲缘关系。陆安静等[26]通过内转录间隔序列(Inter⁃nal transcribed spacer,ITS)分析比较认为细茎石斛与铁皮石斛的亲缘关系较近;李国良等[27]通过ITS、Nad intron2和psbA-trnH系列分析发现,霍山石斛与铁皮石斛在这些序列上具有明显的碱基差异,而与细茎石斛差异不明显,霍山石斛和铁皮石斛之间的遗传距离大于其和细茎石斛之间的遗传距离。这些研究结果与该文研究结果类似,即这三种石斛的遗传亲缘关系都比较近,而霍山石斛与细茎石斛的遗传关系比霍山石斛与铁皮石斛的遗传关系更近。
探讨不同种石斛的遗传关系,一般野生样本更具有说服力,人工栽培因人为的选择可能会造成遗传多样性的丢失或者遗传背景的复杂,如Hou[28]利用三核苷酸微卫星(Trinucleotide microsatellite)标记分析发现异位收藏保护的铁皮石斛和其野生居群相比基因多样性并没有显著的差异,但Structure分析揭示了其在遗传组成上具有明显的差异;张君毅等[29]采用目标区域扩增多态性(Target region ampli⁃fication polymorphism,TRAP)和特异序列扩增区域(Sequence-characterized amplified region,SCAR)标记研究得出铁皮石斛野生类群遗传多样性水平最高,而仿野生类群和栽培类群基本一致;而魏丹红和徐红[30]用ISSR标记研究认为金钗石斛栽培居群的遗传多样性和野生相比基本上没有丧失;吴永辉等[31]利用保守DNA衍生多态性(Conserved DNA-de⁃rived polymorphism,CDDP)分子标记研究表明铁皮石斛人工栽培种具有丰富的遗传多样性;该研究因资金的有限和石斛野生资源的稀缺未能完成野生和栽培石斛遗传关系的比较研究,而所选的细茎石斛栽培和野生样本量太少,无法准确判断两者差异,希望未来的研究能比较野生样本和栽培样本的遗传差异。
总之,根据GBS-SNP标记分析发现霍山石斛与铁皮石斛遗传关系较远,而其和细茎石斛遗传关系较近;遗传结构、NJ树及主成分分析结果类似,3种石斛被明显分开,证明GBS-SNP分子标记可用于该3种石斛的鉴定研究。
