低强度激光与骨微穿孔术对大鼠正畸牙移动的影响
2021-11-10管晓燕廖成成肖琳琳赵玉洁刘建国
管晓燕,马 锐,王 倩,廖成成,肖琳琳,赵玉洁,刘建国
(1.遵义医科大学附属口腔医院 正畸科,贵州 遵义 563099;2.贵州省普通高等学校口腔疾病研究特色重点实验室暨遵义市口腔疾病研究重点实验室,贵州 遵义 563006)
低强度激光能产生特殊的生物刺激作用,激活细胞,促进牙槽骨改建[1]。骨微穿孔术通过骨创伤,可引起周围骨质快速脱矿,骨改建加速[2]。低强度激光与骨微穿孔术是目前加速正畸治疗领域的两大研究热点,在对于临床正畸治疗的辅助加速具有极大潜力。本实验拟验证低强度激光与骨微穿孔术促进正畸牙移动的有效性,探讨二者协同作用在疗效和组织学水平的影响,奠定其进一步临床应用的基础。
1 材料与方法
1.1 实验动物及分组 动物实验在遵义医科大学实验动物中心开展。Sprague-Dawley(SD)大鼠60只(6周龄,雄性,150~200 g),适应性喂养1周后随机分组(n=15)。分组情况如下:激光照射合并加力组(LLL)、骨微穿孔术合并加力组(MOPs)、骨微穿孔术联合激光照射合并加力组(联合)以及对照组。对照组单独给予加力;LLL组应用加力合并激光照射(100 mW功率, 50 s照射时间,0.5 cm2光斑面积);MOPs组应用加力合并骨微穿孔术;联合组采取加力、激光照射(参数同LLL组)、骨微穿孔术3种干预措施联合使用。各干预组及对照组分别在实施1、3、5、7、14 d时进行组织切片取样及测定牙移动距离。
1.2 材料 镍钛拉簧(0.010 in×6 mm,速航NIC,中国);美佳印弹性体印膜材料(0型、3型,沪鸽,中国);正畸测力计(天天齿科,中国);正畸支抗套装(1.2 mm×8 mm,HUBIT,韩国);半导体激光治疗仪(300IB型,三顿,中国);立体显微镜(M205C,德国 Leica),Leica Application Suite V 4测量软件。
1.3 动物模型的建立 腹腔注射麻醉(水合氯醛,10%)实验动物,麻醉后采取二次印模法以动物上颌牙齿为模板制备硅橡胶印模(见图1A)并制作石膏模型。采用光固化树脂在上颌切牙唇、舌、远中面分层堆出上宽下窄倒梯形,随后沿唇侧、远中唇轴角接近龈缘处磨出上颌切牙固位沟(深度约0.5 mm)。操作者直视下采用正畸结扎丝(直径0.20 mm)穿过上颌第一和第二磨牙间隙。结扎丝连接镍钛拉簧,拉簧另一端穿入结扎丝(0.25 mm),越过切牙树脂结扎于固位沟内,采用正畸测力计控制拉簧力量(50 g),见图1B。
采用激光探头直接接触照射大鼠上颌第一磨牙(见图1C),于造模第0~6天连续照射,每日1次。在距离双侧上颌第一磨牙近中5 mm处,采用正畸微种植钉在皮质骨上钻取3个骨微穿孔(深度1.0 mm,间距1.0 mm),见图1D。

A:安装正畸加力装置前先取上颌印模;B:建立上颌双侧第一磨牙加力装置;C:骨微穿孔部位;D:激光照射部位。图1 大鼠正畸模型建立过程
1.4 监测正畸牙移动的距离 建模结束后处死大鼠,制备上牙列印模,注入超硬石膏备用。于体视显微镜下,水平放置石膏模型并保持牙齿咬合面与观测台平行,采用本文方法所述测量软件(精度0.000 1 mm)测量上颌第一与第二磨牙咬合面中央牙尖远中边缘嵴之间的距离,连续测量3次取平均值(见图2)。计算建模前后测量数据差值作为牙移动距离。上述方法参照文献报道[3]方法实施。

A:建模前测量;B:建模后测量;×20。图2 正畸牙齿移动距离的测量
1.5 组织切片制备 剔除双侧上颌骨软组织后,置于4%多聚甲醛固定液中48 h,固定完成后于10% EDTA脱钙溶液(隔日更新溶液)中室温脱钙4周,针尖可无阻力刺穿组织作为脱钙完成标准。脱钙标本由专业病理人员进行石蜡包埋并行2 μm切片。切片置于温水(56 ℃)中展平并贴片于载玻片,分别采用苏木精-伊红染色法 (Hematoxylin-eosin staining,HE )和抗酒石酸性磷法(Tartrate-resistant acid phosphatase staining,TRAP)染色。

2 结果
2.1 各类干预方法 对牙移动距离的影响在加载正畸力后的第1、3、5、7、14天制取正畸术后模型,测量各组实验动物术前、术后石膏模型,发现各组大鼠牙移动距离变化的总趋势是随加力时间延长而加大。以牙移动距离为监测指标,施加正畸力3 d内,各组动物牙移动量差距无统计学意义(P>0.05)。至第5天,联合组动物牙移动距离相对于对照组显著加大(P<0.05)。至第7天,联合组与对照组间的差异进一步增大(P<0.01)。至第14天,各干预组牙移动量均较对照组明显增加,统计显著性水平分别为:LLL组(P<0.05)、MOPs组(P<0.01),联合组(P<0.001)。其中,联合组牙移动距离显著高于LLL组(P<0.05)。联合组与MOPs组间牙移动距离差异无统计学意义(见图3)。

*、**、***:分别与对照组相比,P<0.05、P<0.01和P<0.001。图3 不同干预方法下牙移动距离对比
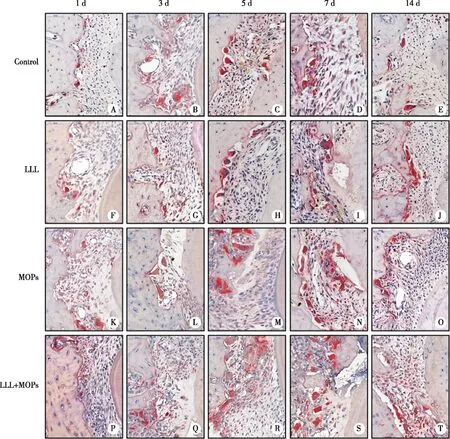
2.2 HE染色观测组织学变化 HE染色结果显示,至第1天,各干预措施对牙周组织均无明显改变,在压力测和张力侧观测到的其他主要改变包括:在压力侧,牙周组织血管受压导致血流量减少,牙周膜间隙受挤压变窄;张力侧牙周间隙增宽、胶原纤维沿正畸力牵引方向拉伸变长。1~3 d内,各组动物牙周组织变化趋势相似,但在不同干预措施间变化程度不同。至第3天,联合组压力侧牙槽骨表面出现骨吸收现象,主要表现为蚕蚀状吸收陷窝。至第5天,骨吸收现象在各组中均有表现。至第7天,各干预组牙槽骨表现出不同程度吸收现象,压力侧牙周膜间隙宽度有恢复迹象,可能是由于骨组织被吸收后被纤维结缔组织所取代所致;张力侧成纤维细胞增殖活跃,少量成骨细胞在牙槽骨表面散在排列。至第14天,对照组破骨细胞减少水平较为明显,骨吸收变得缓慢;破骨细胞在各干预组压力侧牙周组织中的数量仍然较多,骨吸收活动保持活跃;薄层类骨质在各干预组张力侧牙槽骨表面出现,且观察到立方形的成骨细胞紧贴于类骨质边缘的牙周膜中(见图4、5)。
2.3 TRAP染色观测组织学变化 染色结果显示,在压力侧牙槽骨表面骨吸收陷窝中,单核或多核破骨细胞胞浆和细胞核分别呈酒红色和蓝色。在观察周期内(0~14 d),破骨细胞数量在各组均出现先增长后减少的趋势。至第5天,对照组中破骨细胞数量出现最高值,但迅速出现降低,至第14天,对照组中破骨细胞数量降低至初期水平;各干预组破骨细胞数量也在第5天达到最峰值,达峰并保持至第7天后出现降低趋势,但至第14天时依然有较多破骨细胞被观察到(见表1、图6)。

AB:牙槽骨;PDL:牙周膜;TR:牙根;HE染色(×400)。图4 压力侧牙周组织

TR:牙根;PDL:牙周膜;AB:牙槽骨;HE染色(×400)。图5 张力侧牙周组织
对各组破骨细胞数量进行统计学分析后发现(见表1),观察至第3天,破骨细胞数量的变化仍然没有统计学差异(P>0.05)。至第5天和第14天时,联合组破骨细胞技术相对于对照组出现显著增加(P<0.05,P<0.01)。在第7天以及14 d时,破骨细胞数量在LLL组及MOPs组内均表现出较对照组显著增多的现象(P<0.05)。

表1 各干预组大鼠在不同时间内破骨细胞计数结果个/视野)
AB:牙槽骨;PDL:牙周膜;TR:牙根;TRAP染色(×400)。图6 压力侧破骨细胞
3 讨论
正畸治疗是一个需要耗时1~2年的漫长治疗过程[4-5]。在这一治疗过程中,有可能出现龋齿[6]、牙龈萎缩[7]和牙根吸收[8]等不良反应。正畸治疗中需要长期佩戴矫治器,这也会给患者正常的社交生活带来一定的困扰。因此,加速牙齿移动从而快速结束治疗成为正畸治疗的主要挑战。目前取得的进展主要分为药物治疗、物理治疗、外科治疗等。药物治疗除一些临床常用药物[9](卡马西平、丙戊酸钠)外,还包括激素[10-11]、中草药[12]、生长因子[13-14]等。物理治疗包括电磁场、微电流、机械振动、低强度激光等[15];外科治疗主要包括超声骨刀切开术、骨皮质切开术等,还有近几年发展的效率高且创伤小的骨微穿孔术[16-18]。
LLL(Low-level laser)是低强度激光技术的简称。具有安全、无创伤等特点,具有较强的患者依从性。LLL在将光能作用于生物体的同时,不会造成损伤,却足够激活细胞,引起机体产生相应的生物学应答,最终促进毛发的生长及加速伤口愈合、溃疡愈合。在骨折快速愈合方面,LLL还从刺激骨痂内血管新生,促进成纤维细胞、软骨细胞增殖等方面产生作用[1]。LLL于2000年开始应用于大鼠正畸治疗研究[19],在促进牙槽骨的改建和加速正畸牙齿的移动两方面都显示出优势。随后的临床研究发现该技术可以使尖牙移动速度提高34%[20]。传统方法不能避免创伤以及侵袭性问题,会给患者的健康骨组织和牙周结构造成一定伤害,从而导致患者接受度较低。随着加速正畸牙移动速度的辅助方法不断改进,微创趋势越来越明显[21-22]。2013年,经过改良的外科手术微创术式骨微穿孔术(Micro-osteoperforations,MOPs)被Alikhani等[2]提出。该术式避免了对软组织进行翻瓣或造成附加伤口,而采用选择性以点存在的形式穿透骨皮质,产生的骨穿孔小而浅,从而最低限度减轻骨创伤并减少进一步的炎症反应[23]。骨创伤发生后,刺激炎症因子和趋化因子释放,周围骨质快速脱矿,骨密度减小,骨改建加快,这一现象被称为局部加速现象[24](Regional acceleratory phenomenon,RAP),被认为是MOPs加速正畸牙移动的基础理论。
本实验大鼠正畸模型上,研究了联合应用低强度激光与骨微穿孔技术对正畸牙齿移动的影响及组织学改变。
Altan[25]和Seifi[26]的研究结果表明在考虑激光照射剂量对于正畸牙移动的影响时,除考虑激光总能量值外,还应该考虑照射光斑面积大小。因此,本研究预实验采用LLL激光能量密度参数确定照射剂量:固定了LLL激光功率为100 mW、光斑面积0.5 cm2,通过调整照射时长来控制照射剂量,设定5个组,照射时长分别为10、25、50、75、100 s,对应能量密度分别是2、5、10、15、20 J/cm2。结果表明,10 J/cm2的LLL照射引起的正畸牙移动值最大。因此选定该激光照射剂量用于本实验的LLL组和联合组。
在前3 d观察期内,牙移动距离参数上无明显变化;在第5天和第7天时,联合组大鼠牙齿移动与对照组相比改变明显(P<0.05);至第14天,两组差距进一步加大(P<0.001)。在单一干预因素上,低强度激光组与骨微穿孔组也发生牙移动距离相对于对照组的显著增加(P<0.05、P<0.01)。本研究证实了单独应用低强度激光或者骨微穿孔均可加快正畸牙齿移动,且二者有协同作用,更快地加速正畸牙移动。
在组织学研究上,矫治力的加载在加力初期会导致牙周组织改变,牙周膜间隙受力压缩导致牙齿移动,此时应用的低强度激光和骨微穿孔等刺激方法还没有足够时间产生效果,这与Yamaguchi[27]和Sugimori[28]等学者的报道吻合。至第3天后,联合组和各干预组牙周组织开始出现变化,压力侧牙槽骨表面开始出现蚕蚀状吸收陷窝,TRAP染色显示陷窝内多核破骨细胞紧贴骨组织边缘。至第5天,各组破骨细胞数目均达高峰,其中联合组开始出现与对照组的显著差异(P<0.05),证明了联合运用低强度激光和骨微穿孔可在早期协同刺激破骨细胞增殖。至第7天,及第14天,各干预组依然维持着一定数量的破骨细胞,骨吸收活动继续活跃的,对照组骨吸收活动及破骨细胞数量在第14天时都降至实验初期的水平。牙槽骨改建是正畸牙移动的分子基础,破骨细胞在吸收骨基质的有机物和矿质中产生骨吸收凹陷,骨吸收速度决定了牙移动的速度[29];推测低强度激光和骨微穿孔可能通过刺激破骨细胞形成维持较高水平破骨细胞数量,组中加快骨改建和加速正畸牙齿移动。还有研究表明,当骨皮质穿刺术与低强度激光联用时,由于LLL的协同效应,甚至减少了骨皮质穿刺的点数,也能达到相同的骨反应[30]。
综上,低强度激光和骨微穿孔均可有效加速大鼠正畸牙移动,且具备协同作用,提升破骨细胞的形成速度和数量,显著增大牙移动距离。因此,将无创的低强度激光与微创的骨微穿孔联合使用,有望成为临床正畸治疗术的潜在新方法。
