氟硼二吡咯光敏剂的合成及其抗肿瘤活性研究
2021-11-10栾天骄曹亚萍王萌萌袁泽利
栾天骄,曹亚萍,王萌萌,袁泽利
(遵义医科大学 药学院,贵州 遵义 563099)
光动力治疗(Photodynamic therapy,PDT)是基于光化学反应的一种新型治疗技术,已经被批准应用于临床中皮肤、腔体等癌症的治疗,具有创伤小、可重复治疗、毒副作用小、疗效确切及与其他治疗方案联用产生联合或协同效应等诸多优势[1-2],是当前肿瘤治疗研究的热门课题之一[3-6]。PDT主要包括光敏剂、氧气及光三要素,其中光敏剂是该疗法的核心要素。因此,探寻光学性能优良、组成单一、毒性低(暗毒性弱而光毒性强)以及治疗窗口宽的光敏剂是PDT取得突破的关键[5-8]。
在众多的光敏剂探寻中,氮杂氟硼二吡咯分子(Aza-BODIPY,BOD)因具有合成简单、光学性能优良、产生单线态氧的能力强等优势而受到研究者们极大关注[9-10],当前在2和6位进行重原子取代效应的光敏剂研究取得了可喜的研究进展[11-12]。为进一步丰富氮杂氟硼二吡咯光敏剂,本文将2和6位用非重原子取代,在meso位用苯甲醇取代制备了一个氮杂氟硼二吡咯先导化合物(BOD-OH),并通过分子、细胞和活体三个层面考察其光物理性质、体内外的光动力抗肿瘤活性。合成路线如图1所示:

图1 BOD-OH的合成路线
1 材料与方法
1.1 药品与试剂 1,3-二苯基异苯并呋喃(1,3-Diphenylisobenzofuran,DBPF),对羟甲基苯甲醛,三氟化硼乙醚,2,4-二甲基-3-乙基-1H-吡咯,三氟乙酸(trifluoroacetic acid,TFA),2,3-二氯-5,6-二氰基-1,4-苯醌(2,3-dicyano-5,6-dichlorobenzoquinone,DDQ),罗丹明6G,二氢卟吩(Chlorin e6 ,Ce6)及苯丁酸氮芥等均为分析纯,购自萨恩化学技术(上海)有限公司或百灵威试剂有限公司。其余试剂未作特殊说明均为分析纯。
1.2 仪器 Varian 1000 FT-IR红外光谱仪(美国瓦里安公司);安捷伦400 MHz-DD2磁共振仪(美国安捷伦公司);CKX41倒置显微镜(日本Olympus公司);CM1950冷冻切片机(德国Leica公司);全波长扫描式多功能读数仪(美国Thermo 公司);TU-1901紫外-可见吸收光谱仪(北京普析公司);Carry Eclipse荧光分光光度计(美国瓦里安公司)。
1.3 方法
1.3.1 目标光敏剂(BOD-OH)的合成 将0.244 g(2 mmol)对羟甲基苯甲醛溶解于100 mL二氯甲烷中,通入氩气15 min后,继续加入0.492 g(4 mmol)2,4-二甲基-3-乙基-1H-吡咯,随后往反应液中滴入1-2 滴TFA,于室温下搅拌12 h后,再加入0.908 g(4 mmol)的DDQ,继续搅拌4 h,往反应液中再加入1.01 g(10 mmol)三乙胺后继续搅拌15 min。将反应液置于冰浴下,缓慢滴加2.12 g(15 mmol)三氟化硼乙醚,滴毕,于室温下继续搅拌过夜。用二氯甲烷(100 mL×3)萃取反应液,合并有机相并用无水硫酸钠干燥后,用二氯甲烷/石油醚(v∶v=1∶7)作洗脱剂过硅胶柱,得橙红色粉末。
1.3.2 光物理性质测定 以甲醇-水(v∶v=1∶1)为溶剂,将BOD-OH配制成1×10-5mol/L待测液,用TU-1901紫外-可见分光光度计和Carry Eclipse荧光分光光度计测其吸收光谱和荧光光谱(狭缝宽度为2.5 nm,电压中等);用DPBF作为单线态氧捕获剂,在410 nm处测定BOD-OH的单线态氧产生能力。以罗丹明 6G为荧光量子产率的参比物,测定BOD-OH的荧光量子产率,并按课题组前期方法计算[13]。
1.3.3 4T1细胞培养及体外光动力效应 4T1(小鼠乳腺癌细胞)肿瘤细胞复苏后,在含有10%胎牛血清、1%双抗的RPMI 1640培养基中,于37℃和5% CO2条件下进行细胞培养试验。采用MTT法考察BOD-OH对4T1细胞在光照(光动力活性)和避光(暗毒性)的生长抑制活性[13]。步骤为:取上述对数生长期的4T1肿瘤细胞,接种于96孔板中(2.0×104~5×104个/mL),置于5% CO2、饱和湿度及37 ℃的培养箱中,培养24 h后,分别加入5、10、20、40、60、80、100和120 μg/L的受试化合物,暗室孵育20 h,用功率为500 mW/cm2溴钨灯光照,于37℃暗室孵育4 h,于每孔加入10 μL (5 mg/mL)的MTT溶液和90 μL培养基,再于37℃暗室孵育4 h,将孔内液体吸弃,每孔加入100 μL DMSO,室温下振摇5 min,用酶联免疫检测仪测490 nm OD值。细胞增殖抑制率公式为:抑制率=1-[OD(样品)-OD(空白)]/[(OD细胞对照-OD空白)]×100%。暗毒性考察不需光照,其他条件同上。
1.3.4 肿瘤模型的建立 实验动物为3~4周的雌性Balb/C小鼠,购于斯贝福(北京)生物科技有限公司,动物饲养及操作均遵照遵义医科大学动物实验中心要求,经适应性喂养1周后,皮下注射100 μL浓度为1×106个/mL的4T1细胞,继续喂养7~8 d,待肿瘤长到长宽约5 mm左右时即可进行实验。
1.3.5 体内光动力治疗性能研究 随机选取1.3.4中建立的肿瘤小鼠,并随机按每组4只分组:以PBS为空白组;以化疗药物苯丁酸氮芥为阴性对照组;市售光敏剂Ce 6为阳性对照组;用BOD-OH为实验组,上述分组均含光照组与暗室组。给药剂量100 μL,浓度2 μmol/L,给药方式为瘤内注射。
光照组需使用二极管激光灯(532 nm,500 mW/cm2)对肿瘤部位照射拟定的时间,每隔4天注射1次化合物并进行光照1次,暗室组仅注射化合物而不进行光照,每天称量每组小鼠体重并用游标卡尺测量肿瘤的长和宽,总治疗时长为15 d。15 d后,将各组小鼠处死,取肿瘤称重。
1.4 数据处理 所有的数据均用SPSS软件进行统计处理,用Origin 8软件作图。数据表示为平均值±SD。并使用单因素方差分析进行组间比较。P<0.05被认为具有统计学意义。
2 结果
2.1 BOD-OH的合成与结构表征 用乙基占据的2,4-二甲基-3-乙基-1H-吡咯与对羟甲基苯甲醛在TFA和DDQ催化下以50%的产率一锅获得BOD-OH,并对其结构进行表征,所得数据如下:m.p:245 ℃,1H NMR (400 MHz,CDCl3),δ 7.46-7.48 (d,J= 8.0 Hz,2H),7.26-7.28 (d,J= 8.1 Hz,2H),4.80 (d,J= 3.0 Hz,2H),2.52 (s,6H),2.26-2.32 (q,J= 7.6 Hz,4H),1.27 (s,6H),0.95-0.99 (t,J= 7.6 Hz,6H)。13C NMR (101 MHz,CDCl3),δ 153.65,141.55,139.92,138.31,134.94,132.72,130.87,130.55,128.40,127.25,64.81,17.03,14.60,12.48,11.75。FT-IR (KBr,4 000-400 cm-1) δ:3 558,2 954,2 917,2 859,1 529,1 469,1 398,1 311,1 247,1 182,1 114,1 056,971,752,694,525。
2.2 BOD-OH的光物理性质 为证实合成的BOD-OH具有优良的光学性能,将其以甲醇-水(v∶v=1∶1)配制成1×10-5mol/L待测液后,用TU-1901紫外-可见分光光度计和Carry Eclipse荧光分光光度计测其吸收光谱和荧光光谱,实验结果见图2。由图2可见,BOD-OH的最大吸收波长在532 nm处(见图2A),荧光发射波长为542 nm(见图2B),具有较好的摩尔吸光系数和荧光强度。以罗丹明6G作为荧光量子产率标准参照物,按课题组前期类似的方法[13]经计算得BOD-OH的荧光量子产率为0.78,仅比罗丹明6G小0.01。表明其有与商业光敏剂相差不大的荧光量子产率,具有良好的光学性能。

A:吸收光谱;B:荧光光谱。图2 BOD-OH的光谱测量结果
2.3 BOD-OH的单线态氧产生能力 一个化合物能否作为光敏剂,除具有良好的光学性能外,其在光辐射下产生单线态氧的能力是决定其光敏性的关键。为考察BOD-OH光辐射产生单线态氧的性能,以课题组常用的DBPF为单线态氧捕获剂[13],分别考察DBPF和DBPF与BOD-OH混合物在不同的光辐射时间后,溶液在410 nm处的吸光度变化情况,实验结果见图3。

光辐射条件:532 nm,500 mW/cm2。图3 不同时间光辐射BOD-OH分解DBPF
由图3可以看出,在光辐射5 min内,单独光辐射DBPF溶液在410 nm处的吸光度未发生变化,表明光辐射DBPF不能使其结构发生变化。而在BOD-OH与DBPF混合液中,随着光辐射时间的增加,DBPF在410 nm的吸光度逐渐减小,这是由于单线态氧使DBPF发生分解而结构改变,使其在410 nm处吸光度减小,表明光辐射BOD-OH有单线态氧的产生。
2.4 BOD-OH的细胞摄取实验 鉴于BOD-OH的良好荧光量子产率和光分解产生单线态氧的性能,接下来考察BOD-OH与4T1细胞共孵育后的细胞摄取情况,实验结果见图4。由图4可见,随着孵育时间的增加,荧光强度逐渐增大,当孵育时间到6 h后,细胞内荧光强度达最大值。表明BOD-OH能较快地进入4T1细胞,具有较好的细胞摄取性能,这为BOD在体内外进行PDT疗效实验提供了指导。

图4 BOD-OH与4T1细胞不同孵育时间下的荧光成像
2.5 BOD-OH的光动力细胞存活率实验 良好的光敏剂需要其在细胞层面暗毒性低而光毒性强,为进一步证实BOD-OH的体外光动力效能,以苯丁酸氮芥为阴性对照,用MTT法考察在相同光剂量下BOD-OH及苯丁酸氮芥分别对4T1细胞的细胞存活率,实验结果见图5。
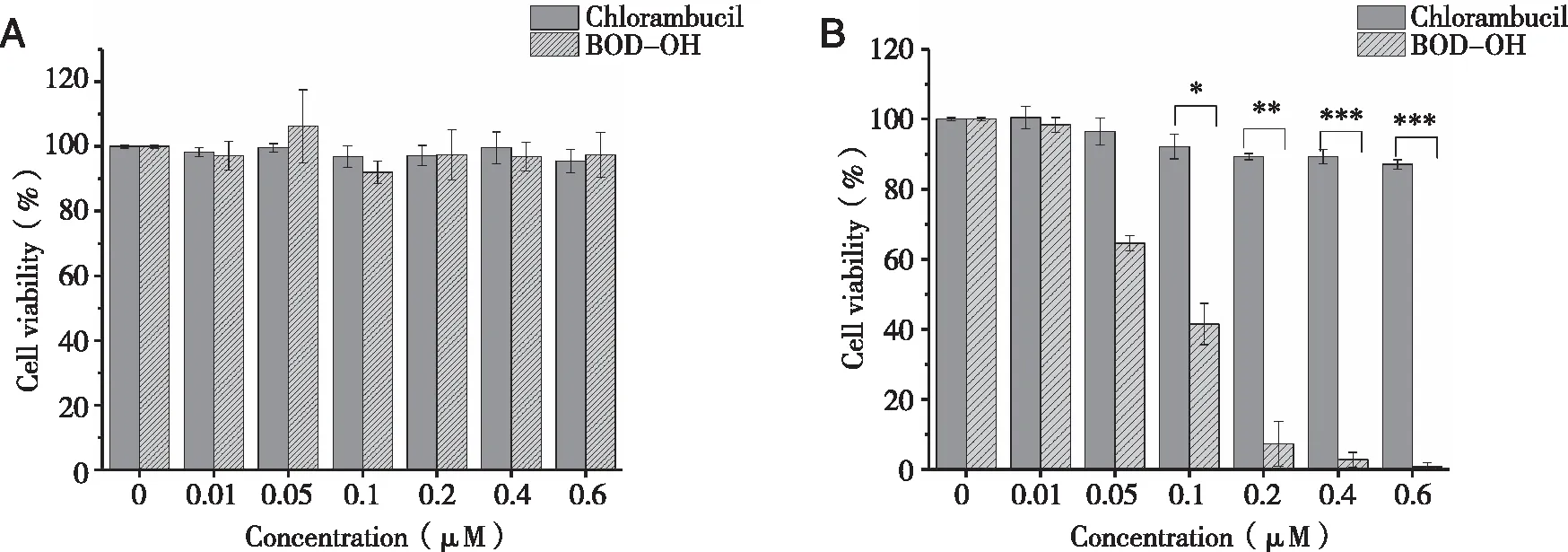
A:避光;B:光照(光照时间5 min;光条件:532 nm,500 mW/cm2);n=3。图5 苯丁酸氮芥和BOD-OH对4T1细胞存活率
由图5A可以看出,在未光照下两个化合物对4T1细胞的存活率均在95%以上,表明它们对受试的4T1细胞没有化疗作用,也即无暗毒性。相反,在相同光剂量辐射下(见图5B),苯丁酸氮芥即使在0.6 μmol/L下光辐射5 min,细胞存活率仍在88%以上;而BOD-OH在光辐射5 min后,即使在0.1μmol/L浓度下,细胞存活率即低于50%;而在0.6 μmol/L下的细胞存活率不足2%,表明BOD-OH对受试的4T1细胞具有较强的光动力活性。
2.6 BOD-OH的体内光动力效能 光敏剂往往在体外细胞实验中表现出较强的PDT治疗效果,而体内DPT治疗效果欠佳。这是由于活体组织对光的吸收等因素影响光敏剂获得有效的光能量,从而影响PDT治疗的活体应用。鉴于BOD-OH对4T1细胞具有暗毒性弱而光动力活性强的优点,进一步通过4T1荷瘤小鼠肿瘤模型,考察其体内光动力抗肿瘤效能。
考虑到活体组织对光的吸收,为获得体内PDT治疗的最佳光辐射时间,本文先考察了不同光辐射时间下BOD-OH对4T1荷瘤小鼠肿瘤模型的PDT性能。实验以PBS为空白对照,于瘤内给药(PBS或BOD-OH,给药剂量为100 μL,BOD-OH浓度为2 μmol/L,每4天给药1次)后光辐射不同时间,每天分别测小鼠的体重和肿瘤尺寸,15 d后处死小鼠,取肿瘤进行称重,实验结果见图6。

A:肿瘤体积变化情况;B:小鼠体重变化情况;C:15 d后的肿瘤质量变化情况;光条件:532 nm,500 mW/cm2;n=4。图6 生理盐水和BOD-OH对4T1荷瘤小鼠不同光辐射下的光动力效能
由图6可以看出,控制组生理盐水无论在避光还是在不同的光照时间后均对肿瘤没有显著的PDT作用。同样,在避光条件下,BOD-OH也对肿瘤没有显著的治疗作用。相反,BOD-OH在光照后有显著的治疗作用,且随着光辐射时间的增加,PDT治疗作用增强,但当光辐射时间达到10 min后,即使再增加光辐射时间到15 min,也未能提升PDT治疗作用,说明BOD-OH在体内的PDT抗肿瘤治疗以光辐射10 min为最佳时间。
体内最佳光辐射时间为BOD-OH在同样条件下与商业光敏剂进行疗效对比研究提供了实验数据指导。为此,本文以化疗药物苯丁酸氮芥和商业光敏剂Ce6(PDT治疗)为对照,固定光照时间为10 min,于上述同样条件下,对4T1荷瘤小鼠肿瘤模型的PDT作用进行了对比实验,结果示于图7。
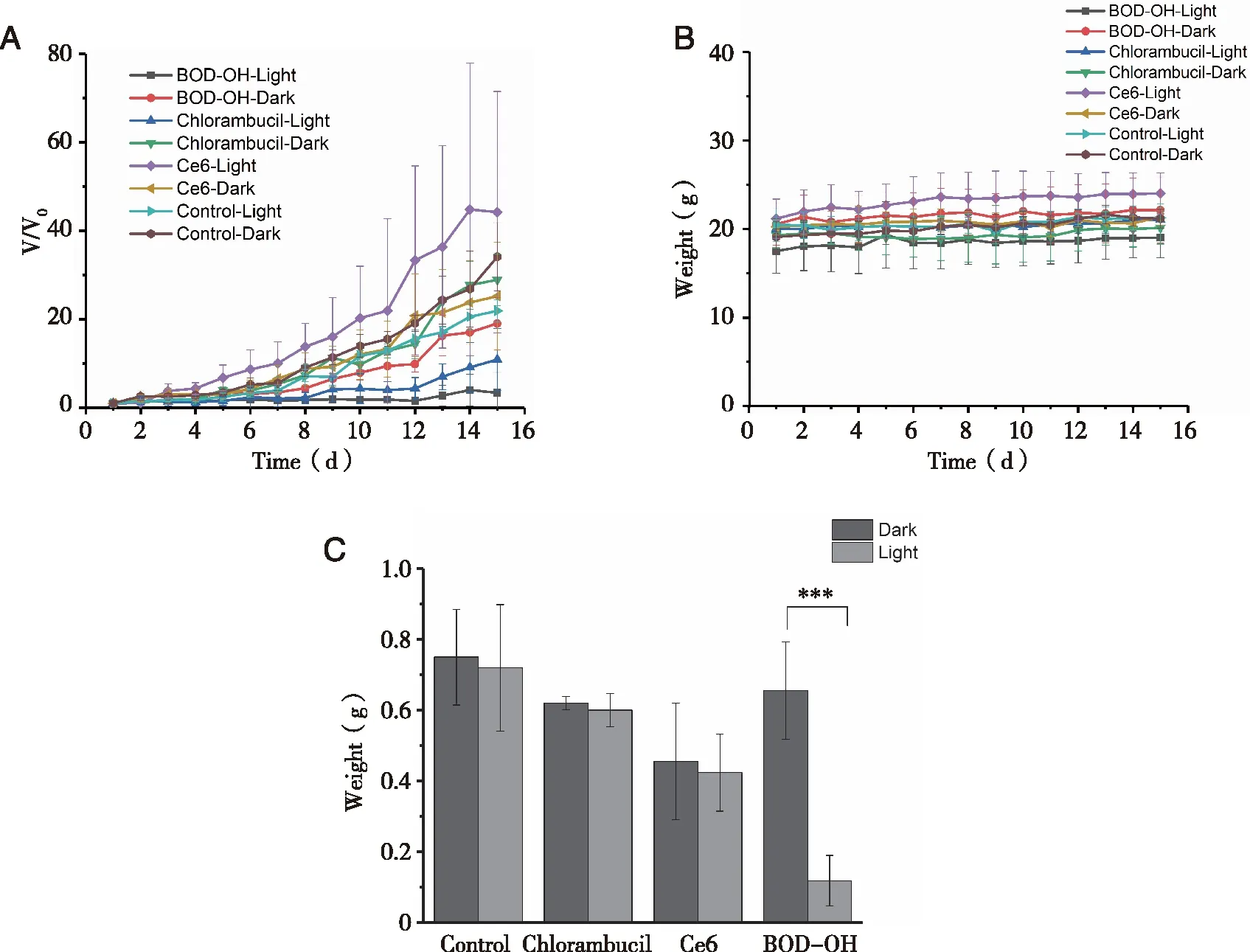
A:肿瘤体积变化情况;B:小鼠体重变化情况;C:15 d后的肿瘤质量变化情况;光条件:532 nm,500 mW/cm2(n=4)。图7 生理盐水、苯丁酸氮芥、Ce6及BOD-OH对4T1荷瘤小鼠的光动力效能
由图7可以看出,控制组生理盐水无论在避光还是光辐射下均未表现出抗肿瘤作用。化疗药物苯丁酸氮芥对肿瘤的抑制率为17.27%,光照后的肿瘤抑制率为16.85%,表明其无PDT肿瘤治疗作用。对于商业光敏剂Ce6而言,在没有光辐射下,其表现出了较强的暗毒性(化疗作用),肿瘤抑制率达39.16%;光辐射后肿瘤抑制率略有提高,肿瘤抑制率为41.16%,表明其具有较弱的PDT肿瘤治疗作用。在同样实验条件下,本文构建的BOD-OH在避光下仅有12.41%的肿瘤抑制率(化疗作用);当光辐射后,其肿瘤抑制率高达83.38%,说明其具有良好的体内PDT肿瘤治疗作用。
3 讨论
3.1 BOD-OH的合成、结构表征及光学性能
3.1.1 BOD-OH的合成 探寻性能优良的新光敏剂一直是研究者们热衷的课题[11-12],本文基于BODIPY类光敏剂的合成简单、光学性能优良、产生单线态氧等优势,开展了一个BODIPY光敏剂的合成。文献多以重原子取代方式制备BODIPY光敏剂[14-15],然而,重原子取代后虽能使BODIPY类光敏剂吸收波长改变,但重原子的引入使单线态氧的量子产率降低[14-15]。有研究者通过meso位取代BODIPY光敏剂也能提升其光动力效能[16]。为此,本文将2,6位用乙基取代,并在meso位含酚取代,设计合成了一个BODIPY先导化合物BOD-OH。
3.1.2 BOD-OH的结构表征 在BOD-OH的1H NMR波谱中,在7.26~7.46 ppm出现了4个质子化学位移,对应于芳环的4个质子;在4.80 ppm处为苄醇的亚甲基两个质子化学位移;在2.26~2.32 ppm出现了吡咯相连乙基中两个亚甲基的4个质子化学位移;0.85~2.52 ppm出现了3组甲基共18个质子化学位移,上述质子的数目与预期结构吻合。在BOD-OH的13C NMR波谱中,于153.65,-127.25 ppm出现了芳环、吡咯环碳的信号;而在64.81~11.75 ppm出现了亚甲基、甲基的碳信号。在BOD-OH的红外光谱中,于3 558 cm-1处出现的为羟基特征振动吸收峰;在2 954、2 917和2 859为甲基和亚甲基的特征振动吸收峰。上述结构表征充分说明成功合成得到预期的目标分子结构。
3.1.3 BOD-OH的光学性能 将BOD-OH配制成甲醇-水(v:v=1∶1)溶液后,通过吸收光谱和荧光光谱测定,表明其具有较好的摩尔吸光系数和强的荧光强度。以商业的光敏剂罗丹明6G为参比,测得BOD-OH的荧光量子产率仅比罗丹明6G荧光量子产率降低了0.1,表明其具有较好的光学性能,可作为潜在的光敏剂。
3.2 BOH-OH的PDT性能 细胞存活率实验结果表明BOD-OH对受试的4T1细胞具有避光下的低毒性和光辐射下的强的光毒性,其对受试的4T1细胞的IC50达0.071 μmol/L。说明其在细胞层面满足毒性低(暗毒性弱而光毒性强)的光敏剂要求。在体内的4T1肿瘤模型中,BOD-OH也表现出了较低的毒性和较高的PDT性能。与商业的光敏剂Ce6相比,Ce6的暗毒性是BOD-OH的3.1倍,而BOD-OH的PDT性能是Ce6的2.1倍。这表明本文构建的光敏剂对受试的4T1肿瘤模型具有更为优良的光敏剂PDT性能,值得进一步深入研究。
综上所述,本文所得BOD-OH具有制备简便、光学性能优良、组成单一,且在体内外均具有暗毒性弱而光毒性强的显著优势,为开发BODIPY类光敏剂提供了实验基础,值得进一步深入研究。
