氧化苦参碱通过抑制CHK1/2 磷酸化改善糖尿病大鼠肾组织的纤维化和炎症
2021-11-10李志阳肖雅文代云莉艾福军石明隽
李志阳,梁 丹,肖雅文,代云莉,艾福军,丁 菁,石明隽,肖 瑛,郭 兵
贵州医科大学基础医学院病理生理学教研室//贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵阳550025
糖尿病肾病(DKD)是终末期肾病的主要病因[1]。据统计,截止至2017 年全球糖尿病患者超过4.25 亿人。如果不采取干预措施,到2045年,全球患糖尿病的人数估计将上升至6.29亿[2]。而DKD是糖尿病的常见并发症和死亡原因[3]。近年研究认为肾脏血流动力学异常、氧化应激、糖脂代谢紊乱是其主要发病机制[4-8]。同时,炎症在DKD 的发生和发展中起着关键性的作用[9-12]。氧化苦参碱(OMT)是苦参中含量最高的生物活性物质,具有抗炎、抗病毒、抗心律失常、抗肿瘤、抗纤维化等作用,广泛用于慢性乙型肝炎的治疗及肥胖、糖尿病等相关疾病的辅助用药[13-14]。本课题组前期研究发现,OMT对糖尿病大鼠肾组织的炎症反应和纤维化均具有一定抑制作用[14-16]。细胞周期检测点激酶(CHK)包括CHK1、CHK2,是G2/M期细胞周期检测点调控及DNA损伤修复的关键分子,能够阻止发生DNA损伤的细胞进入有丝分裂并协调参与DNA修复的各个过程[17-18]。既往研究多集中于CHK1和CHK2与肿瘤发生发展之间的关系,特别是在胃癌、乳腺癌、食管癌、肺癌、血液肿瘤等肿瘤中CHK1和CHK2扮演着重要角色[19-23]。也有研究发现CHK1、CHK2可促进IL-1β和IL-6的分泌从而引起炎症反应,提示CHK1和CHK2可能与炎症和纤维化密切相关[24-25],但关于CHK1和CHK2可否成为OMT治疗DKD的主要靶点的研究目前尚未见报道,因此本研究旨在探究OMT对DKD抗炎抗纤维化的可能作用机制是否是通过影响CHK1 和CHK2 的表达来发挥的?为寻找OMT抗炎抗纤维化的有效靶点提供一定的理论和实验依据。
1 材料和方法
1.1 材料
1.1.1 动物与细胞 SPF级8周龄SD雄性大鼠18只(北京华阜康有限公司);大鼠肾小管上皮细胞NRK-52E细胞株(ATCC)。
1.1.2 药物与试剂 链脲佐菌素(STZ)(Sigma);氧化苦参碱(南京广润生物制品有限公司);β-肌动蛋白(βactin)(普美生物科技有限公司);兔抗纤维连接蛋白(FN)(abcam);鼠抗Ⅳ型胶原(Col-Ⅳ)(Sigma);兔抗Ⅲ型胶原(Col-Ⅲ)(武汉三鹰生物技术有限公司);鼠抗CHK1(博奥森生物有限公司);兔抗CHK2(abcam);兔抗p-CHK1(Ser345)(Cell Signaling Technology);兔抗p-CHK2(Thr68)(博奥森生物有限公司);ELISA试剂盒(Elabscience);正常糖培养基(Gibco);胎牛血清(PBS)(常州天地人和公司);CHK1-siRNA、CHK2-siRNA(吉玛基因股份有限公司)。
1.2 方法
1.2.1 动物模型的建立与分组 SD大鼠适应性喂养1周后,采用完全随机设计将大鼠随机分为正常对照组(NC组)、糖尿病模型组(DM组)、氧化苦参碱治疗组(OMT组)。DM组与OMT组尾静脉注射STZ(55 mg/kg)复制糖尿病动物模型。3 d后若血糖≥16.7 mmol/L视为糖尿病模型复制成功[17]。造模成功6周后,OMT组给予腹腔注射OMT 120 mg/kg,1次/d,NC组与DM组给予等量等体积生理盐水,持续注射8周,每周监测1次血糖、体质量。实验期间动物自由进食饮水。所有操作均遵照实验动物伦理学要求(1900073)进行。
1.2.2 取材与生化指标检测 给药8周后处死大鼠。处死前,代谢笼收集24 h尿并用试剂盒检测尿蛋白;股动脉取血,离心取血清;试剂盒检测血糖、血肌酐,剩余血清置于-80 ℃保存待用;取双侧肾脏,部分固定于4%多聚甲醛溶液中用于组织切片,其余肾脏组织-80 ℃保存备用。
1.2.3 细胞培养与干预 NRK-52E细胞用含10%胎牛血清和1%青霉素/链霉素的正常糖培养基,置于37 ℃、5%CO2恒温培养箱中培养,以备后续实验。OMT药物用量根据本教研室前期实验基础所得,为0.1 g/L。正常糖对照组(NG组)用1%NG培养(含1%胎牛血清的正常糖培养基,葡萄糖含量为5.5 mmol/L);高糖模型组(HG组)用1%HG培养(含1%胎牛血清的高糖培养基,葡萄糖含量为30 mmol/L);正常糖用药组(NG+OMT组)与NG组处理方式相同,同时用0.1 g/L OMT干预24 h;高糖用药组(HG+OMT组)与HG组处理方式相同,同时用0.1 g/L OMT 干预24 h;正常糖空载组(NG+con 组)用含1%NG 培养并转染阴性对照control-siRNA、正常糖敲低组(NG+siCHK1/2)用1%NG培养并转染CHK1/2-siRNA、高糖空载组(HG+con组)用1%HG 培养并转染阴性对照control-siRNA、高糖敲低组(HG+siCHK1/2)用1%HG培养并转染CHK1/2-siRNA。
1.2.4 肾组织HE染色、Masson染色 按试剂盒说明书操作。
1.2.5 ELISA 检测肾组织匀浆IL-6、IL-1β的水平 按BCA试剂盒说明书操作检测上清中蛋白浓度。ELISA试剂盒所测得IL-6、IL-1β浓度与上清中蛋白浓度之比为有意义值。
1.2.6 免疫组织化学染色检测肾组织中CHK1、CHK2、p-CHK1、p-CHK2、蛋白的表达部位 采用SP二步法,将组织切片行脱蜡、水化、微波炉加热进行抗原修复;30 mL/L H2O2去离子水孵育,一抗CHK1(1∶100)、CHK2(1∶100)、p-CHK1(1∶100)、p-CHK2(1∶100),4 ℃孵育过夜;PBS洗涤后,加相应二抗孵育,DAB显色,自来水充分冲洗、复染、脱水、封片,光镜下观察并拍照。
1.2.7 Western blot 法检测肾组织CHK1、CHK2、p-CHK1、p-CHK2、FN、Col-Ⅲ、Col-Ⅳ蛋白的表达水平取肾组织0.1 g,研磨后取上清。按BCA试剂盒说明书操作检测浓度,按比例加入5×的上样缓冲液,煮沸后经聚丙烯酰胺凝胶电泳分离蛋白;转膜,50 g/L脱脂牛奶封闭。TBST洗膜后,分别加β-actin(1∶5000)、CHK1(1∶1000)、CHK2(1∶1000)、p-CHK1(1∶1000)、p-CHK2(1∶1000)、FN(1∶1000)、Col-Ⅲ(1∶1000)、Col-Ⅳ(1∶1000)。4 ℃冰箱,摇床上孵育过夜;洗涤后分别加入相应的二抗标记物,室温孵育1 h;用增强化学发光法显色,Tanon凝胶成像,经Image J软件分析后得到灰度值。
1.2.8 统计学分析方法 采用SPSS 21.0统计软件进行,各组间数据的计量资料均以均数±标准差表示。经单因素方差分析,方差齐时,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义;若方差不齐时,组间两两比较采用Games-Howell检验,P<0.05为差异有统计学意义。
2 结果
2.1 OMT对各组大鼠生化指标的影响
与NC组相比,DM组大鼠血糖(BG)、血肌酐(Scr)和24 h尿蛋白(24 h UP)均明显升高(P<0.05),经OMT治疗8周后,与DM组大鼠相比血糖、血肌酐和24 h尿蛋白均有所改善,但血糖仍未降至正常(P<0.05,表1)。
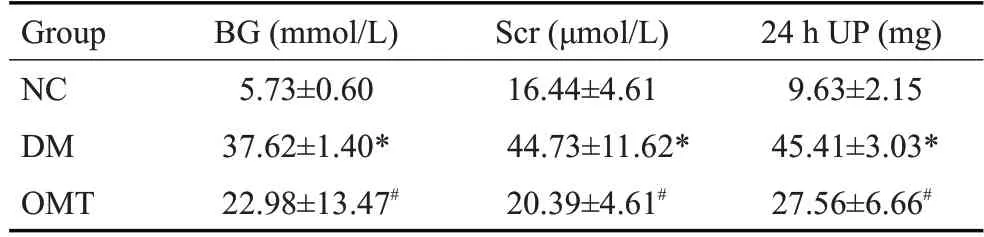
表1 各组大鼠血糖、血肌酐、24 h尿蛋白变化Tab.1 Changes of blood glucose,serum creatinine and 24 h urinary protein in each group(n=6,Mean±SD)
2.2 肾组织病理形态学变化
HE染色可见,NC组肾脏结构清晰完整;与NC组相比,DM组肾小球系膜细胞增生,肾小管萎缩,小管间质有炎性细胞浸润;与DM组相比,OMT组肾小球和肾小管病变程度明显减轻。Masson染色可见,与NC组相比,DM组肾小管间质胶原纤维增多;与DM组相比,OMT组胶原沉积显著降低(图1)。

图1 各组大鼠肾脏病理学变化Fig.1 HE and Masson staining for examining pathological changes of the kidney in each group(Original magnification:×400).Yellow arrows indicate the lesion site.
2.3 OMT对各组大鼠肾组织上清中炎症介质分泌的影响
DM组大鼠肾组织上清中IL-1β、IL-6的表达明显高于NC组(P<0.05)。给予OMT治疗8周后,与DM组相比IL-1β、IL-6的表达有所下降(P<0.05,表2)。
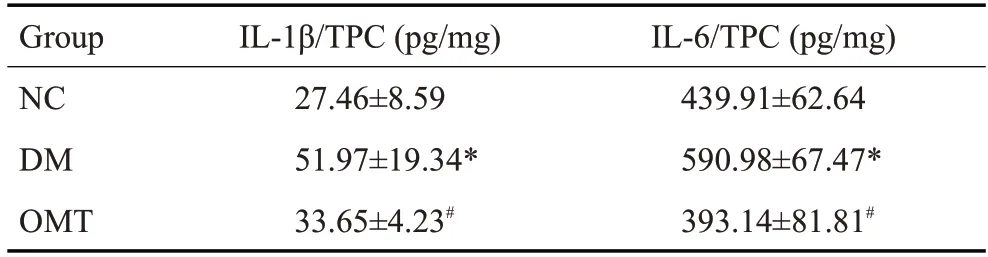
表2 各组大鼠肾组织上清中IL-1β、IL-6的表达水平Tab.2 Expression levels of IL-1β and IL-6 in the renal tissue of the rats in each group(n=6,Mean±SD)
2.4 CHK1、CHK2、p-CHK1、p-CHK2在大鼠肾组织蛋白中的定位及表达情况
NC 组大鼠的肾组织中,与DM 组、OMT 组相比CHK1、CHK2表达量无明显差异,但p-CHK1、p-CHK2表达量减少,DM组可见p-CHK1、p-CHK2表达明显增多,主要表达在肾小管胞浆和细胞核中,呈棕黄色,肾小球也可见少量阳性染色;而在OMT组中,p-CHK1、p-CHK2的表达较DM组明显减少,颜色变浅(图2)。

图2 免疫组织化学染色检测各组大鼠肾组织CHK1/2、P-CHK1/2的表达Fig.2 Expression of CHK1/2 and p-CHK1/2 in renal tissue of rats in each group detected by immunohistochemical staining(×400).Red arrows indicate positive expression.
2.5 Western blot检测各组大鼠肾脏中Col-Ⅲ、Col-Ⅳ、FN蛋白的表达情况
与NC组相比,DM组Col-Ⅲ、Col-Ⅳ、FN蛋白水平明显增加(P<0.05);与DM组相比,OMT组Col-Ⅲ、Col-Ⅳ、FN蛋白水平明显降低,差异具有统计学意义(P<0.05,图3)。
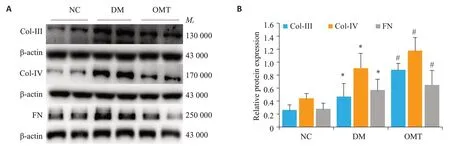
图3 各组大鼠肾组织中Col-Ⅲ、Col-Ⅳ、FN蛋白表达Fig.3 Col-III,Col-IV and FN protein expressions in the renal tissue of the rats in each group(n=6, Mean±SD).A:Western blots;B:Relative protein expression.*P<0.05 vs NC;#P<0.05 vs DM.
2.6 Western blot 检测各组大鼠肾组织中CHK1、CHK2、p-CHK1、p-CHK2蛋白的表达情况
在NC组、DM组和OMT组中CHK1、CHK2蛋白水平统计无差异。与NC组相比,DM组p-CHK1、p-CHK2蛋白水平明显增加(P<0.05);与DM组相比,OMT组p-CHK1、p-CHK2蛋白水平明显降低,差异具有统计学意义(P<0.05,图4)。

图4 各组大鼠肾组织中CHK1、CHK2蛋白表达Fig.4 Expression of CHK1 and CHK2 proteins in the renal tissue in each group(n=6,Mean±SD).A:Western blots;B:Relative protein expression.*P<0.05 vs NC;#P<0.05 vs DM.
2.7 敲低CHK1、CHK2后高糖培养的NRK-52E细胞中各蛋白的表达的影响
当CHK1/2敲低后,NG+siCHK1/2组各蛋白表达与NG+con 组相比无明显差异,与NG+con 组相比,HG+con组p-CHK1/2、Col-Ⅲ、Col-Ⅳ、FN蛋白水平明显增加(P<0.05);与HG+con组相比,HG+siCHK1/2组各蛋白水平明显减少(P<0.05,图5)。
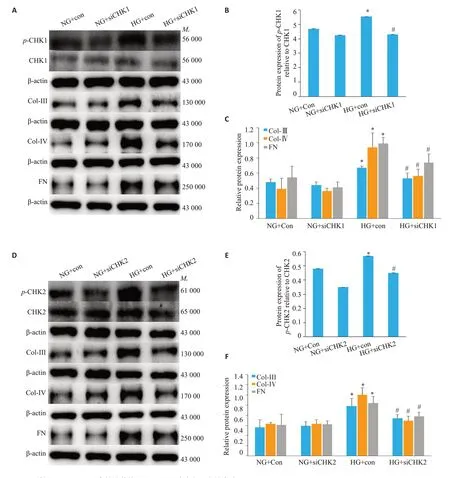
图5 敲低CHK1、CHK2高糖培养的NRK-52E细胞中各蛋白的表达Fig.5 Effects of CHK1 and CHK2 knockdown on protein expressions in NRK-52E cells exposed to high glucose(n=6,Mean±SD).A:Western blots of the proteins in cells with CHK1 knockdown.B:Protein expression of p-CHK1 relative to CHK1.C:Relative protein expression.D:Western blots of the proteins in cells with CHK2 knockdown.E:protein expression of p-CHK2 relative to CHK2.F:Relative protein expression.*P<0.05 vs NG,#P<0.05 vs HG.
2.8 OMT对高糖培养的NRK-52E细胞中各蛋白的表达的影响
与NG 组相比,HG 组p-CHK1、p-CHK2、Col-Ⅲ、Col-Ⅳ、FN 蛋白水平明显增加(P<0.05),但CHK1、CHK2 蛋白水平无明显变化。在所有组中CHK1、CHK2表达水平无明显差异。与NG组相比,NG+OMT组各蛋白表达无明显差异,HG组p-CHK1、p-CHK2、Col-Ⅲ、Col-Ⅳ、FN蛋白水平明显增加(P<0.05);与HG组相比,HG+OMT组蛋白水平明显减少(P<0.05,图6)。

图6 OMT对高糖培养的NRK-52E细胞中各蛋白的表达的影响Fig.6 Effect of OMT on protein expressions in NRK-52E cells cultured with high glucose (n=6, Mean±SD).A,B:Western blots.C:Relative protein expression.*P<0.05 vs NG.#P<0.05 vs HG.
3 讨论
DKD是糖尿病患者最常见且严重的并发症,是导致终末期肾病的主要原因[1]。近年来炎症一直是调节DKD过程重要的研究热点,广受学者关注。多位作者分别从炎症在DKD发展中的病理作用、表观遗传学对炎症和纤维化的治疗策略、表观遗传学与炎症的关系等方面进行综述[9,11,26]。当机体受到炎症持续刺激后,肾小管上皮细胞向间充质细胞转分化(EMT),此时产生大量的α-平滑肌肌动蛋白形成肌成纤维细胞,肌成纤维细胞大量增殖,分泌纤维FN和Ⅰ-Ⅳ型胶原,造成过量的细胞外基质沉积,最后形成纤维化病变[16,28-29]。高糖诱导的NLRP3炎症小体激活介导了HK-2细胞的IL-1β分泌、caspase-1激活和细胞凋亡,且在高糖条件下,CD36、NLRP3 和IL-1β 表达水平(蛋白质和mRNA)均显着增加[27]。α-硫辛酸可下调糖尿病大鼠肾组织TLR4 和NLRP3炎症信号,减少炎性因子IL-6和TNF-α的表达和细胞外基质的沉积,从而减轻DKD炎症反应和纤维化病变的发生发展[29]。CHK1、CHK2是细胞周期检测点调控的关键因子。当机体受到多种内源性或外源性因子的威胁而发生DNA 损伤时,CHK1、CHK2 可使DNA 复制停滞在G2/M 期,进而引起一系列反应[22]。Xu等[24]在PM2.5引起的人支气管上皮细胞气道炎症与自噬的研究中提到了CHK1及其相关通路可诱导炎症的发生从而上调IL-6和IL-1β的水平;人碳酸酐酶Ⅱ复制的衰老模型中发现CHK2可促进IL-6等炎性因子的分泌[25]。我们的研究结果发现,CHK1/2在糖尿病大鼠肾组织中呈高表达,同时IL-6和IL-1β也呈高表达,提示在DKD中CHK1/2仍可能是促进IL-6和IL-1β分泌的主要因素,即CHK1/2可能是导致DKD炎症的重要因素。
OMT被普遍认为具有抗炎、抗纤维化、抗病毒、抗心律失常和抗肿瘤等广泛的药理作用,目前被作为治疗糖尿病的辅助用药[13,14]。本课题组前期研究发现,OMT具有显著地抗肾纤维化作用,其机制可能与下调DKD肾组织中促纤维化因子TGF-β1表达和抑制Arkadia泛素化降解SnoN蛋白,促进SnoN蛋白水平的恢复进而抑制TGF-β1/Smads信号通路的致纤维化效应相关[14]。OMT也可通过将Id2与Twist结合并影响其下游靶基因的转录激活,促进Id2逆转EMT并在糖尿病肾小管上皮细胞中发挥抗纤维化作用[15]。此外,OMT可抑制高糖介导的炎症反应和致纤维化作用。其机制可能与OMT降低血糖抑制PKCα的信号激活,减少TLR4蛋白表达进而使肾组织局部炎症因子的分泌减少,从而缓解
DKD纤维化病变的发生发展有关[16]。本研究结果中OMT的抗炎抗纤维化作用与上述报道一致,不同之处在于我们观察到CHK1/2除作为细胞周期阻滞的关键激酶外,可能还参与了炎症在DKD中的发生发展,可能是OMT减轻DKD炎症和纤维化的新作用靶点。且在体外实验结果部分我们看到,高糖培养的NRK-52E细胞中CHK1/2磷酸化水平上升,纤维化指标增多,敲低CHK1/2后纤维化指标减少,经OMT处理后CHK1/2磷酸化水平降低,同时纤维化指标降低,这提示OMT治疗纤维化的中间靶点可能是CHK1/2。
综上所述,OMT在糖尿病大鼠肾脏中发挥抗炎、抗纤维化的作用机制可能是通过抑制CHK1/2的磷酸化水平从而影响下游IL-1β、IL-6炎症介质释放及细胞外基质分泌增多来发挥作用的。本研究立足于课题组前期对OMT治疗DKD的作用机制的研究,寻找到OMT治疗的新靶点CHK1/2,探究了OMT对糖尿病大鼠肾脏抗炎抗纤维化作用的可能机制是通过抑制CHK1/2磷酸化来发挥的,为寻找OMT的作用靶点提供新思路,同时为临床应用OMT治疗DKD提供实验依据。后续我们将深入探究OMT是如何作用于CHK1/2,寻找其具体分子机制,明确CHK1/2作为OMT的靶点是如何起到抗炎和抗纤维化的作用。
