伴不典型BCR-ABL融合基因的慢性髓细胞白血病1例报道并文献复习*
2021-11-09黄兴琴向时庆李志刚杨丽莎蒋玲琳姚元友文译翎
黄兴琴,向时庆,李志刚,杨丽莎,蒋玲琳,姚元友,文译翎,万 佳△
(陆军军医大学第一附属医院:1.血液科;2.检验科,重庆 400038)
慢性髓系白血病(chronic Myeloid Leukemia,CML)的特征是存在由t(9;22) (q34;q11.2)易位形成的费城(Ph)染色体[1]。这种易位是BCR-ABL融合基因产生的,编码具有组成性激酶活性的BCR-ABL融合蛋白[2]。BCR-ABL主要有3种类型,根据断裂点不同可分为M型(major),包括b2a2(e13a2)和b3a2(e14a2),m型(minor)ela2和u型e19a2[3]。目前,国内外大多数实验室都对这3种典型BCR-ABL融合基因进行常规检测,但仍有小于1%的CML患者,其BCR或ABL基因的断裂点不在以上常见位点,从而形成非典型BCR-ABL融合基因亚型,包括e14a3、e8a2、ela3、e6a2、el3a3等[4-5]。这些非典型BCR-ABL,可能有着不同的临床意义,其发现有助于CML的诊断、治疗及后续治疗疗效的监测,而目前的检测方案,往往会导致不典型BCR-ABL的漏检。本研究所报道病例是1例携带非典型BCR-ABL融合基因的CML患者,染色体核型分析及荧光原位杂交(fluorescence in situ hybridization,FISH)检查均符合CML的特点,但典型的BCR-ABL融合基因检测结果为阴性,进行非典型BCR-ABL的融合基因筛查后检测到BCR-ABL(e14a3),现将该病例诊治情况报道如下。
1 资料与方法
1.1 一般资料
患者,男,66岁,因“左侧臀部疼痛、血象异常8 d,血糖升高5年”于2018年7月19日入住血液科治疗。
1.2 方法
患者入院后进行体格检查、血常规检查、骨髓细胞形态学检查、影像学检查、染色体核型分析、FISH检查、分子生物学检查等。
2 结 果
2.1 患者体格检查及血常规检查结果
体格检查:无贫血貌,全身皮肤无瘀点瘀斑,胸骨压痛阴性,全身浅表淋巴结未扪及肿大;咽部充血,口腔无溃疡、出血;心肺(-),脾大平脐,质中。血常规检查结果:白细胞计数(WBC) 36.4×109/L、红细胞计数3.27×1012/L、血红蛋白(Hb) 96.0 g/L、血小板(PLT) 1 045.0×109/L。
2.2 患者细胞形态学检查结果
外周血细胞形态学检查结果显示:中性粒细胞增高,以成熟中性粒细胞为主,可见原始及幼稚粒细胞,红细胞形态正常,血小板易见,可见大血小板。原始粒细胞占2%,早幼粒细胞占3%,中幼粒细胞占9%,晚幼粒细胞占5%,杆状核粒细胞占13%,分叶核粒细胞占68%,无嗜酸性粒细胞和嗜碱性粒细胞,有核红比例6∶100(图1A)。骨髓细胞形态学检查结果显示:有核细胞增生活跃,粒细胞系增生,比例70.5%,以成熟粒细胞为主,部分细胞胞体大,核质比例增大,核肿胀,细胞质中颗粒增粗,原始粒细胞占0.5%,嗜酸性粒细胞和嗜碱性粒细胞各占0.5%。红细胞系增生活跃,以晚幼红细胞为主,部分幼红细胞可见核固缩,类巨幼样变。全片见巨核细胞28个,其中颗粒巨核细胞4个,产板巨核细胞24个,血小板增多,成大堆易见,可见小巨核细胞及大血小板(图1B)。外周血涂片碱性磷酸酶(NAP)染色:阳性率66%,积分102分(图1C)。铁染色:外铁(+),内铁62%。血小板增多,外周血可见原始及幼稚粒细胞及有核红细胞,骨髓纤维化待排;建议BCR-ABL融合基因及JAK2、MPL、CALR等基因检测。骨髓活检显示:造血组织增生异常活跃,以粒细胞系、巨核细胞系为主,粒细胞系极度增生,原始幼稚前体细胞散在易见,以中晚幼粒细胞及以下阶段为主,可见幼稚细胞异常定位,且可见骨小梁旁区原始幼稚前体细胞层增宽,嗜酸性粒细胞明显增多,易见早期阶段嗜酸性粒细胞。红细胞系增生明显低下,幼红细胞簇未见。巨核细胞系增生明显,可见病态巨核细胞。多形性改变明显,纤维组织增生。结论:造血组织异常活跃,以粒细胞系、巨核细胞系为主,CML待排,请结合临床,完善相关检查。见图2。

A:外周血涂片(瑞氏染色);B:骨髓涂片(瑞氏染色);C:外周血涂片(NAP染色)。
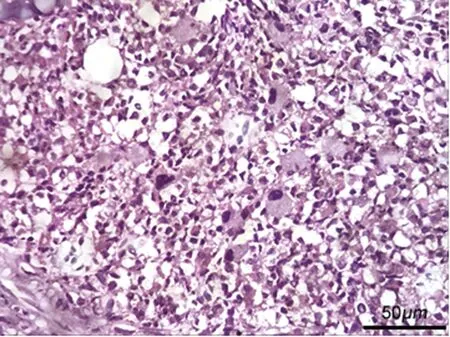
图2 骨髓活检(×400)
2.3 患者影像学检查结果
显示脾脏肿大。
2.4 患者染色体核型及FISH检测结果
染色体核型:46,XY,t(9;22;11)(q34;q11.2;q14)。结论:可见克隆性异常t(9;22;11)。FISH检测BCR-ABL融合基因阳性,伴融合基因阳性的间期核占74%,即伴t(9;22)染色体易位的间期核占74%,正常细胞间期核占26%,JAK2呈阴性表达。见图3。
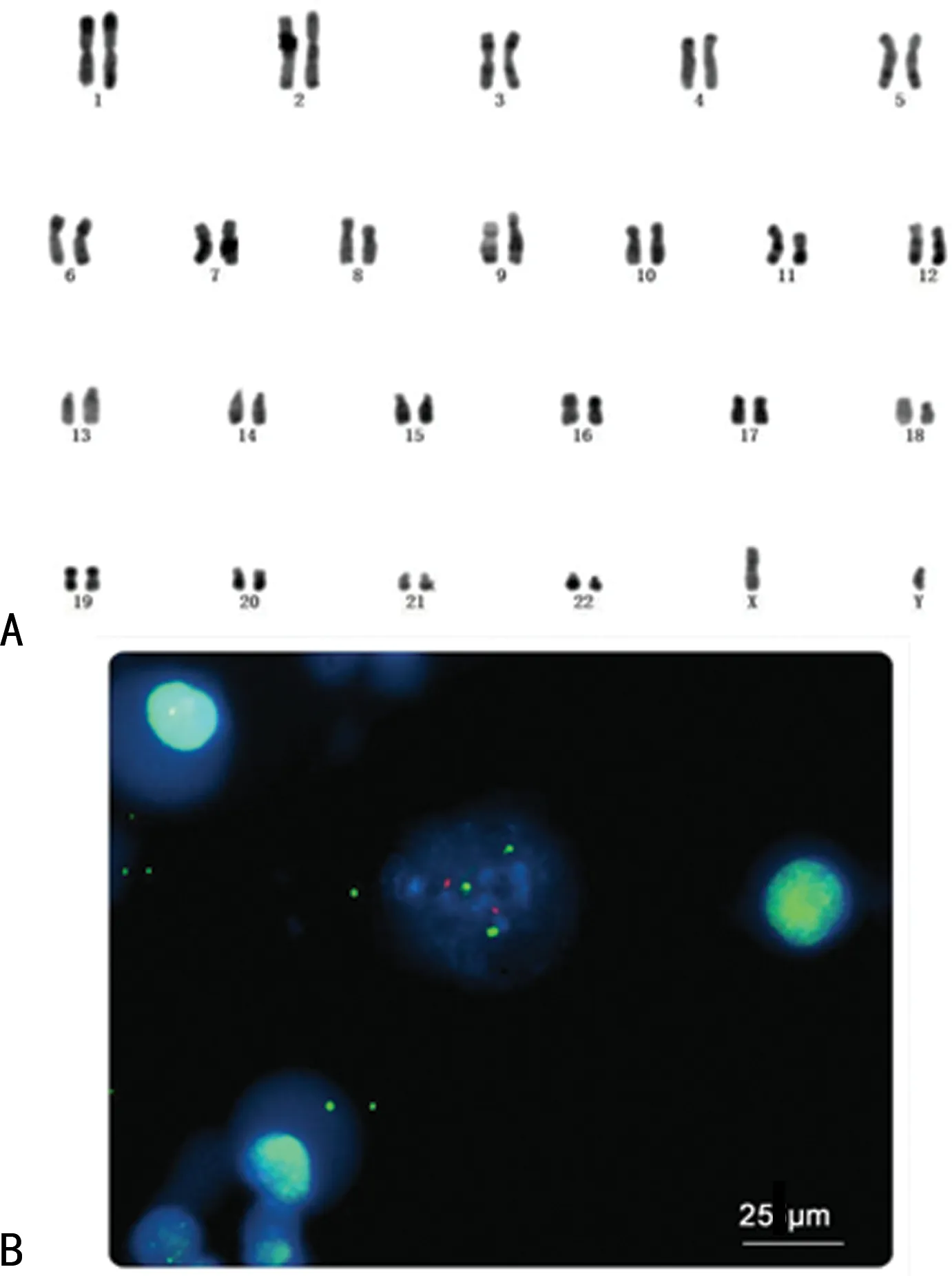
A:染色体核型分析结果;B:FISH检测结果。
2.5 患者分子生物学结果
实时荧光定量PCR(RT-qPCR)检测显示:JAK2、CALR、MPL基因阴性,BCR-ABL(p210、p190、p230)基因阴性。BCR-ABL罕见基因型检测结果为BCR-ABL(e14a3)阳性。
2.6 诊断及治疗
综合以上检查结果,临床诊断为 CML,入院后予以羟基脲降白细胞、血小板,补液及碱化、水化改善循环,补充造血原料升Hb,门冬胰岛素30注射液控制血糖等治疗,确诊后,经甲磺酸伊马替尼0.4 g/d治疗,患者治疗4个月复查BCR-ABL(e14a3)基因转阴,目前仍以甲磺酸伊马替尼维持治疗中,BCR-ABL(e14a3)基因持续阴性。
3 讨 论
从结构上看,e14a3 融合基因的ABL基因断裂点位于第3号外显子(a3),因此融合基因中缺乏ABL的a2外显子,属于a3型BCR-ABL融合基因[6-7]。有研究发现,a3型BCR-ABL融合基因缺乏ABL的SH3区域,该区域可对ABL激酶的SH1区域进行反向调节,丢失该区域将使ABL激酶活性增加,加速患者病程进展[7];但也有不同的观点,认为SH3区域可激活与白血病发生相关的STATS信号途径,丢失该区域可使细胞的白血病活性降低[8],可能导致较慢的临床进展[9]。虽然SH3结构域在白血病发生中的作用仍有争议,但缺少SH3结构域并没有对白血病的临床病程产生更有利的影响[5]。
从治疗效果上看,目前大多数的研究均支持BCR-ABL(e14a3)型的CML患者对酪氨酸激酶抑制剂(TKI)敏感[10-11]。2017年,HU等[12]对以往报道的14例BCR-ABL(e14a3)型的CML病例进行了分析,结果提示此类患者中位年龄44.5岁,相比典型BCR-ABL的CML患者更为年轻,且以男性居多(男女比例12∶2),疾病侵袭性较弱,白细胞计数较低,对伊马替尼反应良好[12]。2018年,QIN等[4]分析4 750例CML,在83例患者中检出19种少见融合基因,其中BCR-ABL罕见基因(e14a3)11例、BCR-ABL(e13a3)6例,与典型BCR-ABL(p210)的CML患者比较,接受一线伊马替尼治疗的BCR-ABL(e14a3)型患者,1年完全细胞遗传学反应(CCyR)和主要分子学反应(MMR)的概率显著升高(P=0.007 2、P=0.007 3)。2019年,XUE等[5]分析了2 331例CML,其中BCR-ABL(e14a3)型检出9例,也得出相同结论,BCR-ABL(e14a3)型的CML患者,对TKI敏感,且预后良好。
在本病例中,患者伴有不典型BCR-ABL(e14a3)基因阳性,经甲磺酸伊马替尼治疗后转阴,并在后续检测中持续阴性,表明患者对伊马替尼敏感,进一步支持了BCR-ABL(e14a3)的CML患者对TKI敏感的观点。但是该患者同时伴有复杂染色体易位46,XY,t(9;22;11)(q34;q11.2;q14),这在既往报道中比较少见。目前的研究认为,复杂变异的Ph染色体易位约占5%~10%[13],与典型的Ph染色体易位患者比较,复杂易位的患者预后并无不同[14]。其中,t(9;22;11)的易位,目前仅有几例报道,且多数显示对伊马替尼敏感,预后较好,且并未发现不典型BCR-ABL,而是典型的BCR-ABL(p210)型[15-17]。因此,本病例中t(9;22;11)复杂易位与不典型BCR-ABL同时存在的现象非常少见。
综上所述,罕见BCR-ABL融合基因的检出,对于患者的预后评估和治疗方案的选择都非常重要,而目前的BCR-ABL检测主要是针对p210、p190、p230,罕见的融合变异可能被遗漏。所以,对于形态学及染色体检查均符合CML的特点,但是典型的BCR-ABL融合基因检测阴性的情况下,应进行非典型BCR-ABL的融合基因筛查,有助于合理评估患者的预后及疾病进展,及时调整治疗方案;并且可以作为后续微小残留病灶(MRD)监测的一个敏感性指标。
