CQ10-LPSp对紫花苜蓿幼苗内生细菌多样性及其根瘤菌的影响
2021-11-09王晓芬德吉卓玛吴菁菁张振粉
黄 荣, 姚 博, 王晓芬, 德吉卓玛, 吴菁菁, 张振粉
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
植物内生细菌是指在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官的细菌[1],它可以通过维管束系统进入种子,也可以通过禾谷类花粉通道、成熟种子的种脐、种皮的裂缝开口、种皮背部索状细胞和种脊进入种子,成为种子内生细菌,即植物种带细菌[2-3]。换言之,种带细菌是下一代新植株内生细菌的重要来源。其中植物根系作为植物获取养分、水分和矿质营养物质的重要器官,定殖着大量的细菌,是植物分解转化污染物和抵御病原菌入侵的重要场所,为宿主提供了丰富的生态位,所以植物根系内生细菌是植物内生细菌的重要来源。植物根系内生细菌在植物体内与宿主协同进化发挥各种生物学作用,如促进宿主植物生长[4-5]、防控植物病虫害[6-8]和提高植物抗逆性[9]等。目前关于植物根系内生细菌的研究多集中在其次级代谢产物的生物功能测定及农业、生物防治和医药领域等方面的应用[10]。
一般来说,植物内生细菌中绝大部分属于革兰氏阴性细菌(Gram negative bacteria,G-)[11-13]。脂多糖(Lipopolysaccharide,LPS)作为革兰氏阴性细菌细胞外膜的主要成分和次生代谢产物之一,覆盖40%左右的细菌细胞表面,对植物、动物和多种真核生物体有极强的免疫刺激的作用[14],可以引起植物叶绿体损伤和活性氧(Reactive oxygen species,ROS)迸发等反应[15],在植物生长发育调控过程中起到重要作用。其次,脂多糖也是一种重要的微生物相关分子模式(Microbe-associated molecular patterns,MAMP),植物可以通过模式识别受体(Pattern recognition receptor,PRR)感知MAMP并激发的免疫反应,被称为模式触发的免疫(Pattern-triggered immunity,PTI)反应[16]。冷静[17]报道成团泛菌脂多糖(Pantoeaagglomeranslipopolysaccharide,LPSp)是一种低毒性、安全性良好和纯度活性高的免疫增强剂,在调控植物周围环境微生物种类和组合中起着重要作用[18]。本实验室前期研究表明,0.267 0 EU·mL-1成团泛菌脂多糖会促进紫花苜蓿的生长和结瘤[19]。其中根瘤菌(Rhizobium)作为紫花苜蓿共生固氮体系中一种典型的革兰氏阴性细菌[20],其共生体系中的细菌脂多糖是如何影响寄主紫花苜蓿根系中的根瘤菌等内生细菌的机理仍未明确,需开展相关研究。为此,本试验以‘巨能551’紫花苜蓿品种为试验材料,探究不同浓度成团泛菌CQ10脂多糖(PantoeaagglomeransCQ10 Lipopolysaccharide,CQ10-LPSp)对紫花苜蓿幼苗内生细菌多样性及其根瘤菌的影响,其结果可为挖掘和开发促进根瘤菌生长的外源添加脂多糖制剂提供理论和实践依据。
1 材料与方法
1.1 供试材料
供试菌株:紫花苜蓿种带成团泛菌(Pantoeaagglomerans)CQ10菌株由甘肃农业大学草业学院牧草病理实验室提供。
供试品种:紫花苜蓿‘巨能551’(Medicagosativa‘Juneng 551’)种子由甘肃农业大学牧草种质资源实验室提供。
1.2 供试培养基
营养琼脂/液体培养基(Nutrient agar,NA/NB),配方参考《植病研究方法(第三版)》[21]。
酵母甘露醇琼脂/液体培养基(Yeast mannitol agar,YMA/YMB),配方参考刘卢生等人的[22]的方法。
1.3 紫花苜蓿种带细菌的分离
采用常规稀释法分离培养。称取‘巨能551’紫花苜蓿种子0.25 g,先用质量浓度75%的酒精浸泡2 min,后转入3%的NaClO浸泡5 min,无菌水冲洗3~4次,转至盛有10 mL无菌水的研钵研磨。静置10 min后,将原液依次稀释为10-4~10-1的梯度稀释液。每个梯度稀释液分别吸取200 μL上清液均匀涂布到NA和YMA培养基上,以无菌水涂布的NA和YMA培养基为空白对照,n=3。涂板后转置28℃恒温箱中培养3 d,通过形态观察挑选单菌落进行分离纯化,记录菌落数及菌落的形态特征。菌株纯培养保存于—80℃冰箱中。
1.4 细菌的16S rDNA鉴定
细菌DNA提取使用天根生化科技(北京)有限公司TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒(离心柱型,目录号DP302),具体方法参见试剂盒说明书。
细菌基因的扩增,参照夏秀东的方法[23],将扩增产物送到武汉金开瑞生物工程有限公司进行检测。
1.5 构建根瘤菌的系统发育树
将测序后的根瘤菌DNA序列提交到NCBI-Blast进行在线比对,后选用同源性最高的菌株的序列作为参比对象,运用MEGA6.0软件Neighbor-Joining法构建系统树,确立根瘤菌的系统发育地位。
1.6 CQ10-LPSp对紫花苜蓿生长的影响
1.6.1CQ10-LPSp的提取 CQ10菌株复苏后在NA培养基上培养48 h并提取其脂多糖备用,提取方法参照文献[19]。
1.6.2CQ10-LPSp的浓度设置 试验设置6个浓度,即0,0.133 5,0.200 3,0.267 0,0.333 8,0.400 5 EU·mL-1。浓度按照CQ10-LPSp的活性[19]进行配制。
1.6.3接种试验 向生长瓶中加入200 mL蒸馏水和不同浓度(0,0.133 5,0.200 3,0.267 0,0.333 8,0.400 5 EU·mL-1)的CQ10-LPSp,高温高压(121℃,0.11 Mpa)灭菌21 min后待用。后挑选籽粒饱满、无病虫害的内含根瘤菌紫花苜蓿品种的干净种子600粒。将种子等距置于上述灭好菌的发芽瓶的发芽床上,每瓶25粒,每个处理4个重复。接入种子后将发芽瓶放置于温度23℃、湿度45%、光照(18 Klx)18 h、黑暗6 h的生长室进行培养,期间需观察无菌水组和处理组种子的结瘤状况,于第21 d取样分离研磨紫花苜蓿根系内生根瘤菌。
1.7 CQ10-LPSp对紫花苜蓿根系内生根瘤菌数量的影响
以100 mLYMA固体培养基为基础培养基,分别添加不同浓度的脂多糖(0.133 5,0.200 3,0.267 0,0.333 8,0.400 5 EU·mL-1)CQ10-LPSp,并以空白的YMA固体培养基为对照。培养基分装后121℃高温灭菌后倒平板待用。后挑取根瘤菌单菌落接种到培养基上,每个处理4个重复,27℃恒温培养箱培养3 d,观察根瘤菌的生长形态。
1.8 CQ10-LPSp对紫花苜蓿根系幼苗内生细菌多样性的影响
超净工作台中分离6个不同浓度下紫花苜蓿根系的内生细菌。分别称取不同浓度下的幼苗根系0.1 g,消毒研磨稀释涂板,方法与1.3相同。比较纯化后的细菌分离物和‘巨能551’紫花苜蓿种带细菌分离物的种类和数量。
1.9 数据分析
试验数据用SPSS 23.0软件进行统计分析,采用单因素方差分析检验不同CQ10浓度对紫花苜蓿幼苗根系根瘤菌数量的影响,用Duncan法进行多重比较,显著性水平a为0.05;采用Microsoft Excel 2010进行数据整理和绘图。
2 结果与分析
2.1 紫花苜蓿种带细菌多样性
根据颜色、大小和形态等菌落形态特征的不同分类可知,从‘巨能551’紫花苜蓿品种中共得到17株细菌分离物,分别为NA培养基上9株,细菌的总数量约为1.38×108cfu·g-1;YMA培养基上8株,细菌的总数量约为1.07×107cfu·g-1,表明‘巨能551’种带内生细菌丰富多样。根据其形态特征的差异,提取其DNA、扩增16S rDNA序列,与NCBI的BLAST比对,鉴定结果如表1所示,代表菌属在培养基上的形态见图1。17株细菌分离物分别隶属于欧文氏菌属(Erwiniasp.)、肠杆菌属(Enterobactersp.)、芽孢杆菌属(Bacillussp.)、假单胞菌属(Pseudomonassp.)、埃希氏菌属(Escherichiasp.)、亚特兰大杆菌属(Atlantibactersp.)和中华根瘤菌属(Sinorhizobiumsp.)。其中革兰氏阳性细菌(Gram-positive bacteria,G+)有79株,革兰氏阴性细菌179株,革兰氏阴性细菌多于阳性细菌,表明种子内部分布着大量的脂多糖。

表1 ‘巨能551’紫花苜蓿种带细菌的种群、数量、菌落特征及属名Table1 Population,quantity,colony characteristics and generic name of bacteria in ‘Ju neng 551’ alfalfa

图1 代表菌属在培养基上的形态Fig.1 The morphology of representative bacteria on the culture medium注:Dfz15(欧文氏菌属);Dfz8(芽孢杆菌属);Dfz6(埃希氏菌属);Dfz3(肠杆菌属);Dfz9(假单胞菌属);Dfz16(亚特兰大杆菌属)Note:Dfz15(Erwinia sp.);Dfz8(Bacillus sp);Dfz6(Escherichia sp.);Dfz3(Enterobacter sp.);Dfz9(Pseudomonas sp.);Dfz16(Atlantibacter sp.)
其中编号为Dfz17菌株的16S rDNA序列,通过MEGA6.0构建菌株的系统发育树见图2。系统发育树结果表明,菌株Dfz17与Sinorhizobiummeliloti(FM178842.1)、Sinorhizobiummeliloti(FM178844.1)在系统发育树上聚在一起,且相似度为100%,初步将其鉴定为中华根瘤菌属(Sinorhizobiumsp.)。

图2 Dfz17的系统发育树Fig.2 Phylogenetic tree of Dfz17 bacteria
2.2 CQ10-LPSp对‘巨能551’根系内生根瘤菌的数量影响
不同CQ10-LPSp浓度下,‘巨能551’紫花苜蓿生长和结瘤现象不同,其中仅0.267 0 EU·mL-1CQ10-LPSp下紫花苜蓿根有结瘤。研磨幼苗根系内生细菌,结果表明随着CQ10-LPSp浓度的增大,紫花苜蓿根系内生根瘤菌的数量呈先上升后下降的趋势,且在0.267 0 EU·mL-1CQ10-LPSp下达到最大;而在0.333 8 EU·mL-1CQ10-LPSp和0.400 5 EU·mL-1CQ10-LPSp下,未分离到根瘤菌(表2)。

表2 6个不同CQ10-LPSp浓度下‘巨能551’根系内生根瘤菌的数量Table 2 The number distribution of Sinorhizobium in the root system of ‘Juneng 551’ at 6 different CQ10-LPSp concentrations
通过观察添加不同浓度的CQ10-LPSp培养基上根瘤菌的生长形态,发现添加不同浓度CQ10-LPSp对根瘤菌的生长影响不同。仅添加0.267 0 EU·mL-1CQ10-LPSp的培养基上根瘤菌的单菌落较对照分布较多,其余浓度下均未观察到根瘤菌的生长。该结果表明0.267 0 EU·mL-1CQ10-LPSp可以促进根瘤菌的生长,且其可以提高幼苗内生根瘤菌的数量与植物内生细菌多样性有关。
2.3 CQ10-LPSp对紫花苜蓿根系幼苗内生细菌多样性的影响
另外,分离0.267 0 EU·mL-1CQ10-LPSp处理下紫花苜蓿的根系内生细菌,还得到了其他8株菌株,种群、数量及菌落征(表3)和菌落形态(图3)。根系内生细菌种类比种带细菌少。其中,编号Rn1和Dfz13,Rn3和Dfz17,Rn4和Dfz4,Rn2和Dfz10,Rn6和Dfz5细菌种类是一样的,且Rn1,Rn3和Rn4数量大于Dfz13,Dfz17和Dfz4,Rn2数量小于Dfz10,Rn6数量等于Dfz6;而Rn5,Rn7和Rn8菌株未在种带细菌中发现,经16S rDNA鉴定和NCBI比对,鉴定Rn5为副球菌属(Paracoccussp.),Rn7和Rn9为芽孢杆菌属(Bacillussp.),Rn6为志贺氏菌属(Shigellasp.)。

图3 9株细菌分离物在YMA和NA培养上的生长形态Fig.3 Growth morphology of 9 strains of bacteria isolate on YMA and NA culture
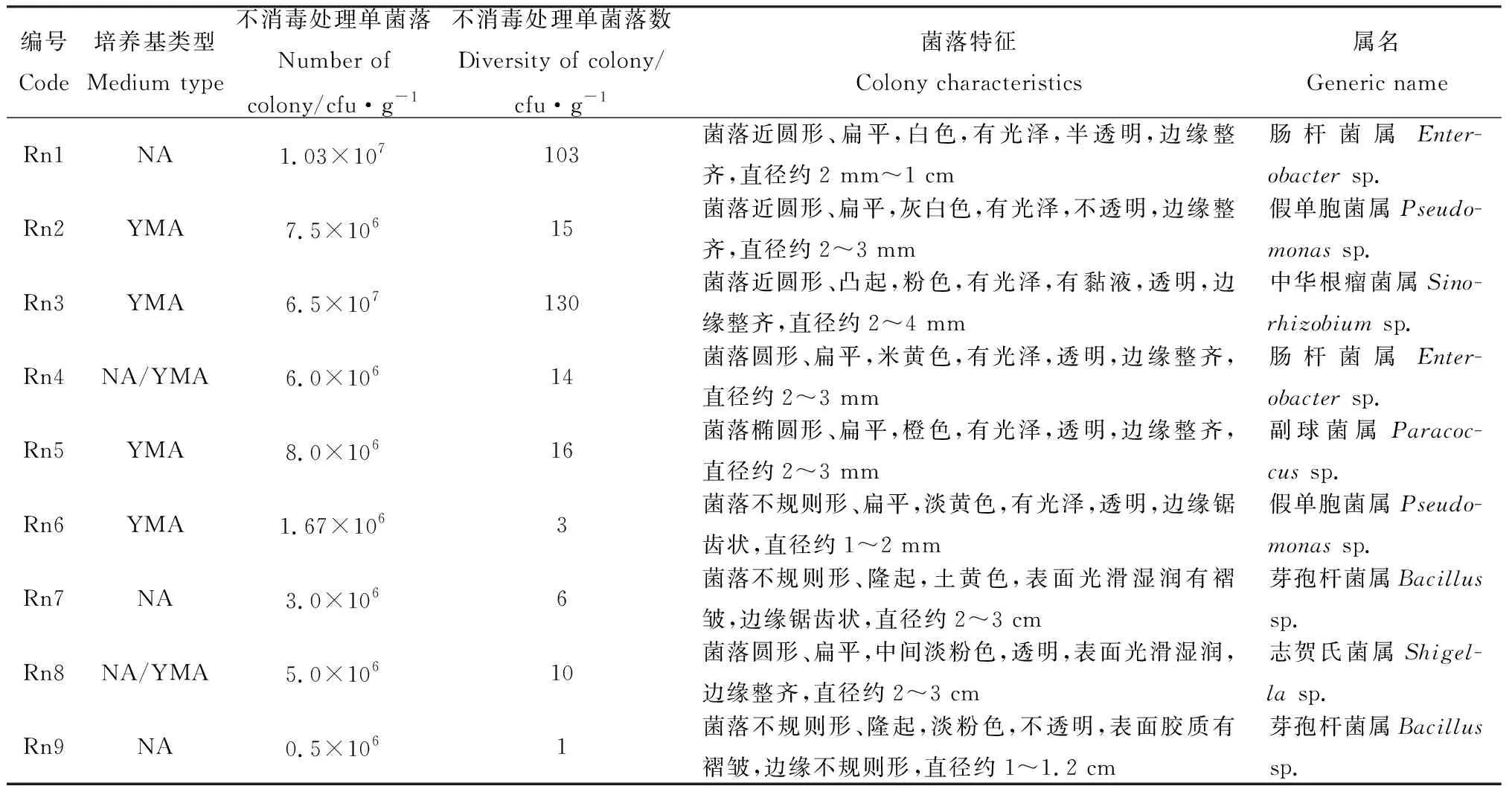
表3 0.267 0 EU·mL-1 CQ10-LPSp下紫花苜蓿根系内含细菌的种群、数量及菌落征Table 3 Population,quantity and colony characteristics of bacteria in the roots of 0.267 0 EU·mL-1 CQ10-LPSp alfalfa
3 讨论
3.1 CQ10-LPSp对紫花苜蓿内生细菌多样性的影响
经过长时间的协同进化,内生细菌与宿主植物之间形成了稳定的共生体。一方面,内生细菌能够为植物提供生物活性代谢物(如营养物质、矿物质、酶和植物激素等),并促进这些资源的再分配,从而有助于宿主植物抵抗外界的逆境胁迫[24-25];另一方面,宿主植物在自身生长繁殖正常的情况下为内生细菌提供了一个稳定的生长和繁殖场所,从而与其形成共生互利的生命体[26]。本研究采用NA和YMA培养基,对‘巨能551’紫花苜蓿品种内生细菌进行多样性分析,得到17株内生细菌,分别隶属于欧文氏菌属、芽孢菌属、肠杆菌属、假单胞菌属、埃希氏菌属、亚特兰大肠杆菌属和中华根瘤菌属。在全程无菌条件下再用0.267 0 EU·mL-1CQ10-LPSp处理紫花苜蓿的根系,分离得到了新的两属细菌(副球菌属和志贺菌属),但未能重复分离得到紫花苜蓿种带的欧文氏菌属、亚特兰大肠杆菌属和埃希氏菌属,而芽孢杆菌属等其余细菌仍然存在于在脂多糖处理后的紫花苜蓿根系中。王志伟等[1]报道种子内微生物群不仅是种子中群落组装的终点,也是新幼苗中群落组装的起点。植物种子随着储藏年限的延长,细菌的种群数量会相应缩减[27],这就说明在存储中植物种带细菌会死亡,而革兰氏阴性细菌死亡后将裂解出脂多糖,本试验证明脂多糖处理紫花苜蓿后,紫花苜蓿根系的细菌种群和种子的细菌种群表现出多样性差异。这可能是脂多糖处理紫花苜蓿后根瘤菌种群数量由种带细菌中的1.05×106cfu·g-1增加至根系中的6.98×107cfu·g-1,相应占据了紫花苜蓿根系中更多的生态位,从而影响了部分其它细菌在紫花苜蓿根部的生长。植物种子和根系中的细菌多样性差异也可能是由于传统培养方法存在局限性,不能充分展示紫花苜蓿内生细菌的多样性[28],应进一步利用微生物组学方法进行研究。但至于脂多糖是如何调控植物种子中细菌菌群的多样性进而影响储藏年限和萌发,均需进一步的试验探究。
3.2 CQ10-LPSp对紫花苜蓿根系内生根瘤菌数量的影响
大多数植物都有高功效的PAMP感知系统,能迅速启动PTI信号传导,诱发免疫反应。细菌PAMP主要有鞭毛蛋白、热不稳定延伸因子、脂多糖、冷激蛋白和harpin蛋白。PAMP激活的免疫反应包括早期氢离子、钙离子内流和钾离子外流,迅速激活下游的MAPK信号级联反应,诱导ROS爆发、被侵染部位细胞壁上的胼胝体的沉积,以及免疫反应基因表达等一系列防卫反应[15]。这一系列免疫反应在调控植物周围环境的微生物种类和组合中起着重要作用[18],且细菌的PAMP和植物PRR的多样化组合也是调控与不同细菌互作的一个关键因素[29]。本试验结果显示,不同浓度CQ10-LPSp处理‘巨能551’后紫花苜蓿的结瘤现象不同,对其根系内生根瘤菌数量影响也不同。随着CQ10-LPSp浓度的增大,内生根瘤菌的数量先上升后下降,且在0.267 0 EU·mL-1CQ10-LPSp下达到最大,且紫花苜蓿根有结瘤。以往研究表明,革兰氏阳性和阴性细菌的细胞壁的成分肽聚糖能够特异性识别含有Lysin基因序列的细胞表面受体(受体样激酶LYKs和受体蛋白LYPs),从而触发宿主的先天免疫反应[30]。脂多糖具有和肽聚糖在植物免疫调节上类似的功能[14],是与植物受体识别后而激发的结瘤等免疫响应有关。然而,截至目前除了拟南芥外的其它植物识别细菌脂多糖的受体尚未被鉴定[31]。一方面,紫花苜蓿根系中的根瘤菌种群数量增加是保证根系结瘤的物质基础;另一方面,根瘤菌种群数量的提升也相应影响了植物根系周围环境的细菌种类及数量;两者相互制约且相互调控。CQ10-LPSp对中华根瘤菌属在紫花苜蓿结瘤过程中的作用及其机理需要进行进一步的研究。
4 结论
本试验研究了CQ10-LPSp对紫花苜蓿细菌多样性及其根瘤菌的影响,结果表明随着CQ10-LPSp浓度的增大,紫花苜蓿内生根瘤菌的数量呈先升高后降低的变化趋势,在0.267 0 EU·mL-1CQ10-LPSp下根瘤菌数量最高,为6.98×107cfu·g-1,该浓度下内生肠杆菌属的细菌株数增多,假单胞菌属株数减少,整体根系内生细菌种类较种带可培养细菌多样性减少。综上所述,CQ10-LPSp会影响幼苗内生细菌的多样性及数量,且能增加内生根瘤菌的数量。
