紫花苜蓿/燕麦间作对燕麦碳、氮代谢及其物质积累的影响研究
2021-11-09刘晓静赵雅姣
汪 雪, 刘晓静, 赵雅姣, 王 静
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
间作是我国传统农业生产中一种极其普遍和重要的多元种植技术,与单一种植模式相比,间作具有明显的产量优势,尤其是豆科与禾本科作物间作。豆科与禾本科作物间作能最大限度地激发作物对有限农业资源的利用潜力[1],活化根际土壤中难溶性的磷和铁[2]以及防控病虫草害[3]等,让整个系统形成一种可持续的生产体系,进而显著提高群体作物土地利用率,以达到增产保产的目的。大量研究表明,豆科与禾本科作物进行间作的模式丰富,且主要集中应用在两种及以上粮食作物之间,如小麦(Triticumaestivum)/蚕豆(Viciafaba)[4]间作可以改善蚕豆微生态环境,减少蚕豆锈病的发生;花生(Arachishypogaea)/玉米(Zeamays)[5]间作可以改善花生体内的铁营养,提高其净光合速率等。随着我国人民食物结构的改变,我国粮食需求已基本满足,饲料相对匮乏,豆/禾间作被认为是一种可减缓饲草供应危机的有效途径之一[6],对于解决当前畜牧产业发展中饲料供给匮乏问题及实现农牧业安全、高效发展具有重要意义。
碳氮代谢作为植物体内最主要的两大生理代谢过程,其直接决定着作物的品质和产量[7]。碳代谢保障着无机碳的光合固定代谢及糖代谢,氮代谢维持着含氮化合物的合成与分解等,但两者并非是2个独立运转机制。Huppe等[8]研究表明,碳、氮代谢所需的能量及其中间产物大部分来源于光合作用,其中,氮代谢消耗掉的光合作用能量可达55%;吕腾飞等[9]研究发现,杂交籼稻(Oryzasativasubsp)的氮代谢途径相关酶与代谢产物会受到碳代谢相关产物的反馈制约,可见,植物体内的碳氮代谢是相互偶联相互制约的。在植物的生长发育过程中,碳氮代谢及其产物的合成会受到诸多因素影响[10-12]。张嘉雯等[12]研究发现不同种植密度会改变雪茄烟叶(Cigarro)碳氮代谢相关酶活性及其代谢产物;罗凯等[13]研究表明外源喷施植物生长调节剂会增强与玉米套作的大豆(Glycinemax)叶片碳代谢酶活性,加强其碳水化合物的合成及转运;焦念元等[14]在玉米/花生间作的研究中发现增施氮磷肥有利于群体作物功能叶片硝酸还原酶和谷氨酰胺合成酶活性的提高。以上对于碳氮代谢的研究都只集中在粮食作物间套作、施肥效应及种植密度上,而对间套作模式下牧草作物的碳氮代谢研究很少。
紫花苜蓿(Medicagosativa)作为一种重要的植物性蛋白资源,可制作成优质的粗饲料,为我国畜牧产业可持续健康发展提供重要物质保障。燕麦(Avenasativa)作为一年生粮饲兼用型作物,其种植面积居世界第六位[15],是我国冬季牧场极为重要的饲料来源[16]。用紫花苜蓿与燕麦进行间作种植不仅增加强豆科牧草的根瘤菌固定的氮素供禾本科牧草利用,而且还能提高饲草产量和品质及获得良好的生态效益[17]。优质牧草饲料的不足一直是我国畜牧业发展的重要限制因素之一,紫花苜蓿和燕麦作为我国畜牧业主要生产区的两大重要饲草作物,其产量与品质的形成与碳氮代谢密切相关,只有协调好碳氮代谢才能保证饲草产量和蛋白质含量的同步增长。为此,本试验以紫花苜蓿与燕麦模拟间作为基础,旨在揭示豆/禾间套作模式下饲草作物的碳氮代谢及其产物积累变化规律,为提高饲草产量和品质、促进畜牧业高效发展提供理论依据。
1 材料与方法
1.1 供试材料
紫花苜蓿‘LW6010’由北京猛犸种业有限公司提供,燕麦‘海威’由北京克劳沃公司提供。
1.2 试验设计
试验在甘肃农业大学牧草试验基地的防雨网棚内进行。本试验采用桶栽土培法来模拟间作,即紫花苜蓿与燕麦栽植于高为45 cm,直径为50 cm的塑料桶中,该塑料桶中所用的土样均来自甘肃农业大学牧草试验基地,此基地土壤的pH为8.23,0~25 cm土层基础养分含量为:有机质12.23 g·kg-1,全氮0.81 g·kg-1,碱解氮81.24 mg·kg-1,速效磷15.22 mg·kg-1,速效钾118.12 mg·kg-1。试验采用3种种植模式,即:紫花苜蓿单作(SA),燕麦单作(SO),紫花苜蓿与燕麦间作(A/O),每个处理重复3次。试验先将紫花苜蓿栽植于备好土的塑料桶中,间作则将紫花苜蓿栽植于桶的一侧,后期间苗时紫花苜蓿单作每桶留20株,间作每桶留10株。待紫花苜蓿出苗2天后,对燕麦进行催苗使其露白,随后再将其均匀移入间作桶的另一侧,燕麦单、间作每桶所留株数与紫花苜蓿相同。燕麦出苗前每天用喷壶浇3次水,保持土壤的正常湿度;待燕麦出苗后,每3天浇一次水,确保燕麦和紫花苜蓿的正常生长。该试验分别于2017年6月13日(紫花苜蓿分枝期),7月5日(紫花苜蓿现蕾期)和7月18日(紫花苜蓿初花期)进行取样,取样时直接将待测样品(包括桶)运至实验室,然后从桶栽植株上选取叶片及根进行测定,其中,叶片碳氮代谢关键酶活性和碳水化合物含量的测定位点与测定光合位点相同,均需在牧草的功能叶上进行,紫花苜蓿选取顶叶向下第3片完全展开的健康完整叶片,燕麦选择旗叶。
1.3 测定指标
干物质重:取样后置于105℃烘箱下杀青25 min,之后再将烘箱调至85℃烘干36 h至恒重,称其干质量。
气体交换参数:使用GFS-3000便携式光合系统分析仪(Walz,Germany)于晴天的上午9:00-11:00对功能叶片进行净光合速率(Net photosynthetic rate,Pn)、蒸腾速率(Transpiration rate,Tr)、气孔导度(Stomatal conductance,Gs)和胞间CO2浓度(Intercellular CO2concentration,Ci)等指标的同步测定[18],每种牧草随机选取5片功能叶,各重复3次。
核酮糖-1,5-二磷酸羧化酶(Ribulose-1,5-bisphosphate carboxylase,RuBPCase)活性:用上海杰美科技有限公司生产的RuBP ELISA试剂盒测定,单位为μmol·g-1·min-1。
碳水化合物积累量:为干物质与碳水化合物含量的乘积,碳水化合物含量采用向阳等[19]的方法测定。
硝酸还原酶(Nitrate reductase,NR)、谷氨酰胺合成酶(Glutamine synthetase,GS)活性参照邹琦[20]的方法测得。NR活性单位为μg·g-1·h-1,GS活性单位为μmol·g-1·h-1。
粗蛋白含量:先用凯氏定氮法[21]测定氮含量,粗蛋白含量=氮含量×6.25。
蛋白积累量:为干物质与粗蛋白含量的乘积。
1.4 数据分析
用Excel 2010软件进行试验数据的整理后,采用SPSS 19.0软件进行单因素方差分析。
2 结果与分析
2.1 紫花苜蓿/燕麦间作下的干物质量
间作燕麦地上、地下干物质重在分枝期时,与单作燕麦无显著性差异。燕麦地上干物质重在现蕾期和初花期时,间作燕麦与单作燕麦相比分别增加了15.41%和19.13%,燕麦地下干物质重在现蕾期和初花期时,间作燕麦与单作燕麦相比分别增加了39.53%和47.38%,均呈显著性差异(P<0.05)。紫花苜蓿地上干物质重除分枝期外,均表现为单作紫花苜蓿显著大于间作紫花苜蓿(P<0.05);紫花苜蓿地下干物重在3个时期内,均表现为间作紫花苜蓿显著低于单作紫花苜蓿(P<0.05)(图1)。

图1 不同种植模式下紫花苜蓿与燕麦的干物质重Fig.1 Dry weight of alfalfa and oat under different planting patterns注:SA,SO,IAO,IOA表示紫花苜蓿单作、燕麦单作、与燕麦间作的紫花苜蓿、与紫花苜蓿间作的燕麦。不同小写字母表示不同种植模式之间差异显著(P<0.05)。下同Note:SA,SO,IAO,IOA are sole alfalfa,sole oat,alfalfa intercropped with oat,oat intercropped with alfalfa,respectively. Different lowercase letters show significant differences between different planting patterns at the 0.05 level. The same as below
2.2 紫花苜蓿/燕麦间作下的碳代谢特性
2.2.1光合特性 在3个时期下,间作紫花苜蓿蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(GS)均显著低于单作紫花苜蓿(P<0.05),紫花苜蓿胞间CO2浓度(Ci)除分枝期外,均表现为单作紫花苜蓿显著大于间作紫花苜蓿(P<0.05)。
在分枝期时,间作燕麦蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(GS)相比于单作燕麦分别提高了16.77%,16.42%和16.09%(P<0.05);在现蕾期时,间作燕麦蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(GS)相比于单作燕麦分别提高了11.55%,17.11%和22.45%(P<0.05);在初花期时,间作燕麦蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(GS)相比于单作燕麦分别提高了11.76%,14.25%和19.19%(P<0.05)。在3个时期下,间作燕麦胞间CO2浓度(Ci)显著低于单作燕麦(P<0.05)(表1)。

表1 不同种植模式下紫花苜蓿与燕麦的光合特性Table 1 Photosynthetic characteristics of alfalfa and oat under different planting patterns
2.2.2核酮糖-1,5-二磷酸羧化酶(RuBPCase) 燕麦地上核酮糖-1,5-二磷酸羧化酶(RuBPCase)活性在3个时期内,均表现为间作燕麦显著大于单作燕麦(P<0.05),且相对于单作燕麦分别提高了7.33%,7.90%和3.77%。在3个时期下,间作紫花苜蓿地上核酮糖-1,5-二磷酸羧化酶(RuBPCase)活性与单作紫花苜蓿无显著性差异(图2)。

图2 不同种植模式下紫花苜蓿与燕麦的RuBPCase活性Fig.2 RuBPCase activity of alfalfa and oat under different planting patterns
2.2.3碳水化合物积累量 在3个时期下,间作燕麦地上碳水化合物积累量与单作燕麦比分别增加了29.62%,38.87%和41.63%(P<0.05)。紫花苜蓿地上碳水化合物积累量在分枝期和初花期时,均表现为间作紫花苜蓿与单作紫花苜蓿之间无显著性差异,在现蕾期时,表现为单作紫花苜蓿显著大于间作紫花苜蓿(P<0.05)(图3)。

图3 不同种植模式下紫花苜蓿与燕麦的碳水化合物积累量Fig.3 Carbohydrate accumulation of alfalfa and oat under different planting patterns
2.3 紫花苜蓿/燕麦间作下的氮代谢特性
2.3.1硝酸还原酶(NR) 在3个时期下,间作燕麦地上硝酸还原酶(NR)活性与单作燕麦相比分别增加了8.80%,11.94%和10.40%,间作燕麦地下硝酸还原酶(NR)活性与单作燕麦相比分别增加了12.07%,18.14%和15.54%,均呈显著性差异(P<0.05)。紫花苜蓿地上硝酸还原酶(NR)活性在现蕾期和初花期时,均表现为紫花苜蓿单作显著大于紫花苜蓿间作(P<0.05);紫花苜蓿地下硝酸还原酶(NR)活性在3个时期下,均表现为紫花苜蓿单作显著大于紫花苜蓿间作(P<0.05)(图4)。

图4 不同种植模式下紫花苜蓿与燕麦的NR活性Fig.4 NR activity of alfalfa and oat under different planting patterns
2.3.2谷氨酰胺合成酶(GS) 在3个时期下,间作燕麦地上GS活性与单作燕麦相比分别增加了37.05%,16.12%和21.18%(P<0.05);在现蕾期和初花期时,间作燕麦地下GS活性与单作燕麦比,分别增加了4.41%和18.45%(P<0.05)。紫花苜蓿地上、地下GS活性在现蕾期和初花期时,均表现为紫花苜蓿单作显著大于紫花苜蓿间作(P<0.05)(图5)。
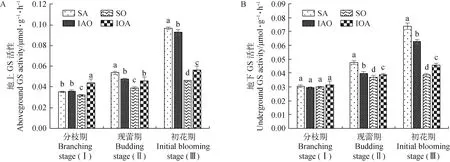
图5 不同种植模式下紫花苜蓿与燕麦的GS活性Fig.5 GS activity of alfalfa and oat under different planting patterns
2.3.3蛋白含量 在3个时期下,间作燕麦地上蛋白含量与单作燕麦比分别增加了36.13%,21.01%和16.71%(P<0.05);在现蕾期和初花期时,间作燕麦地下蛋白含量与单作燕麦比分别增加了20.79%和17.34%(P<0.05)。在分枝期和初花期时,单作紫花苜蓿地上蛋白含量均显著大于间作紫花苜蓿(P<0.05);在3个时期下,单作紫花苜蓿地下蛋白含量均显著大于间作紫花苜蓿(P<0.05)(图6)。

图6 不同种植模式下紫花苜蓿与燕麦的蛋白含量Fig.6 Protein content of alfalfa and oat under different planting patterns
2.3.4蛋白积累量 在3个时期下,间作燕麦地上蛋白积累量与单作燕麦比分别增加了46.14%,39.64%和38.95%(P<0.05);除初花期外,间作燕麦地下蛋白积累量与单作燕麦相比无显著性差异。紫花苜蓿地上、地下蛋白积累量在现蕾期和初花期时,均表现为紫花苜蓿单作显著大于紫花苜蓿间作(P<0.05)(表2)。
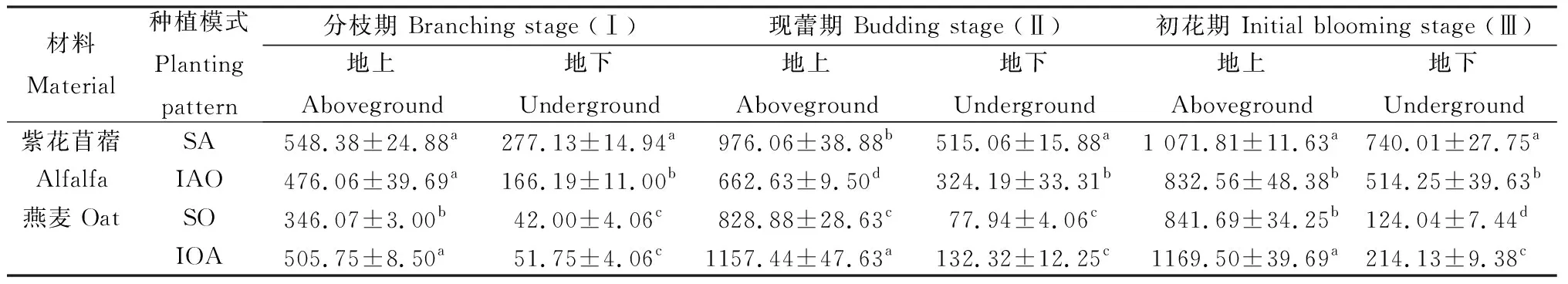
表2 不同种植模式下紫花苜蓿与燕麦的蛋白积累量Table 2 Protein accumulation of alfalfa and oat under different planting patterns 单位:mg·plant-1
3 讨论
植物的光合作用可为其碳、氮代谢提供所需的碳源及能量[22]。在植物的光合特性研究中,气体交换参数能直观反应出植物的光合能力。本研究发现,燕麦与紫花苜蓿间作可显著提高燕麦的蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(GS),降低燕麦的胞间CO2浓度(Ci),可能是当燕麦和紫花苜蓿间作时,燕麦作为豆禾间作系统中的优势主导作物,可截获更多的光能,提高其光系统光化学活性及光合电子传递,从而提高其光合能力。有研究证明,豆禾间作中禾本科作物功能叶片光合能力的提高源于其在间作时可享受边际优势[23]。可见,在豆/禾间作体系中,禾本科具有明显的优势地位,而间作方式会降低豆科作物的有效光强度。本研究中,间作紫花苜蓿蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(GS)均显著低于单作紫花苜蓿,这是由于紫花苜蓿与燕麦间作时,紫花苜蓿处于劣势地位,可捕获和利用的强光减少了,紫花苜蓿虽提升了自身对弱光的利用,但光合能力仍然会降低,在唐秀梅等[24]对花生/木薯(Manihotesculenta)间作体系的研究中也有此发现。此外,随着生育期的推进,间作燕麦的光合能力不断加强,可能是因为随着生育期的推进,燕麦的光合面积和冠层CO2浓度也随之增加,进而提高了燕麦的光合速率,为碳氮代谢提供了能量保障。
碳氮代谢作为植物体内最基本的生理代谢过程,其代谢强度和协调程度直接决定着植物的生长、发育及代谢能力[25-26]。RuBPCase作为一种光调节酶,可决定植物光合碳代谢方向和碳代谢效率,其含量和活性的高低与作物光合速率显著相关[27]。在本研究的间作系统中,间作燕麦的核酮糖-1,5-二磷酸羧化酶(RuBPCase)活性与上述所提到的光合气体交换参数步调一致,与单作燕麦相比,都表现出有显著增强的趋势,而单作和间作的紫花苜蓿差异不明显。可见,间作可有效改善群体作物对有效光能的截获,增加群体作物光照强度及群体冠层内CO2浓度,进而提高燕麦光合速率,提高碳同化酶RuBPCase活性,加强群体光合碳代谢效率。碳水化合物作为植物光合碳同化过程中的基础代谢物质及渗透调节物质,RuBPCase活性的提高也加速了C3过程中碳水化合物的合成[28-29],并可促进植物对铵态氮的同化。本研究中,与单作燕麦相比,间作燕麦的碳水化合物积累量显著提高,这可能是由于间作有效改善了燕麦根系构型及根系活力,加强了燕麦有机碳的同化固定及碳水化合物的积累、贮藏和转运。氮代谢是植物体内合成氨基酸和蛋白质的主要途径,NR和GS作为氮代谢过程的关键酶,NR在一定程度上反映了植物的氮同化能力;GS可与GOGAT偶联加快氮代谢运转以及氨基酸合成和转化[30]。在本研究的间作系统中,间作燕麦硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性显著高于单作,这是由于间作提高了禾本科牧草燕麦的光合速率,进而促进其旗叶内NR转录翻译及GS表达[31];同时,禾本科牧草燕麦作为间作体系中的优势主导作物,还能获得豆科植物紫花苜蓿通过生物固定的有效氮营养,进而提高其氮代谢酶活性和氮代谢水平。焦念元等[14]在玉米/花生间作体系的研究中也有类似发现。另外,间作中燕麦地上蛋白含量、蛋白积累量和干物质重均显著提高,也说明紫花苜蓿与燕麦间作有利于提高燕麦氮同化,增强间作系统内种间氮营养的互补利用,进而加速燕麦蛋白质的合成,提高其产量和品质,党科等[32]在糜子(Panicummiliaceum)/绿豆(Vignaradiata)间作研究中也得出了相似结论。此外,本研究还发现,随着紫花苜蓿与燕麦共生期的延长,燕麦的碳氮代谢明显增强,尤其是在紫花苜蓿现蕾期时燕麦的碳氮代谢最为活跃,加速了燕麦的生长发育,使其在间作中的紫花苜蓿现蕾期时表现出较高的生物量。
4 结论
与单作相比,紫花苜蓿与燕麦间作可显著提高燕麦光合速率,增强燕麦RuBPCase,NR和GS活性,进而提高燕麦碳、氮代谢水平,促进其对碳水化合物及蛋白质的积累,提高了间作燕麦的生物量和品质;且随着生育期的推进,燕麦碳氮代谢随之增强,尤其是在间作中的紫花苜蓿现蕾期时燕麦体内的碳氮代谢最为活跃。
