转hTERT 基因牛胎盘滋养层细胞生长及分泌特性研究
2021-11-09李茜茹李博宇苏运泽王春伟肖龙菲齐晓龙盛熙晖倪和民王相国
李茜茹,邢 凯,苏 月,李博宇,苏运泽,王春伟,郭 勇,肖龙菲,齐晓龙,盛熙晖,倪和民,王相国*
(1.北京农学院动物科学技术学院,北京 102206;2.新疆生产建设兵团第七师畜牧兽医站,新疆乌鲁木齐 830000)
胎盘是妊娠期间维持胎儿生长发育的器官,由胎盘滋养层细胞、毛细血管内皮细胞及二者之间的基膜构成[1]。早期绒毛组织中主要为滋养层细胞(Trophoblast Cell)[2],在胎盘发育中起着关键作用。滋养层细胞在桑葚胚时期形成,后分化形成细胞滋养层细胞(Cytotrophoblast Cells)和绒毛外滋养层细胞(Extravillous Trophoblast Cells,ETCs)。细胞滋养层细胞继续形成合体滋养层细胞,参与营养、分泌和代谢等过程[3];绒毛外滋养层细胞主要通过迁移和侵袭作用侵入子宫内膜,在胚胎附植、血管重塑[4]及胎盘形成等方面均有重要作用。因此,滋养层细胞异常形态及功能障碍往往是导致不良妊娠结局的诱因[5]。
王专家等[6]探索了绵羊多核绒毛膜滋养层细胞的体外分离培养方法并进行了细胞鉴定。赵志文等[7]采用联合消化法对牦牛胎盘滋养层细胞进行分离纯化,优化培养体系。目前很多研究通过体外培养获取该细胞后,继续传代培养依旧受到很大限制。端粒酶的过度表达与细胞癌变及细胞永生有关。有研究将人端粒酶逆转录酶(Human Telomerase Reverse Transcriptase,hTERT)基因导入正常细胞中,利用端粒酶异常表达,使细胞获得旺盛的增殖能力[8]。这一研究为导入hTERT基因延长细胞生长周期提供了可能。本研究尝试将外源hTERT基因导入原代牛胎盘滋养层细胞,使其获得更强的增殖能力,并通过多种方法鉴定其生物学特征,以获得更有效的体外培养细胞,从而为后续实验提供参考。
1 材料与方法
1.1 实验材料 完整妊娠 45~60 d 健康牛子宫采自河北省大厂县某屠宰场,妊娠时间根据胎儿的顶臀长度计算。
1.2 试剂与仪器 胎牛血清(杭州四季青公司),DMEM/F12 培养基(美国Hyclone 公司),Lipofectamine 2000(美国Invitrogen 公司),逆转录试剂盒(日本Toyobo 公司),BCA 蛋白定量检测试剂盒(北京Leagene 公司),兔抗牛角蛋白7 抗体、兔抗牛波形蛋白抗体、兔抗牛端粒酶抗体及兔抗牛E-钙黏蛋白抗体均(美国Abcam 公司)。引物均由上海生工生物工程技术服务有限公司合成。
CO2恒温细胞培养箱(美国Thermo 公司),荧光定量PCR 仪(美国ABI 公司),高速台式离心机(德国Eppendorf 公司),凝胶成像仪(美国Alpha Inotech 公司)。
1.3 牛胎盘滋养层细胞分离培养 取妊娠45~60 d 的完整牛子宫低温运输至实验室。清洗后在无菌环境下打开,取出完整胎盘放于含双抗的DPBS 液中清洗。剪下胎盘子叶,浸入75%酒精15~30 s,立即放入新的DPBS 缓冲液内清洗。处理好的胎盘组织剪碎至1~2 cm3置于细胞瓶内,于5% CO2、37℃培养箱内放置1 h 后,颠倒观察无脱落,向瓶内补加含双抗的20% DMEM/F12 完全培养基2 mL。于补液后24 h 和48 h 时进行细胞换液,之后每3 d 换液,至细胞爬出后进行纯化传代。弃去培养液,用DPBS 清洗后加入1 mL 胰蛋白酶,热台上放置1 min,细胞变圆有部分漂浮时加入完全培养基终止消化,移液枪轻吹至全部漂浮后移入离心管,1 500 r/min、5 min。弃上清,适量培养基重悬细胞,置入新培养瓶,培养箱内静置1 h,取上清液种入新培养瓶。
1.4pc1-neo-hTERT质粒纯化及鉴定 采用OMEGA 公司生产的Endo-free plasmid midi kit 按照说明书操作步骤进行质粒提取。利用Nanodrop 2000 紫外分光光度计检测质粒的浓度和纯度,分装于-20℃保存备用。
引物hTERT-F:5'-TATGCTGTGGTCCAGAAGG-3';hTERT-R:5'-CAAGAAATCATCGACCAAACG-3'。将提取的pCI-neo-hTERT质粒进行双酶切鉴定,酶切体系:1 μL 10×限制性内切酶缓冲液(Buffer H),0.5 μLEcoRI(12 U/μL),0.5 μLSalI(12 U/μL),0.25 μL BSA(10 mg/mL),4 μL DNA,3.75 μL ddH2O。涡旋仪充分混匀,37℃ 2 h,65℃ 10 min,加入2 μL 6×DNA 上样缓冲液,进行琼脂糖凝胶电泳分析。
1.5hTERT基因转染牛胎盘滋养层细胞 确定新霉素(G418)最佳筛选浓度。第2 代牛胎盘滋养层细胞接种于24 孔板,生长至70%~80%,加入不同浓度G418(100、150、200、250、300、350、400 μg/mL)筛选培养基,每个梯度3 个重复,培养基3 d 一换,选取2 周内杀死所有细胞的最小浓度。采用Lipofectamine 2000 Regent 转染试剂将pc1-neo-hTERT质粒导入原代细胞,含最佳筛选浓度G418(300 μg/mL)的DMEM/F12 培养基,待2 周后对照孔细胞全部死亡,递减G418浓度至获得单克隆细胞。利用Western Blot 检测hTERT基因表达情况。
1.6 免疫荧光检测各组细胞角蛋白7(CK7)将灭菌盖玻片置于6 孔板中,按1×105个细胞/孔接种,待细胞至70%~80%进行后续实验。弃液后DPBS 洗3 次,4% 多聚甲醛固定,室温30 min,0.1% TritonX-100 通透,室温10 min,1% BSA-PBS 封闭,室温30 min,弃液DPBS 充分清洗3 次,每次3 min,分别加入兔抗牛细胞角蛋白7 抗体(CK7,1:100)和兔抗牛波形蛋白抗体(Vim,1:100),4℃过夜。弃液DPBS 充分清洗,FITC 标记的鼠抗兔IGg(1:50)避光孵育,室温2 h,弃液DPBS 充分清洗,PI 染核10 min,弃液DPBS 充分清洗,用荧光显微镜拍照。
1.7 酶联免疫检测绒毛膜促性腺激素(CG)、胎盘催乳素(PL)收集细胞培养液,低温离心,分装保存于-20℃。实验开始前将各试剂平衡至室温,并充分混匀。设标准孔、空白孔、待测样品孔,按照ELISA 试剂盒说明书进行CG、PL 检测,均进行3 次重复。最后利用酶标仪在450 nm 波长测量各孔的光密度(OD 值)。
1.8 统计分析 数据采用软件Excel 2010 进行整理,对ELISA 检测获得的OD 值进行独立样本t检验,结果均以平均值表示。
2 结果与分析
2.1pc1-neo-hTERT质粒鉴定pc1-neo-hTERT质粒全长8 900 bp,hTERT基因片段长3 450 bp。利用EcoRI 和SalI 双酶切,琼脂糖凝胶电泳显示酶切片段与预期大小一致(图1),表明提取的质粒确为pc1-neohTERT质粒,且可用于细胞转染。

图1 双酶切法鉴定pCI-neo-hTERT 质粒
2.2 牛胎盘滋养层细胞形态观察 显微镜下观察培养的牛胎盘子叶组织块,第7 天开始,组织块周围迁出细胞,细胞形态多样,呈圆形、长梭形或不规则多边形,分布不均匀(图2-A);经差速贴壁法纯化后,大多数细胞轮廓清晰(图2-B、C),细胞在低密度时出现伪足(图2-D、E),密度增加至铺满后呈铺路石状,单层生长(图2-F),均匀分布,为上皮样细胞形态。观察发现转染前后细胞形态及生长状态均无变化,表明转染外源hTERT基因的牛胎盘滋养层细胞不受其影响。

图2 原代牛胎盘滋养层细胞与转染hTERT 基因细胞
2.3 转染前后细胞特征鉴定 通过Western Blot 检测,显示hTERT基因转染成功且能够正常表达(图3-A)。通过免疫荧光组化鉴定培养的原代牛胎盘滋养层细胞与转染后细胞均表达CK7(图3-B),且纯化分离的细胞没有成纤维细胞污染。

图3 转染前后细胞蛋白表达情况
2.4 转染前后细胞表达功能检测 通过酶联免疫检测方法对转染后细胞与原代牛胎盘滋养层细胞中分泌的CG和PL 检测结果显示,与原代细胞的分泌水平差异不显著(表1)。
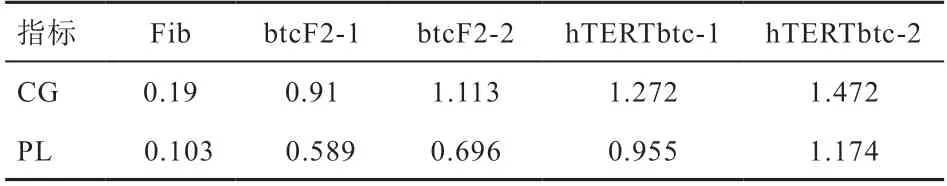
表1 转染前后细胞CG、PL 分泌情况
3 讨论
组织块培养法和胰蛋白酶消化法是目前原代细胞获取最常用的方法。Tzschoppe 等[9]采用胰蛋白酶-DNaseI酶联合消化法获得细胞悬液,又采用Percoll 密度梯度离心法获得纯度较高的人绒毛膜滋养层细胞。刘慧等[10]采用组织块法获得滋养层细胞,又用差速消化法获得纯度较高的绵羊绒毛膜滋养层细胞。王专家等[6]改良刘慧等[10]有关绵羊胎盘滋养层细胞的分离培养方法,用胰蛋白酶和胶原酶联合消化法会获得滋养层细胞,使细胞产量和质量有所提升。胰蛋白酶法获得的细胞液混杂有大量成纤维细胞、红细胞及其他细胞,对滋养层细胞的生长有限制。组织块培养法获得的细胞纯度更高,但耗时较长,通常10~20 d 才会出现细胞。本研究联合使用组织块培养法与酶消化法,获取的体外培养细胞纯度高、活性好,且耗时较短,培养第7 天即出现细胞。第二、三代原代细胞增殖效率快,细胞活性高,可用做大多数研究。但继续传代至五、六代时,细胞活性明显下降。孕早期的滋养层细胞随着妊娠过程的推进,其增殖分化能力逐渐下降。体外培养的细胞也出现可连续传代次数少或随传代细胞活性下降的问题。端粒是位于线性真核生物染色体末端的、重复DNA 序列和蛋白质组成的复杂核蛋白[11],可防止染色体降解并能修复DNA 复制过程中末端丢失序列[12-13],其合成由一个特殊的具有反转录活性的核糖核蛋白酶——端粒酶完成。端粒酶是RNA 模板和蛋白亚基组成的核蛋白颗粒,能解决染色体末端问题,该基因过度表达可使细胞获得更强的增殖分化能力。
本研究利用导入外源hTERT基因使细胞获得连续增殖分化的能力。转染后的细胞通过不断优化的培养体系,成功连续传至十五代以上,暂称为hTERT-btc 细胞株。经Western Blot 检测,hTERT基因成功转染且能够正常表达,相比原代细胞,hTERT-btc 细胞株端粒酶活性显著增加,细胞在连续传代过程中细胞活性保持良好。经荧光免疫检测,转染前后细胞中CK7 表达正常,无显著差异[14-15]。妊娠过程中,CG 和PL 的分泌是胎盘滋养层细胞的重要生物学功能之一。通过酶联免疫检测CG、PL 发现转染前后细胞分泌无显著差异[15]。胎盘滋养层细胞为上皮样细胞,体外培养的第二代btc 与第十五代hTERT-btc 均单层贴壁生长,低密度下伸出伪足相互接触,细胞呈多样性,密度增加逐渐形成铺路石样,呈典型上皮样细胞体外生长特点。胎盘滋养层细胞作为胎盘中的主要功能细胞,在整个妊娠过程中发挥重要作用,通过迁移、侵袭和内分泌等功能,在胎盘形成、妊娠建立与胎儿发育中起着关键作用。本实验结果表明转染hTERT基因后,细胞获得更强的增殖分化能力,且仍具有正常的生物学功能,CK7 正常表达,CG、PL 表达量处于正常范围。
胎盘是雌性哺乳动物在妊娠期间出现的重要临时性器官,早期的胚胎绒毛组织中,胎盘滋养层细胞可分化为2种:一是绒毛内滋养层细胞,包括细胞滋养层细胞和由其融合形成的合体滋养层细胞;二是绒毛外滋养层细胞,与子宫内膜紧密接触、侵入其中以保证胎盘稳固[16]。滋养层细胞通过分泌整合素、E-钙黏蛋白及免疫球蛋白超家族[17]等黏附因子对子宫内膜上皮细胞进行识别及黏附,诱导胚胎完成植入。另可分泌表皮生长因子(Epidermal Growth Factor,EGF)、转化生长因子(Transforming Gro wth Factor,TGF)和集落刺激因子(Colony Stimulating Factor,CSF)等细胞因子调节自身功能[18-20]。滋养层细胞分泌的CG 和孕酮(Progesterone,P)等可维持早期胚胎发育及妊娠建立,这些因子与母体激素联合作用,配合细胞强大的迁移、侵袭功能,对母体子宫内膜上皮进行黏附与侵入,最终完成血管重塑与胎盘建立。
本研究通过向原代胎盘滋养层细胞转染外源hTERT基因获得的细胞株,相较于其他同类细胞,具有稳定且增加的传代数和正常的生物学特性及生理功能,为后续相关研究提供了新的思路与方法,为更多实验提供参考。
