基于大数据的药物警戒研究:美国食品药品监督管理局的最新研究进展及对我国的启示
2021-11-09沈春英仇茂珍相小强
沈春英,仇茂珍,顾 萌,相小强,韩 冰,袁 静*
(1.复旦大学附属闵行医院药剂科,上海 201199;2.上海市闵行区市场监督管理局药化科,上海 201199;3.复旦大学药学院临床药学与药事管理系,上海 201203)
世界卫生组织(World Health Organization,WHO)对药物警戒(pharmacovigilance)的定义是:“发现、评估、理解和预防药品不良反应或其他任何药物相关问题的科学和活动”[1]。建立完善的药物警戒体系对健全药物监管法律、法规和体制,开展临床实践和公共卫生计划都极为必要。例如,由于数据分析等问题,罗非昔布在上市后5年才确认其心脏药品不良反应(ADRs)并撤出市场,导致了大量患者因心血管事件而猝死。有研究表明,如果可以采集1亿名使用罗非昔布的患者信息,在3个月内即可发现该药物诱发心血管疾病的风险[2]。该事件也引起了人们对大数据用于药物上市后监测的重视。
近年来,随着电子信息技术的发展,基于大数据的药物警戒研究成为可能。自20世纪90年代以来,电子病历(electronic medical record,EMR)系统已在美国和欧洲部分国家逐渐普及,使获取医疗大数据成为可能。EMR是典型的大数据,通常包括数百万人的医疗信息,符合大数据的“5V”特征,即体量大(volume)、生成速度快(velocity)、多样性(variety)、价值性(value)和真实性(veracity)。
本文旨在介绍美国食品药品监督管理局(Food and Drug Administration,FDA)在药物警戒领域的最新研究动向,为我国药物警戒系统的完善提供启示和参考。
1 美国FDA的药物警戒系统
美国药物警戒工作由FDA的药品审评与研究中心(Centre for Drug Evaluation and Research,CDER)负责,采用主动和被动相结合的方法监测ADRs。美国药品不良事件报告系统(FDA adverse event reporting system,FAERS)主要收集来自MedWatch自愿报告系统的数据和医药企业强制上报的数据[3]。除了用于自发报告的数据库外,FDA近年来还通过其他数据来源,主动收集ADRs数据。
自2008年5月起,FDA启动了“哨点倡议(sentinel initiative)”[4]。“哨点倡议”旨在探索利用大型电子病历信息库进行药物警戒研究的可行性,以及作为现有被动监测体系(FAERS)的有效补充。在“哨点倡议”成功后,FDA于2016年2月正式建立“哨点系统”。哨点系统中电子健康数据(electronic health records, EHRS)的主要来源是医疗保险账单,其次来自医疗记录。目前,其多站点分布式数据库是世界上最大的用于医疗器械安全性评估的数据库。根据FDA对哨点系统最新的战略规划,还将尝试纳入国家患者中心临床研究网络(PCORnet)等其他数据源[5],旨在应用大数据等开发哨点系统的新功能。
在哨点系统中,FDA通过“主动风险识别与分析(active risk identification and analysis,ARIA)”系统来收集贯穿药品全生命周期的安全信息,并根据其优先等级进行分类,最后自动识别安全问题。哨点实施中心会将FDA筛选的安全问题制成单一的分析程序,继而交给其合作机构。目前,该中心已有18家合作机构,包括医院、大学、政府等非盈利科研机构。合作机构会在各自独立的分布式系统中提取相关数据并独立进行分析与评估。在独立的分析过程中,各机构利用通用数据模型(common data model,CDM)实现以相同的标准化计算机程序对数据进行处理。各合作机构所得的分析结果由哨点实施中心进行标准化处理后进一步综合处理和评估,最后反馈给FDA,由FDA决定是否将评估结果向公众发布以及是否采取进一步的行动。该风险信号评估流程的优势是,分布式数据系统和通用数据模型可以在最大限度地保护患者的个人信息的基础上,同时整合各个科研机构在数据分析上的优势,以保证数据分析的准确性和高效性。截至2018年,哨点系统已分析了超过3亿人的数据,成为FDA上市药物安全性监测工具库的核心,对保障公众用药安全,提高公众的生活质量具有重要意义[6]。
2 我国的药物警戒系统研究现状
2016年,我国启动了ADRs监测哨点建设试点工作。经过不懈的努力,我国的药物警戒工作已初显成效。2019年8月,我国新修订的《中华人民共和国药品管理法》首次将药物警戒制度写入法律,标志着我国药物警戒制度的建设与发展进入新篇章。但与美国和欧洲部分国家相比,仍存在一定的差距。2019-12-01,新修订的《中华人民共和国药品管理法》正式施行,标志着我国药品管理进入新时代。在新版《中华人民共和国药品管理法》中,第十二条第二款中明确规定了“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制”。该制度立足于药品全生命周期的全方位药品安全监管制度,其建立健全是我国医药产业与国际接轨的刚需。2020年1月,国家药品不良反应监测中心组织制定的《上市许可持有人药品不良反应报告表(试行)》发布。2020年6月,为确保有效开展药品上市后ADRs及其他与用药有关的有害反应的监测、识别、评估和控制工作,国家药品不良反应监测中心发布《药物警戒委托协议撰写指导原则(试行)》。药物警戒相关法律的相继颁布,意味着我国对药物警戒工作的重视程度提升,将不断推进药物警戒制度的建设与发展。同时,药物警戒制度的入法,也对药品安全监管提出了全新的挑战。
我国药物警戒系统的机构设置可分为行政组织和技术组织。行政组织即国家药品监督管理局和地方药品监督管理局,技术组织即国家药品不良反应监测中心和34个省级药品不良反应监测中心。目前,我国也已初步形成主动和被动相结合的监测系统, 主动监测平台是药品不良反应监测平台,被动监测平台是中国医院药物警戒系统(Chinese hospital pharmacovigilance system,CHPS)。药品不良反应监测平台分为四级,分别为国家、省、市和县。这种层级分明、层层上报的机构设置符合我国幅员辽阔、人口众多的国情。根据国家药品监督管理局最新发布的《国家药品不良反应监测年度报告(2020年)》,2020年全国ADRs监测网络收到ADRs报告共计167.6万份,相较于2019年的151.4万份有较大提升[7]。截至2020年底,我国ADRs报告累计达到1687万份。在县级ADRs报告比例方面,相较于2019年的97.4%,2020年增加为98.3%;报告人职业中,非医药从业者占比从2019年的5.8%上升至2020年的6.3%,反映了我国ADRs监测工作发展良好,药物警戒意识普及率提高。
我国在2016年成立了基于CHPS的哨点联盟。该联盟旨在打造一个药品安全智能监管平台,对真实世界的药品安全性进行更为科学的预测和分析。CHPS 主动采集哨点医疗机构报告的ADRs,解决了以往上报模式中存在的漏报率高、信息不完整等缺点,实现了对医疗机构ADRs信息的线上生成、审核、上报、反馈和分析。目前,全国已有366家医疗机构加入了该联盟。美国FDA和中国国家药品监督管理局对ADRs的监测模式见表1。
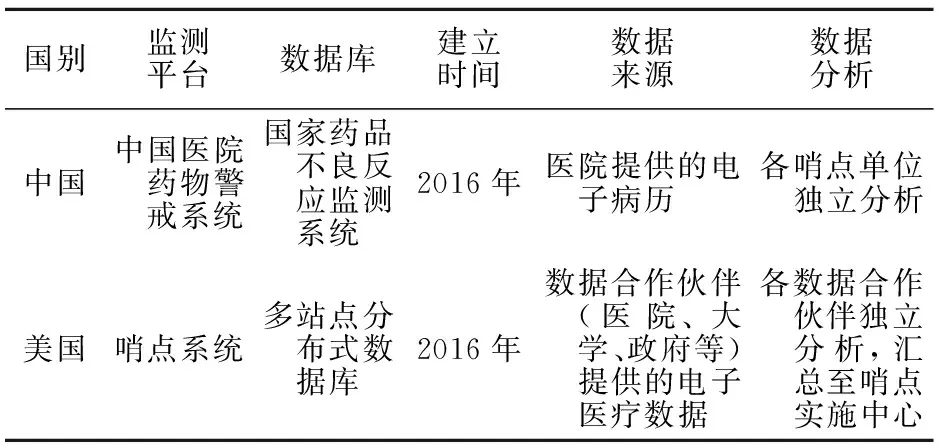
表1 美国食品药品监督管理局和中国国家药品监督管理局的主动监测模式比较
现阶段,我国药物警戒工作面临的挑战主要是三个方面:数据质量问题、数据分析能力和与国际接轨的挑战。(1)数据质量问题:高质量的ADRs报告是对药物安全性数据进行科学分析、获得安全性信息并采取相应措施的重要条件。现阶段,由于我国大多数药企的药物警戒体系建设还处于初级阶段,所报告的ADRs存在专业术语不规范、信息缺失以及数据的可溯源性差等不足。(2)数据分析能力:目前,我国在药物警戒工作中的主要着力点还集中在ADRs数据的采集,对数据的分析关注较少。国家药品监督管理局近年来已积累了海量的ADRs数据,但在对这些大数据进行有效的数据挖掘并采取及时的药品风险预测方面还需要进一步的提升。(3)与国际接轨的挑战:我国的ADRs报告来源于不同的医疗机构和药企,由于缺乏统一的信息填写标准,影响了对多方数据的整合分析以及与外国药物警戒系统数据的分享交流。在统一标准的前提下,获得更多的ADRs数据是发现某种药物罕见、严重ADRs的重要途径。
3 小 结
美国的哨点系统在药物警戒方面的成功是基于高水平的、不断发展的数据挖掘和分析系统。因此,针对我国药物警戒数据库在哨点数目、上报范围、数据来源等方面存在的问题有以下几点建议。
3.1 扩大覆盖面 2016年,哨点联盟的建立弥补了我国在药物警戒主动监测方面的缺乏,但在人口覆盖率上还存在不足。美国哨点系统覆盖率在2017年就已超过美国人口的一半[8]。虽然我国目前哨点联盟所包含的医疗机构已有366家,但人口覆盖率仍较低,不足以解决我国众多人口中存在的用药安全性问题。因此,未来应呼吁更多的哨点机构加入,并纳入国内现有的医疗卫生数据库来增加药品安全信息数据量,从而提高药品安全性监管及风险预测的准确性。
3.2 增加数据来源 FDA的经验显示了将多个数据源结合起来进行药物警戒研究的巨大潜力。尽管如此,整合多个数据库是极富挑战性的,需要一定的专业知识。美国最近的经验提供了如何从不同数据库中提取、处理和存储统一数据的范例,以及在进行多数据库安全分析时应该采用哪种工作模式,如何解释结果等[9]。
3.3 加强数据分析能力 目前,CHPS系统主要侧重于不良事件(adverse event, AE)上报,虽大幅提高了上报率,但在数据分析方面还有所欠缺。正在开发的CHPS v2.0系统将增加数据采集和清洗、信息脱敏和上报、分析及管理等功能,有望提高数据分析能力。同时,现有的数据分析模式是各个哨点独立进行,因此较难监测不常见的ADRs。相比之下,美国FDA能够根据各哨点提供的ADRs信息,筛选出高度可疑的ADRs,并整合全国的科研力量专攻特定的安全问题,更加高效。因此,我国应加强各哨点之间的数据共享,建立分布式数据系统。除此之外,我国还应尝试引入多学科交叉科研团队,如美国哨点项目中有保险公司、高校、医院和研究机构,鼓励团队将大数据和数据科学领域的最新进展应用于药物警戒研究。
3.4 与国际接轨 2017年,医渡云和重庆医科大学成立了我国首个医学大数据研究院,开启了国内医疗领域对大数据利用的探索。在此发展方向上,对EMR进行规范化管理非常重要。2017年6月,我国国家药品监督管理局加入了国际人用药品注册技术协调会(ICH)。因此,全力推进ICH各项指导原则,尤其是将EMR以E2B(R3)格式录入数据库,不仅是提升ADRs监测的关键点,也是与国际药物警戒系统进行数据交流的前提。采取标准化EMR后,我国哨点联盟可以借鉴美国经验,实行分布式管理模式,各哨点单位独立管理各自数据库,设立国家数据管理中心再对其进行统一管理,以实现ADRs信息的高效、规范化处理。
