2010-2019年我国医疗器械召回情况分析
2020-09-10孙曼



摘要:目的 探讨自《医疗器械召回管理办法(试行)》发布至《医疗器械召回管理办法》正式实施以来,我国医疗器械召回实施情况及提出相关建议以供参考。方法 收集2010年5月18日至2019年12月31日国家药品监督管理局官方网站“医疗器械召回”栏信息,在召回产品、数量、分级、进口、国产等方面,运用excel进行数据分析。结果 医疗器械召回数量呈明显上升趋势;有效数据与总召回数据存在差异,需规范召回信息发布;召回级别分类越来越明确;进口和国产医疗器械数量明显增长,国产医疗器械召回占比呈增长趋势。结论 医疗器械召回已初见成效,还需要不断完善规章制度,加强企业主动召回意识,以确保医疗器械安全使用。
关键词:医疗器械;国家药品监督管理局;召回;质量管理
2011年7月1日,我国开始实施《医疗器械召回管理办法(试行)》;2017年5月1日《医疗器械召回管理办法》正式实施(以下简称《召回办法》),同时《医疗器械召回管理办法(试行)》废止。《召回办法》中规定,本办法所称医疗器械召回,是指医疗器械生产企业按照规定的程序对其已上市销售的某一类别、型号或者批次存在缺陷的医疗器械产品,采取警示、检查、修理、重新标签、修改并完善说明书、软件更新、替换、收回、销毁等方式进行处理的行为。本办法所称存在缺陷的医疗器械产品包括:(一)正常使用情况下存在可能危及人体健康和生命安全的不合理风险的产品;(二)不符合强制性标准、经注册或者备案的产品技术要求的产品;(三)不符合医疗器械生产、经营质量管理有关规定导致可能存在不合理风险的产品;(四)其他需要召回的产品。
根据医疗器械缺陷的严重程度,医疗器械召回分为:一级召回:使用该医疗器械可能或者已经引起严重健康危害的;二级召回:使用该医疗器械可能或者已经引起暂时的或者可逆的健康危害的;三级召回:使用该医疗器械引起危害的可能性较小但仍需要召回的。
本文收集2010年5月18日至2019年12月31日国家药品监督管理局官方网站“医疗器械召回”栏信息,在召回产品、数量、分级、进口、国产等方面,运用excel进行数据分析,了解我国医疗器械召回实施情况及提出相关建议以供参考。
1.资料与方法
统计2010年5月18日至2019年12月31日国家药品监督管理局官方网站“医疗器械召回”栏信息,汇总数据见表1,包括各年份总数据、剔除重复和无效信息后的有效数据,产品召回级别分为:一级召回、二级召回、三级召回、未分级,按产品是否进出口分为进口、国产两类进行统计分类,运用excel进行数据分析。
2.结果及讨论
2.1召回数量
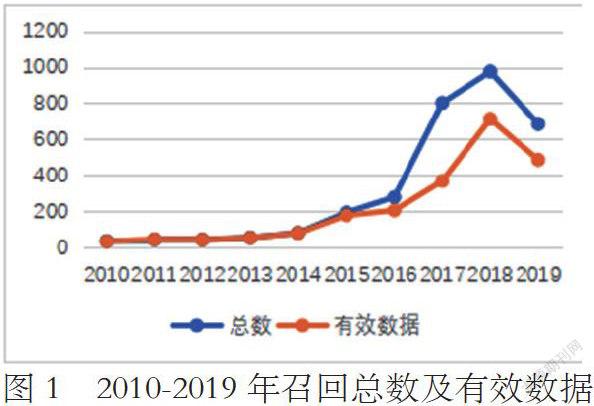
我国的医疗器械实际召回起始于2010年5月18日,2011年5月20日发布《召回办法(试行)》至2014年,召回数量增长缓慢,2010年至2014年有效召回数据分别为34例、45例、43例、54例、80例,且以进口产品为主;从2015年开始药监局加强医疗器械飞行检查力度,至《召回办法》在2017年5月1正式实施,2015年至2017年,医疗器械有效召回数据为178例、206例、369例,有小幅增长;《召回办法》正式实施1年后,2018年召回数量达到高峰,有效召回数量为713例,2019年召回数据有所降低,有效召回数量为486例,可见《召回办法》自正式实施以初见成效(详见图1)。
2011年7月1日,我国开始实施《医疗器械召回管理办法(试行)》,借鉴药品召回制度,该管理办法从监管机制、召回分级、法律责任等方面确立了医疗器械的召回制度。2017年5月1日,《医疗器械召回管理办法》正式实施,标志着我国医疗器械召回机制形成了完整体系,并且已初见成效。
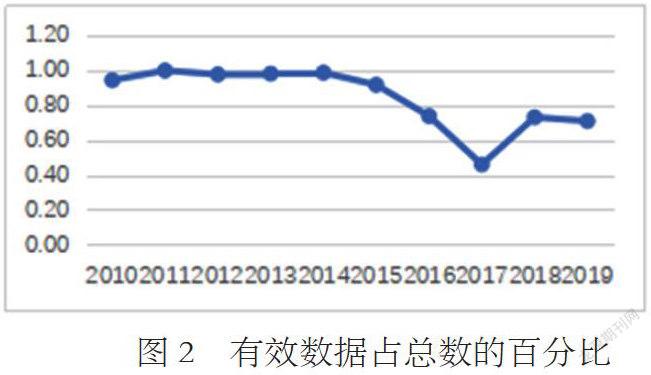
2010-2019年,医疗器械召回总数与实际有效数据存在差距,有效数据占总数的百分比依次为94%、100%、98%、98%、99%、92%、74%、46%、73%、71%,随着召回数量的增加,有效数据占召回总数的百分比呈下降趋势,其中2017年召回总数802例,有效数据369例,有效数据百分比46%(详见图2),召回信息的公布有待进一步规范。
《召回办法》第九条规定,监管部门应当按照医疗器械召回信息通报和信息公开有关制度,采取有效途径向社会公布缺陷产品信息和召回信息。建议监管部门强化召回信息公告制度、规范信息发布的形式与内容,制定科学合理召回原因归类标准,并进行持续反馈与评估机制以确保召回效果。
2.2召回级别
2010-2013年未对医疗器械召回进行明确分级,除2012年有5例一級召回外,其他均未进行分级,未明确分级占召回总数百分比为100%、100%、88%、100%;2014-2018年分类逐渐明确,未分级数据逐渐减少,2019年未分类数据为0,2014-2019年未分级占召回总数的百分比为76%、33%、22%、6%、1%、0%(详见图3);在分级召回数据中,三级召回最多,其次是二级召回,一级召回最少(详见图4)。
自2017年起,未分级的医疗器械明显减少,这相较于此前的试行版本,本次《召回办法》落实了医疗器械召回的责任主体,即境内医疗器械产品注册人或者备案人,或者进口厂商的境内代理人,也明确了生产企业需要主动召回的、存在缺陷的医疗器械产品范围,强化了召回信息公开要求等。
《召回办法》中重要的一点,是将召回分为I、II、III级三个级别,这依据的是医疗器械潜在风险的严重程度,级别越小,严重程度越高。并对国内医疗器械企业提出了更高的要求,即“确认需要召回的情况”时,企业必须根据召回级别与医疗器械的销售、使用情况科学设计召回计划并组织实施。换句话说,“这将彻底终结以往本土医疗器械企业即便出现质量问题也很少召回的现象,取而代之的是‘必须召回’,否则会受到法律的严厉制裁。”
2.3 进口与国产
2010-2011年召回地产品全部为进口产品,分别为34例、45例,2012-2019年进口医疗器械召回占主要部分,国产医疗器械召回占比呈逐渐递增趋势;2010-2019年国产医疗器械召回占总召回数量百分比依次为0%、0%、5%、2%、5%、4%、9%、22%、33%、26%(见图5、6)。
出现这种现象的原因主要表现在以下两方面:
2.3.1 国外医疗器械愿意耗费巨资主动召回产品主要包括以下两方面原因:首先,欧美国家早已建立起比较完善的医疗事故责任追溯制度,若医疗事故是因为医疗器械潜在风险引起的,医疗器械生产企业被勒令支付的赔偿金额要远远高于事故之前通过自查和主动召回而消除潜在风险的成本。其次,还要归因于产品召回险。美国很多保险公司设立产品召回险,承担投保人的部分召回费用和第三方责任,企业的召回成本大大降低。
2.3.2 在我国,国产企业对医疗器械的召回发布偏低。这里体现了国产厂商的一个思维误区:很多国产厂商觉得发布召回事件会对企业的品牌形象产生巨大影响,因此不愿发布召回信息。如果某产品被召回,公众肯定会认为产品质量出现大问题,甚至某些企业负责人在产品被“怀疑”时,首先担心的是市场份额是否会被竞争对手抢占。
目前,我国医疗器械企业主动发现问题并对问题产品进行召回的情况越来越普遍,这代表着我国医疗器械行业风险管理认知和管理水平在不断提高。
实际上,召回不单单指将产品从市场上撤回,而是包含了维护保养事项、检测结果准确性判断、客户投诉应对等很多内容。同时,对于成熟的市场而言,召回更像是售后服务的一部分,市场越成熟,越应有强烈的召回意识,这样才会推动企业在产品技术及安全性能上持续改进。这也从侧面体现了国产医疗器械与进口医疗器械在售后服务方面存在的差距——进口医疗器械把将召回产品当做客户投诉的积极处理方式之一,避免其他客户遇到类似情况,达到及时止损的目的,可以减少潜在损失,在可容忍范围内不仅不会影响品牌口碑,反而有促进作用。然而,涉及到真正的大批量产品回收销毁的召回事件,还是会对企业的口碑产生巨大的影响,并会让企业产生巨大损失,这是目前国产医疗器械厂商承受不住的,也是国产医疗器械企业不愿发布召回的原因之一。
医疗器械产品种类多、跨度大,产品等级、类型或型号不同,使用规范也各不相同,工作人员和患者如果对医疗器械产品了解不足,不规范使用甚至滥用医疗器械产品,会面临较大风险。因此,医疗器械的安全性尤为重要,加强从研制、生产到使用、报废的医疗器械全生命周期管理非常必要。行业特质决定召回在所难免。
医疗器械生产零部件较多、生产工艺复杂,不可避免的会出现瑕疵产品。企业在进行严格生产管控的同时,更应该积极产品上市后不良事件,发现问题后主动召回,这样才会全面降低医疗器械的使用风险,主动召回是负责任的体现。
由于我国目前缺少类似美国产品责任保险制度以及对召回涉及的成本、企业形象与社会舆论等方面考虑,相对于国内医疗器械的生产企业来说,国产企业召回主动性还是不足,建议监管部门发挥技术指导职能,在舆论上引导企业和公众对召回正确认识,运用大数据识别与防控风险,采取主动与被动行动和基于质量体系检查的上市后监管,并适实建立我国产品召回保险制度,多举措促进企业对问题产品召回
3.总结
召回事件是不良事件的报告的延续性工作,是医疗器械上市后监管的重要措施,能显著减少或消除缺陷医疗器械的风险和危害,以保证医疗安全。对召回事件密切关注并进行阶段性分析,可以帮助医疗器械上市后监管,提高技术监督支撑能力,保障医疗器械的安全使用。
总体来讲,医疗器械的质量监督管理和风险管理还需进一步加强,这需要国家层面、各层级医疗机构及医疗器械生产企业的共同努力,一起为保障医疗服务质量、推动国产医疗器械行业进步而奋斗!
参考文献:
[1]《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号).
[2]《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局令第1号)
[3] 张焕,洪源等. 2010_2018年我国医疗器械召回情况分析[J].中国医药导报,2020.17(2).48-51.
[4]张倩,冯靖炜,吕颖莹,等. 2018年上半年医疗器械召回情况探讨[J],中国医疗设备,2018,33(12):151-153,156.
[5]史超. 承担主体责任__有效控制风[J]. 中国医药报/2020 年/2 月/4 日/第 003 版.
[6]吴佳男.变被动为主动 器械召回办法实施.中國医院院长,29-31.
作者简介:孙曼(1987.6-),女,汉族,安徽,职务/职称:国际商学院在职人员高级课程研修班学员,学历:本科(研究生在读),单位:对外经济贸易大学,研究方向:企业管理。
